19.18 Elektrolityczne cynkowanie stali.
Celem ćwiczenia jest zapoznanie się ze zjawiskiem elektrolizy i właściwościami powłok cynkowych na stali.
Wykonanie ćwiczenia
1. Przygotowanie zestawu do elektrolitycznego cynkowania .
Zestaw składający się z wanny galwanizerskiej (1), miliamperomierza (2) i stabilizowanego zasilacza prądu stałego (3) połączyć w sposób pokazany na rysunku 1.
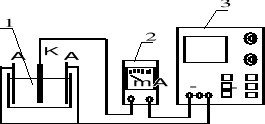
Rys. 1. Zestaw do elektrolitycznego cynkowania.
A - anoda; K - katoda.
Wannę galwanizerską napełnić kąpielą do poziomu zaznaczonego kreską .W skład kąpieli wchodzą: ZnSO4 - dostarczający jonów cynku, Na2SO4, i KAl(SO4)2 - regulujące przewodność i pH, dekstryna - dodatek blaskotwórczy.
Zanurzyć w kąpieli cynkowe anody.
2. Przygotowanie próbek stalowych i nakładanie powłok cynkowych.
Dwie próbki wykonane z blachy stalowej należy przed nałożeniem powłok przygotować w następujący sposób:
- oczyścić papierem ściernym
- przetrzeć oczyszczone powierzchnie watą
- posługując się suwmiarką wyznaczyć łączną powierzchnię poddawaną cynkowaniu
(pominąć powierzchnie boczne próbek)
- obliczyć natężenie prądu, umożliwiające prowadzenie procesu elektrolizy zgodnie z
podaną przez prowadzącego zajęcia katodową gęstością prądu. Natężenie prądu oblicza się ze wzoru:
I = S
gdzie : - katodowa gęstość prądu ( A dm-2 )
S - łączna poddawana cynkowaniu powierzchnia dwóch próbek ( dm2 )
- ustawić zgrubnie na zasilaczu wartość wyliczonego natężenia prądu ustalając
odpowiednio pokrętło " regulacja prądu " .
- zważyć próbki na wadze analitycznej z dokładnością do 0,0001g .
Następnie posługując się wyłącznie pensetą poddać próbki kolejno odtłuszczaniu i trawieniu:
- odtłuścić przez zanurzenie w trójchloroetylenie (30 s)
- opłukać przez zanurzenie w alkoholu metylowym
UWAGA: alkohol metylowy jest bardzo silną trucizną.
- opłukać bieżącą zimną wodą z kranu
- trawić przez zanurzenie w 15% roztworze kwasu siarkowego (15 s)
- opłukać bieżącą wodą .
Tak przygotowane próbki należy niezwłocznie zanurzyć do kąpieli przez zawieszenie ich przy pomocy miedzianych zaczepów na szynie katodowej wanny galwanizerskiej.
Z kolei należy:
- załączyć zasilacz przez wciśnięcie przełącznika "sieć"
- posługując się pokrętłem zasilacza do płynnej regulacji natężenia prądu,
ustawić dokładnie na miliamperomierzu wyliczoną wartość natężenia prądu,
- zapisać dokładny czas rozpoczęcia elektrolizy.
Podczas trwania elektrolizy należy:
- kontrolować i w razie potrzeby korygować natężenie płynącego w obwodzie prądu
- odczytać i zapisać napięcie wskazywane przez miernik w zasilaczu.
Po upływie podanego przez prowadzącego ćwiczenia czasu elektrolizy, należy:
- przerwać przepływ prądu w obwodzie przez zwolnienie przełącznika "sieć" zasilcza
- wyjąć z wanny galwanizerskiej ocynkowane próbki
- opłukać je bieżącą zimną wodą i wysuszyć dokładnie w strumieniu gorącego
powietrza z suszarki ręcznej.
- zważyć na wadze analitycznej z dokładnością do 0,0001 g.
3. Określenie biegunowości powłoki cynkowej względem stali.
Do określenia biegunowości powłoki cynkowej względem stali używany jest zestaw przedstawiony na rys. 2.
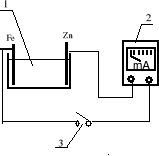
Rys. 2. Zestaw do określania biegunowości powłok cynkowych względem stali:
1 - naczynko pomiarowe; 2 - miliamperomierz; 3 - przerywacz
Aby wyznaczyć biegunowość powłoki cynkowej względem stali należy:
- wlać do naczynka pomiarowego 3 % roztwór chlorku sodowego,
- oczyścić papierem ściernym próbkę stalową bez powłoki
- odtłuścić ją przez zanurzenie w trójchloroetylenie (30 s)
- opłukać przez zanurzenie w alkoholu metylowym
UWAGA: alkohol metylowy jest bardzo silną trucizną.
- opłukać bieżącą zimną wodą z kranu
- wytrawić przez zanurzenie w 15% roztworze kwasu siarkowego (15 s)
- opłukać bieżącą wodą .
Tak przygotowaną próbkę stalową oraz jedną z wcześniej otrzymanych próbek z powłoką cynkową należy zamocować w zaciskach przykrywki naczynka pomiarowego i zanurzyć do roztworu w naczynku pomiarowym. Po zamknięciu obwodu pomiarowego przerywaczem, należy określić kierunek wychylenia się wskazówki miliaperomierza i odczytać wielkość prądu płynącego w obwodzie pomiarowym. Gdy wskazówka miliamperomierza wychyla się w prawo, w utworzonym ogniwie elektrodą o wyższym potencjale jest próbka zamocowana w zacisku połączonym z zaciskiem "+" miliamperomierza. Wychylenie wskazówki w lewo świadczy o połączeniu z zaciskiem "+" miliamperomierza elektrody o niższym potencjale.
4. Pomiar grubości powłoki cynkowej metodą kroplową
Sposób wykonania oznaczenia jest zgodnny z Polską Normą PN-74/H-04605. Skład roztworu używanego do oznaczenia: 200 g jodku potasowego i 100 g jodu w objętości 1 dm3 roztworu wodnego.
Oznaczenie przeprowadzić w trzech punktach leżących na przekątnej ocynkowanej powierzchni drugiej próbki. Na każdy z punktów nanieść przy użyciu kroplomierza kroplę podanego wyżej roztworu i pozostawić ją tam przez 60 sekund. Następnie zdjąć ją ostrożnie rożkiem bibuły filtracyjnej (unikać rozmazania ). Czynność nakładania w te same miejsca kolejnych kropel i zdejmowania ich po upływie 60 sekund powtarzć aż do dostrzeżenia kontrastu między odsłoniętym metalem podłoża i metalem powłoki.
Grubość powłoki cynkowej ( x ) obliczyć w mikrometrach wg wzoru:
x = ( n - 1 ) k
gdzie: n - średnia liczba kropli roztworu zużytego do roztworzenia powłoki
k - współczynnik określający grubość powłoki roztworzonej przez jedną
kroplę roztworu w określonej temperaturze w ciągu 60 sekund.
Zależność współczynnika k od temperatury: 288 K (15o C) - 1,01
293 K (20o C) - 1,24
298 K (25o C) - 1,45
5. Opracowanie wyników.
W oparciu o zastosowane parametry elektrolizy i wyznaczoną wagowo masę uzyskanych powłok, należy obliczyć katodową wydajność prądową procesu, średnią grubość otrzymanych powłok, szybkość nakładania powłok oraz jednostkowe zużycie energii elektrycznej.
Katodową wydajność prądową procesu () należy wyliczyć ze wzoru:
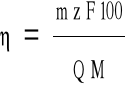
w którym: Q - ładunek elektryczny (*)
m - masa wydzielonego cynku(**)
M - masa molowa cynku ; M = 65,37 g mol -1
z - stopień utlenienia cynku w elektrolicie ; z = + 2
F - stała Faraday'a ; F = 96500 C mol -1
(* ) Ładunek elektryczny płynący w obwodzie elektrycznym Q jest iloczynem natężenia
prądu płynącego w danym obwodzie (I) i czasu trwania określonego procesu (t) :
Q = I t. Jednostka ładunku elektrycznego kulomb (C) jest odpowiednio iloczynem
jednostki natężenia prądu (A) i jednostki czasu (s): C = A s
(**) Różnica sumy mas dwóch próbek po elektrolizie i mas tych samych próbek przed
elektrolizą stanowi masę powłok cynkowych.
Pozostałe wielkości należy wyliczyć ze wzorów 39, 40 i 41 zawartych w części teoretycznej. Przy wyliczaniu grubości powłoki należy przyjąć średnią masę właściwą cynku
ρ 7,13 g cm-3.
Na podstawie kierunku wychylenia się strzałki miliamperomierza i sposobu połączenia z nim obu próbek, określić i uzasadnić biegunowość powłoki cynkowej względem stali ( tzn. czy powłoka cynkowa jest anodową czy katodową względem stali ).
Podanie wyników
Oddając sprawozdanie z wykonanego ćwiczenia należy podać:
1. Dokładnie wypełnioną tabelę wyników.
2. Wszystkie obliczenia.
3. Uzasadnienie podanej w tabeli biegunowości powłok cynkowych.
Wyszukiwarka
Podobne podstrony:
elektrochemia-skrypt, 1907KOND
elektrochemia-skrypt, 1905PH
drążenie elektroerozyjne skrypt 2008
elektrochemia-skrypt, 02BHP
Maszyny Elektryczne Skrypt Polit Krakowska
Maszyny elektryczne skrypt
elektrochemia-skrypt, Tabelki- Laboratorium Elektrochemii, LABORATORIUM ELEKTROCHEMII
elektryczna, Skrypty, UR - materiały ze studiów, IV semestr, inżynieria
elektrochemia-skrypt, cw-KOROZJA, KOROZJA
ELEKTROFOREZA skrypt id 158052 Nieznany
elektrochemia-skrypt, 12CYNK33
Labolatorium aparatów elektrycznych skrypt
więcej podobnych podstron