Iwona Frątczak 99.11.29
wydział chemiczny
kierunek chemia
semestr III
Laboratorium z chemii fizycznej
Ćwiczenie Nr 91
Temat:
„Pomiar napięcia powierzchniowego”
Data wykonania ćwiczenia: 99.11.29. |
Ocena: |
Podpis: |
Data oddania sprawozdania:
|
Ocena: |
Podpis: |
I. Wstęp :
Siły oddziaływania cząsteczek lub jonów ciał stałych i cieczy są z natury rzeczy siłami przyciągającymi. Siły te dążą więc do maksymalnego wzajemnego wysycenia i tym samym minimalzacjii energii układu przez maksymalne wzajemne zbliżenie cząsteczek i otoczenie się cząsteczkami maksymalną, w danych warunkach, liczbą sąsiadek. ponieważ cząsteczki zajmujące powierzchnię fazy skondensowanej pozbawione są sąsiadek od zewnętrznej strony fazy, wykazują one nadmiar potencjału termodynamicznego. W samorzutnym dążeniu do zmniejszenia tego potencjału układ stara się zmniejszyć do minimum swą powierzchnię.
Ta tendencja manifestuje się w istnieniu napięcia powierzchniowego.
Napięcie powierzchniowe jest to zmniejszenie potencjału termdyn. układu towarzyszące zmniejszeniu jego powierzchni o jednostkę =dG/dA lub siła styczna do powierzchni potrzebna do rozerwania błonki powierzchniowej na długości jednostkowej.
Substancje które wprowadzane do roztworu zmniejszają napięcie powierzchniowe to sufaktory (substancje powierzchniowo czynne). Elektrolity zwiększają napięcie powierzchniowe .
Oznaczanie napięcia powierzchniowego d metodą stalagnometryczną sprowadza się do zliczenia n kropli cieczy wypływających z określonej objętości V przez rurkę kapilarną.
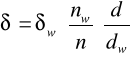
Zazwyczaj oznacza się liczbę kropli nw dla cieczy wzorcowej o znanym napięciu powierzchniowym dw i gęstości dw, a następnie dla badanego roztworu i oblicza się napięcie powierzchniowe badanej cieczy.
Cieczą wzorcową jest dla mnie woda, kt![]()
órej napięcie powierzchniowe dw w temperaturze 20oC wynosi:
![]()
II. Wyniki:
|
stężenie |
liczba kropli |
gęstość
|
napięcie powierzchniowe |
woda |
|
58 |
1 |
0,07244 |
NH4CL |
0,5M |
57 |
1,0076 |
0,07427 |
|
1M |
57 |
1,01375 |
0,07472 |
|
2M |
57 |
1,0315 |
0,07603 |
|
4M |
57 |
1,0594 |
0,07809 |
mydło |
0,0125 % |
58 |
1 |
0,07244 |
|
0,025 % |
63 |
1 |
0,06669 |
|
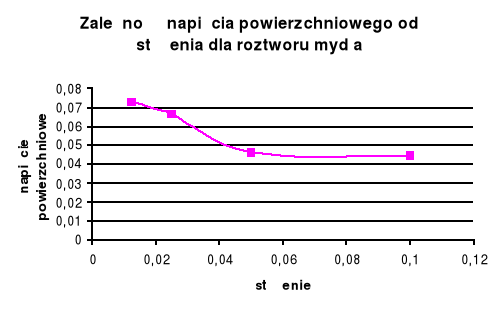
0,05 % |
91 |
1 |
0,04617 |
|
0,1 % |
94 |
1 |
0,04470 |
III. Obliczenia :
• Obliczenia prowadzę w temperaturze 21° C .
• Napięcie powierzchniowe wody obliczam ze wzoru :
![]()
• Napięcie powierzchniowe roztworów obliczam ze wzoru :
![]()
![]()
dla pierwszego pomiaru ( chlorek amonu ) :
![]()
IV. Wykresy :
•
•
V. Opis wykonania ćwiczenia :
Przygotowuję roztwory o podanych stężeniach , następnie myję dokładnie stalagmometr . Badaną ciecz ( najpierw wodę ) naciągam do stalagmometru . W momencie gdy menisk cieczy osiągnie górny , oznaczony poziom , rozpoczynam liczenie kropel i kończę w chwili gdy menisk osiąga poziom dolny . Analogicznie badam pozostałe ciecze o różnych stężeniach .
VI. Wnioski :
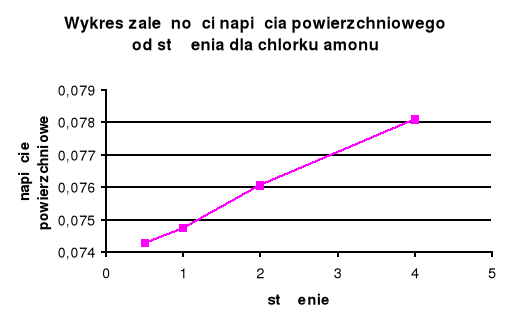
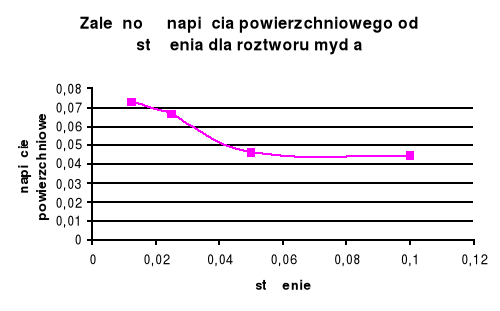
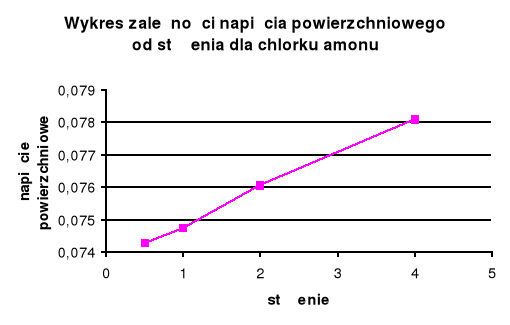
Dla substancji organicznej ( roztwór mydła ) wraz ze wzrostem stężenia maleje napięcie powierzchniowe . W przypadku substancji nieorganicznej ( chlorek amonu ) wraz ze wzrostem napięcia powierzchniowego stężenie rośnie .
Chlorek amonu (elektrolit) powoduje zwiększenie napięcia powierzchniowego. Zależność ta nie jest prostoliniowa im większe stężenie elektrolitu tym większy efekt wzmocnienia napięcia powierzchniowego w przeliczeniu na stężenie.
Roztwór mydła (surfaktor) obniża znacznie napięcie powierzchniowe, zależność ta jest jak wynika z wykresu dąży do prostoliniowej.
Dla roztworów organicznych napięcie powierzchniowe zmienia się większymi skokami niż dla roztworów nieorganicznych , spowodowane jest to tym, że stężenie elektrolitu jest mniej więcej stałe, a środki powierzchniowo czynne tworzą błonki na granicach faz (hydrofobowość i hydrofilowość).
![]()
![]()
Wyszukiwarka
Podobne podstrony:
753
753
752 753
753
B 354(skrajnik dziobowy) id 753 Nieznany
753
753
753
753
753
753
Historie różne, Ściąga od 753 p n e do 44 r p n e
753
753
752 753
Nuestro Circulo 753 ENTREVISTA CON PETER H NIELSEN 21 de enero de 2017
753
753 Steele Jessica Sekret panny mlodej
więcej podobnych podstron