ĆWICZENIE 22: KINETKA HYDROLIZY ESTRU
WSTĘP
Kinetyka zajmuje się zmiennością w czasie reagujących układów chemicznych. Badania kinetyczne dostarczają informacji o przebiegu reakcji chemicznych oraz stanowią podstawę technologicznego projektowania reaktorów.
Wyniki pomiarów kinetycznych opisujemy równaniami , które w większości przypadków wyrażają zależność szybkości reakcji r od stężeń reagentów i od temperatury. Jeśli chcemy znać nie tylko postać równań kinetycznych , lecz również zrozumieć ich powiązanie z molekularnym przebiegiem reakcji , musimy poznać przebieg reakcji. Przez pojęcie „mechanizm reakcji” rozumie się najczęściej ustalenie sekwencji aktów elementarnych i identyfikację nietrwałych produktów pośrednich , a rzadziej wyjaśnienie zmian struktury zachodzących w czasie aktu elementarnego.
Szybkość homogenicznej reakcji chemicznej r definiujemy jako zmianę stężenia - c w czasie - t
![]()
(1)
i jest ona wielkością intensywną. W przypadku gdy stężenie odnosi się do substratów w równaniu (1) dopisujemy znak minus.
Centralnym problemem kinetyki chemicznej jest znalezienie równania kinetycznego
r = f (ci , T) (2)
gdzie T jest temperaturą bezwzględną. Po rozdzieleniu zmiennych szybkość nieodwracalnej reakcji chemicznej r wyraża równanie:
r = k(T)⋅f(ci) (3)
gdzie współczynnik k(T) zwany stałą szybkości reakcji jest niezależny od stężeń reagentów , zależy natomiast od temperatury. W pewnych przypadkach funkcja f(ci) może też zależeć od temperatury.
Stała szybkości reakcji zależy wykładniczo od temperatury (równanie Arrheniusa)
![]()
(4)
gdzie R jest stałą gazową , E - energią aktywacji , a A - czynnikiem przedwykładniczym. Równanie Arrheniusa jest równaniem wykładniczym , co wskazuje na znaczny wpływ temperatury na szybkość rekcji chemicznej. Im większa energia aktywacji tym większy jest ten wpływ. Logarytmując równanie Arrheniusa otrzymujemy
![]()
(5)
W celu wyznaczenia stałych E i A bada się szybkość reakcji w różnych temperaturach , a znalezione stałe szybkości reakcji k przedstawia się na wykresie w układzie współrzędnych : logarytm k - odwrotność temperatury bezwzględnej.
Szybkość pewnych reakcji jest większa w obecności katalizatora. Katalizatorami nazywamy substancje przyspieszające reakcje chemiczne , pozostające w niezmienionej ilości po zakończeniu reakcji. Charakterystyczne jest przy tym , że bardzo małe ilości substancji katalitycznej , w porównaniu z substratami , mogą mieć bardzo silny wpływ na szybkość reakcji. Katalizator nie zmienia stanu równowagi termodynamicznej reakcji , tzn. jeżeli dana substancja katalizuje reakcję odwracalną w jednym kierunku to katalizuje także reakcję odwrotną.
OPRACOWANIE WYNIKÓW
Otrzymane wyniki zestawiamy w tabeli:
L0 = 2,45 [mS] L∞ = 1,06 [mS] c0 = 0,01 [mol/dm3]
Lp. |
Godzina pomiaru |
Czas trwania reakcji [min] |
t2 |
L [mS] |
L0-L [mS] |
L-L∞ [mS] |
|
|
ty |
1. |
09:20 |
5 |
25 |
2,05 |
0,4 |
0,99 |
0,4040 |
40,404 |
202,020 |
2. |
09:25 |
10 |
100 |
1,98 |
0,47 |
0,92 |
0,5109 |
51,087 |
510,870 |
3. |
09:30 |
15 |
225 |
1,85 |
0,6 |
0,79 |
0,7595 |
75,949 |
1139,241 |
4. |
09:45 |
25 |
625 |
1,62 |
0,83 |
0,56 |
1,4821 |
148,214 |
3705,357 |
5. |
09:55 |
35 |
1225 |
1,52 |
0,93 |
0,46 |
2,0217 |
202,174 |
7076,087 |
6. |
10:05 |
45 |
2025 |
1,48 |
0,97 |
0,42 |
2,3095 |
230,952 |
10392,857 |
|
|
∑ |
4225 |
|
|
|
|
∑ |
23026,43 |
2. Wykreślamy zależność
![]()
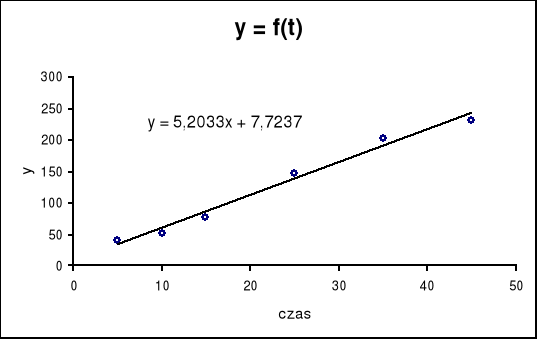
i określamy stałą szybkości reakcji hydrolizy estru wyznaczając współczynnik kierunkowy tak powstałej prostej :
a) graficznie
współczynnik kierunkowy odczytany z wykresu wynosi
k = 5,2033 [1/min]
b) metodą najmniejszych kwadratów
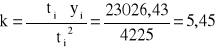
[1/min]
Wyszukiwarka
Podobne podstrony:
CH.F.L9, Studia, Politechnika
CH.F.L.24, Studia, Politechnika
CH.F.Li.5, Studia, Politechnika
Chemia fizyczna - nr 22, Studia, Politechnika
LAB++22, Studia, Politechnika
CH.F.L9, Studia, Politechnika
ch.fiz. zad 1 z 3, Studia, Politechnika
zad. ch. fiz.3-wer. ostat, Studia, Politechnika
Prawo inżynierskie i ochrona własności intelektualnych. Wykład 3, Studia, Politechnika Łódzka - Pend
sprawozdanie cwiczenie 22, studia, agrobiotechnologie
Testy biodegradacji, Studia, Politechnika
Chf9, Studia, Politechnika
Wyznaczanie stałej reakcji szybkości zmydlania estru, Studia, Politechnika
ZAKAAD CHEMI FIZYCZNEJ, Studia, Politechnika
C15, Studia, Politechnika
podstawowe informacje o ochronie prawnej wzorów przemysłowych, Studia - Politechnika Śląska, Zarządz
Sprawko spawalnictwo 1, studia, studia Politechnika Poznańska - BMiZ - Mechatronika, 2 semestr, obro
dziadek25, Studia, Politechnika
więcej podobnych podstron