Zakład Chemii Fizycznej
Laboratorium Studenckie
ĆWICZENIE 5
TEMAT:WYZNACZANIE POWIERZCHNI WŁAŚCIWEJ
WĘGLA AKTYWNEGO.
SPORZĄDZILI:
Marcin Nowicki
Renata Romanowska
Grupa III Rok II
WSTĘP.
Zjawisko występujące na granicy dwóch faz , polegające na powstawaniu różnic pomiędzy przeciętnym składem wnętrza faz , a składem warstw przylegających do powierzchni rozdziału , nazywamy adsorpcją. Zachodzi ono prawie zawsze w przypadku zetknięcia się gazów lub cieczy (adsorbat) z fazą stałą. W wyniku procesu adsorpcji cząsteczki adsorbentu na powierzchni ciała stałego zwanego adsorbentem tracą swobodę ruchu.W zależności od sił działających na cząsteczki fazy ciekłej lub gazowej w warstwie przylegającej do adsorbentu , adsorpcja może mieć charakter fizyczny lub chemiczny.
Adsorpcja fizyczna jest wynikiem oddziaływań międzycząsteczkowych typu van der Waalsa między cząsteczkami adsorbatu i powierzchniowymi cząsteczkami adsorbentu. Jest ona procesem odwracalnym i cechuje ją niewielki efekt cieplny (kilkadziesiąt kJ/mol). Cząsteczki substancji zaadsorbowanej mogą tworzyć w tym przypadku warstwę o grubości odpowiadającej kilku średnicom cząsteczek adsorbatu.
Adsorpcja chemiczna jest wynikiem tworzenia się wiązań chemicznych między cząsteczkami adsorbatu i cząsteczkami powierzchniowymi adsorbentu. Wymaga ono energii aktywacji i charakteryzuje ją z reguły jednocząsteczkowe pokrycie powierzchni adsorbenta energia towarzysząca chemisorpcji jest porównywalna z energią reakcji chemicznych i wynosi ok. 102 kJ/mol. W zależności od rodzaju adsorbatu wiązania chemisorpcyjne mogą być jonowe lub koordynacyjne.
Według modelu adsorpcji Langmuira szybkość procesu adsorpcji można wyrazić następująco
![]()
![]()
(1)
a szybkość desorpcji
![]()
(2)
Z równania (1) wynika , że szybkość adsorpcji zależy od niepokrytej (wolnej) powierzchni (1-Θ) i od ciśnienia gazu p (lub stężenia). W stanie równowagi następuje zrównanie się szybkości va = vd , czyli że
![]()
(3)
a stąd po przekształceniu
![]()
(4)
gdzie K = ka/kd jest określany jako współczynnik adsorpcji.
Wyrażenie (4) jest równaniem izotermy adsorpcji Langmuira. W przypadku adsorpcji z roztworu równanie izotermy Langmuira przyjmuje postać:
![]()
(5)
Równanie izotermy adsorpcji Langmuira można sprowadzić do postaci liniowej
![]()
(6)
Jeżeli stopień pokrycia wyrazimy ilością moli adsorbatu odniesioną do 1 g adsorbentu
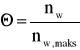
(7)
to równanie izotermy adsorpcji przyjmie postać
![]()
![]()
![]()
(8)
lub po przekształceniu
![]()
(9)
Zależność (9) jest równaniem prostej o parametrach 1/nw,maks i 1/(nw,maksK). Za pomocą tego równania można wyznaczyć stałe K i nw,maks ze współczynnika kierunkowego prostej 1/nw,maks i z rzędnej 1/(nw,maksK). Znając wartość nw,maks możemy wyliczyć powierzchnię właściwą przypadającą na określoną ilość adsorbenta A , jeżeli znana jest powierzchnia S zajmowana przez cząsteczką w monowarstwie
![]()
(10)
OPRACOWANIE WYNIKÓW
1. Zestawienie danych doświadczalnych :
L.P. |
Stężenie 50 cm3 kw. octowego przed adsorpcją [mol/dm3] |
Objętość 0,1 molowego NaOH zużytego do miareczkowania [cm3] |
1. |
0,15 |
28,8 |
2. |
0,12 |
22,5 |
3. |
0,09 |
20,7 |
4. |
0,06 |
11,2 |
5. |
0,03 |
6,0 |
6. |
0,015 |
3,1 |
Do obliczenia liczby moli kw. octowego zawartych w 50 cm3 roztworu przed adsorpcją korzysta się z zależności :
n1 = ckw. octowego Vkw. octowego
![]()
Do obliczenia liczby moli kw. octowego zawartych w 50 cm3 roztworu po adsorpcji korzysta się z zależności :
n2 = cNaOH VNaOH
zestawienie wyników obliczeń w tabeli :
Ilość moli kw. octowego w 50 cm3 r-ru przed adsorpcją n1[mol] |
Ilość gramów użytego węgla aktywnego m[g] |
Ilość moli kw. octowego w 50 cm3 r-ru po adsorpcji n2[mol] |
Stężenie równowagowe kw. octowego c[mol/dm3] |
Całkowita ilość moli kw. octowego która uległa zaadsorbowaniu n=n1-n2[mol] |
Ilość moli kw. octowego która została zaadsorbowana na 1g węgla aktywnego nw=n/m[mol/g] |
0,0075 |
1,0067 |
0,006675 |
0,1335 |
0,000825 |
0,000825 |
0,006 |
1,0027 |
0,005225 |
0,1045 |
0,000775 |
0,000775 |
0,0045 |
1,0255 |
0,00382 |
0,0764 |
0,00068 |
0,000691 |
0,003 |
1,0276 |
0,0025 |
0,05 |
0,0005 |
0,000494 |
0,0015 |
1,0255 |
0,0012 |
0,024 |
0,0003 |
0,000303 |
0,00075 |
1,0287 |
0,00058 |
0,0116 |
0,00017 |
0,00017 |
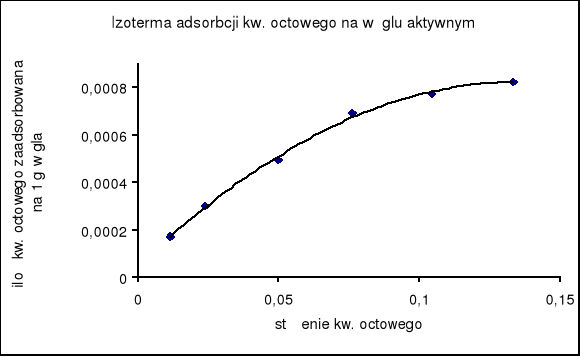
2. Wykreślenie krzywej izotermy adsorpcji :
3. Na podstawie równania (9) wykreślono zależność c/nw = f(c)
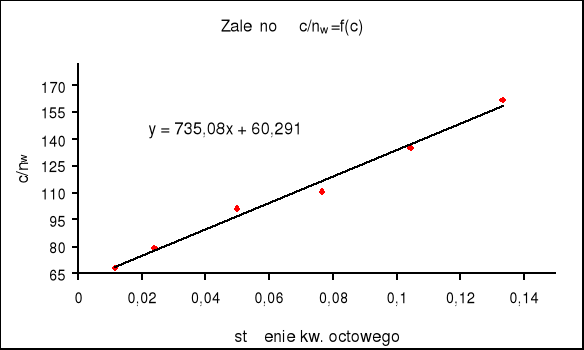
i obliczono liczbę moli kw. octowego potrzebną do pokrycia powierzchni 1 g węgla aktywnego monomolekularną warstewką ( nw,maks). Wyznaczenie tej wartości sprowadza się do wyznaczenia współczynnika kierunkowego wykreślonej uprzednio prostej b = 1 / nw,maks
a) metoda graficzna
korzystamy z wyznaczonego już na wykresie współczynnika kierunkowego b = 735.08
nw,maks = 1 / 735.08 = 0,00136 [mol/g]
b) metoda najmniejszych kwadratów
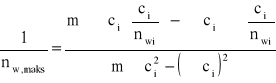
c/nw |
c·(c/nw) |
c |
c2 |
161,8505 |
21,60705 |
0,1335 |
0,017822 |
134,8792 |
14,09487 |
0,1045 |
0,01092 |
110,5328 |
8,444708 |
0,0764 |
0,005837 |
101,17 |
5,0585 |
0,052 |
0,0025 |
79,088 |
1,898112 |
0,024 |
0,000576 |
68,25576 |
0,791767 |
0,0116 |
0,000135 |
655,7763 |
51,89501 |
0,4 |
0,03779 |
suma
(∑ci)2 = 0,16
liczba pomiarów m = 6
![]()
![]()
[mol/g]
4. Zakładając , że S = 21·10-20 obliczamy za pomocą równania (10) powierzchnię właściwą węgla aktywnego A :
A = nw,maksNAS = 0,00136·6,025·1023·21·10-20 = 172,074 [m2/g]
Wyszukiwarka
Podobne podstrony:
CH.F.L9, Studia, Politechnika
chemfiz.24, Studia, Politechnika
Chemai Fiz. nr 24, Studia, Politechnika
CH.F.Li.5, Studia, Politechnika
CH.F.L.22, Studia, Politechnika
CH.F.L9, Studia, Politechnika
Sprawozdanie nr 24, 1 STUDIA - Informatyka Politechnika Koszalińska, Labki, sprawozdania fiza
ch.fiz. zad 1 z 3, Studia, Politechnika
Metrologia 24 protokół, Politechnika Lubelska, Studia, semestr 5, Sem V, Nowy folder
24 - Przyrządy, Politechnika Lubelska, Studia, Studia, FIZA
zad. ch. fiz.3-wer. ostat, Studia, Politechnika
Prawo inżynierskie i ochrona własności intelektualnych. Wykład 3, Studia, Politechnika Łódzka - Pend
Testy biodegradacji, Studia, Politechnika
Chf9, Studia, Politechnika
Wyznaczanie stałej reakcji szybkości zmydlania estru, Studia, Politechnika
ZAKAAD CHEMI FIZYCZNEJ, Studia, Politechnika
więcej podobnych podstron