AKADEMIA GÓRNICZO-HUTNICZA
im. Stanisława Staszica w Krakowie
WYDZIAŁ METALI NIEŻELAZNYCH
Zarządzanie i Inżynieria Produkcji
Metalurgia metali nieżelaznych
Laboratorium nr 1
Temat: Rafinacja ołowiu metodą ługową (metoda Harrisa)
Wykonał:
Witowski Marcin
Wstęp teoretyczny
Metoda Harrisa usuwania As, Sn i Sb daje lepsze wyniki niż utlenianie tlenem powietrza, wymaga mniej skomplikowanych urządzeń i niższej temperatury procesu. Według tej metody zanieczyszczony ołów do temperatury 420- 450 C, oczyszcza się z As, Sb, Sn działając ciekłym wodorotlenkiem sodowym NaOH.
Wodorotlenek sodowy z tlenkami cyny, arsenu, antymonu tworzy cyniany, arseniany i antymoniany sodowe na podstawie amfoterycznych właściwości tych trzech pierwiastków. W trakcie procesu dodawania jest sól kuchenna NaCl , która powoduje obniżenie temperatury topnienia; natomiast saletra sodowa NaNO3 jest właściwym utleniaczem wymienionych domieszek.
Tlen powstający z rozkladu saletry utlenia najpierw ołów na tlenek ołowiawy PbO, który łączy się z Na2O na ołowin sodowy i dopiero ten związek utlenia domieszki. W czasie procesu zachodzą następujące reakcje:
5Pb + 2NaNO3 = Na2O + 5PbO + N2
PbO + Na2O = Na2PbO2
4PbO + 8NaOH = 4Na2PbO2 + 4H2O
2As + 5Na2PbO2 + H2O = 2Na3AsO4 + 4 NaOH + 5Pb
Sn + 2Na2PbO2 + H2O = Na2SnO3 + 2NaOH + 2Pb
2As + 5Na2PbO2 + H2O = 2Na3AsO4 + 4 NaOH + 5Pb
Przy rozpuszczaniu arsenianów, cynianów i antymonianów stopy ługu sodowego i soli kuchennej zmieniając swe zabarwienie w zależności od rodzaju pochłanianej soli, co umożliwia selektywne ich rozdzielenie już podczas rafinacji ołowiu. Nasycając się arsenianem sodu stop jest zabarwiony na czarno. Po usunięciu arsenu zaczyna się utleniać cyna - stop zabarwia się na kremowo. Stop z zawartością antymonianu sodowego ma barwę mleczno białą.
Odmiedziowanie segregacyjne wykorzystuje zależność, iż wraz z obniżeniem temperatury zmniejsza się rozpuszczalność miedzi w ciekłym ołowiu.
Aby usunąć złoto i srebro stosuje się cynk metaliczny. Do odcynkowania ołowiu stosuje się utlenienie cynku w piecach płomiennych lub w kotłach, metodę Harrisa; podobnie jak do usuwania Sn, As i Sb oraz chlorowania i odcynkowania ołowiu w próżni.
W metodzie Harrisa domieszki mieszają się ze stopionym metalem i ulegają stopieniu. Pod wpływem działania tlenu z powietrza, domieszki ołowiu utleniają się. Utlenianie to jest przyspieszane, dzięki zastosowaniu NaNO3, która topi się w temperaturze 308oC. NaNO3 pod wpływem ogrzewania rozkłada się na Na2O oraz N2 i O2. Sumarycznie reakcję rozkładu NaNO3 można zapisać w postaci:
2 NaNO3 = Na2O + N2 + 5/2 O2
Tlen powstający podczas rozkładu NaNO3 jest czynnym utleniaczem domieszek ołowiu, które utleniają się w następującej kolejności: Sn i Sb. Podczas utleniania powstają cyniany
i antymoniany sodu absorbowane w płynnym wodorotlenku sodowym NaOH. Zachodzą wówczas następujące reakcje:
5 Sn + 4 NaNO3 + 6 NaOH = 5 Na2SnO3 + 3 H20 + 2 N2
2 Sb + 2 NaNO3 + 4 NaOH = 2 Na3SbO4 + 2 H20 + N2
Rola reagentów jest następująca:
NaNO3 jest czynnym utleniaczem Sn i Sb;
NaOH jest pochłaniaczem (rozpuszczalnikiem cynianów i antymonianów sodu);
NaCl dodaje się do NaOH w celu obniżenia temperatury topnienia reagentów, dodawany do sody żrącej zwiększa zdolność NaOH do pochłaniania domieszek i zmniejsza zużycie saletry sodowej.
Przebieg ćwiczenia
Przygotowano próbkę czystego ołowiu o masie 205g;
Próbkę tą poddano trzykrotnemu pomiarowi twardości metodą Vickersa;
Następnie czysty ołów stopiono wraz z dodatkiem cyny i antymonu [w ilości 2% każdego z tych metali w stosunku do masy ołowiu];
Po stopieniu otrzymano „surowy ołów”, który odlano do uprzednio wygrzanej kokilki;
Przygotowano wlewek poprzez ścieranie go na papierze ściernym grubo i cienko ziarnistym w celu lepszego odczytu pomiaru twardości;
Oznaczono twardość wlewka metodą Vickersa;
Wlewek poddano ponownemu stopieniu i dodano, w celu rafinacji próbki, sole według następujących proporcji:
NaNO3: 52% w stosunku do Sn
62% w stosunku do Sb
NaOH: 192% w stosunku do Sn
159% w stosunku do Sb
NaCl: w 1/3 ilości NaOH w celu upłynnienia stopu soli.
Przed dodaniem do ołowiu, sole zmieszano ze sobą;
W czasie rafinacji mieszano ołów tak, aby ułatwić jego kontakt z solami;
Proces rafinacji zakończono po zgęstnieniu soli;
Po rafinacji próbkę ołowiu odlano do kokilki i ponownie określono jej twardość.
Obliczenia i wyniki
Masa użytego czystego ołowiu:
Masa Pb = 205g
Masa cyny i antymonu:
Masa Sb - 2% masy ołowiu
Masa Sn - 2% masy ołowiu
205g - 100%
x - 2%
x = 4,1g
Masa wyliczona:
m Sb = 4,1 g m Sn = 4,1g
Masa zważona:
m Sb = 4,072 g m Sn = 4,274g
Sole rafinacyjne:
Masa NaNO3 - 52 % masy Sn
- 62% masy Sb
Masa NaOH - 192% masy Sn
- 59% masy Sb
Masa NaNO3 - wyliczona
Sn: 4,274 - 100% Sb: 4,072 - 100%
x - 52% x - 62%
x = 2,22248g x = 2,60462 g
Masa NaOH - wyliczona
Sn: 4,274g - 100% Sb: 4,072g - 100%
x - 192% x - 159%
x = 8,20608 g x = 6,47448 g
Łączna masa NaNO3 i NaOH
Masa wyliczona : Masa zważona:
m NaOH = 14,68056g ≈14,681g m NaOH = 14,775g
m NaNO3 = 4,74712 g ≈4,747g m NaNO3 = 4,7479g
Masa NaCl
Masa wyliczona:
mNaCl = 4,894g
Masa zważona:
mNaCl = 4,895g
Wyniki pomiarów twardości
rodzaj próbki |
przekątna odcisku C [μm] |
twardość HV [kG/mm2] |
||||
|
pomiar I |
pomiar II |
pomiar III |
średnia |
|
|
|
|
|
|
|
|
|
czysty ołów |
226 |
250 |
205 |
227 |
7,1959 |
|
ołów z dodatkiem Sn i Sb |
150 |
144 |
152 |
148,667 |
16,7769 |
|
ołów po rafinacji solami |
170 |
161 |
162 |
164,333 |
137306 |
|
Twardość mierzymy metodą Vickersa
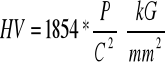
Przykłady obliczeń dla czystego ołowiu:
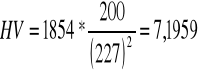
Obliczenia stechiometryczne ilości soli według reakcji
Stechiometryczne wyliczenie ilości NaNO3 i NaOH potrzebnych do przeprowadzenia procesu
5 Sn + 4 NaNO3 + 6 NaOH = 5 Na2SnO3 + 3 H2O + 2 N2
5 moli Sn - 6 moli NaOH
MSn = 118,71g/mol
MNaOH = 22,99 + 15,99 + 1,008 = 39,99g/mol
5*118,71 g Sn - 6*39,99 g NaOH
4g Sn - x g NaOH
xNaOH = 1,62g
xNaOH - masa NaOH potrzebna do przebiegu reakcji.
5 moli Sn - 4 mole NaNO3
MSn = 118,71g/mol
mSn = 5 · MSn = 593,55g
MNaNO3 = 22,9 + 14,01 + 48 = 85g/mol
mNaNO3 = 4 MNaNO3 = 340g
593,55g Sn - 340g NaNO3
4g Sn - x g NaNO3
xNaNO3 = 4⋅340 / 593,55 = 2,29g
xNaNO3 - masa NaNO3 potrzebna do przebiegu reakcji.
2 Sb + 2 NaNO3 + 4 NaOH = 2 Na2SnO3 + 2 H2O + 2 N2
2 mole Sb - 4 mole NaOH
MSb = 121,75g/mol
mSb = 2 · MSb = 243,5g
MNaOH = 22,99 + 15,99 + 1,008 = 39,99g/mol
mNaOH = 4 · MNaOH = 159,96g
243,5g Sb - 189,96g NaOH
4g Sb - x g NaOH
xNaOH = 4⋅189,96 / 237,42 = 2,63g
xNaOH - masa NaOH potrzebna do przebiegu reakcji.
2 mole Sb - 2 mole NaNO3
MSb = 121,75g/mol
mSb = 2 · MSn = 243,5g
MNaNO3 = 22,9 + 14,01 + 48 = 85g/mol
mNaNO3 = 2 · MNaNO3 = 170g
243,5g Sn - 170g NaNO3
4g Sn - x g NaNO3
xNaNO3 = 4⋅170 / 243,5 = 2,79g
xNaNO3 - masa NaNO3 potrzebna do przebiegu reakcji.
Sumarycznie masa NaOH i NaNO3 dla obu reakcji:
xNaOH = 1,62 + 2,63 = 4,25g
xNaNO3 = 2,29 + 2,79 = 5,08g
Wnioski
Z reakcji i stężeń molowych, zawartych w sprawozdaniu, wynika że metoda Harrisa pozwala nam, na bardzo dokładne usunięcie zanieczyszczeń„ w postaci: cyny i antymonu. Nasze doświadczenie miało pokazać jak zmienia się twardość, wraz ze zmianą zawartości tychże pierwiastków.
Wyniki pomiarów twardości w przeprowadzonym doświadczeniu wyraźnie pokazują, że ołów z domieszkami (Sn, Pb) jest dużo twardszy od czystego ołowiu. Obecność antymonu i cyny w ołowiu powodują wzrost jego twardości.
Twardość ołowiu po rafinacji jest mniejsza niż ołowiu z domieszkami, ale jest też o ponad 4 jednostki wyższa od twardości czystego ołowiu (próbki wzorcowej). Świadczy to o tym, iż rafinacja mogła nie zajść do końca a w próbce pozostały niewielkie ilości cyny oraz antymonu, będące powodem wyższej twardości ołowiu rafinowanego od próbki czystego ołowiu. Być może proces rafinacji był prowadzony za krótko. Różnica pomiędzy HV ołowiu rafinowanego i czystego Pb może być spowodowana również błędami podczas odważania substancji użytych w doświadczeniu oraz błędami w pomiarze twardości HV.
Twardość próbki po rafinacji świadczy o tym że nie udało nam się przeprowadzić procesu całkowicie,
Podczas rafinacji ołowiu zaobserwowaliśmy zmiany barwy stopu - od czarnej przez kremową do jasnożółta oraz jego stopniowe gęstnienie po którym proces ten zakończono.
Wyszukiwarka
Podobne podstrony:
Rafinacja ołowiu metodą ługową Harrisa
Rafinacja ołowiu
21 Wyznaczanie pracy wyjścia elektronów z metalu metodą prostej Richardsona
MiO sprawko metoda wyt modeli, Politechnika Poznańska (ETI), Semestr I i II, Metalurgia I Odlewnictw
Lab 21, MIBM WIP PW, fizyka 2, laborki fiza(2), 21-Wyznaczanie pracy wyjścia elektronów z metalu met
fiz21, MIBM WIP PW, fizyka 2, laborki fiza(2), 21-Wyznaczanie pracy wyjścia elektronów z metalu meto
fiztomi21, MIBM WIP PW, fizyka 2, laborki fiza(2), 21-Wyznaczanie pracy wyjścia elektronów z metalu
Metoda magnetyczna MT 14
Metoda animacji społecznej (Animacja społeczno kulturalna)
Metoda Weroniki Sherborne[1]
Metoda Ruchu Rozwijajacego Sherborne
Projet metoda projektu
METODA DENNISONA
więcej podobnych podstron