Temat Sprawozdania:
Celem ćwiczenia było zilustrowanie pierwszej zasady termodynamiki dla układu zamkniętego. Uzyskaliśmy to poprzez wyznaczenia ciepła spalania paliwa stałego. Jako, że jest to układ zamknięty to nie występuje tutaj praca i zmiana energii wewnętrznej jest równa ciepłu.
ΔU = Q
Wszelkie przygotowania to przeprowadzenia badania opierały się na instrukcji zamieszczonej w skrypcie. Zważyliśmy nitkę od brykieciku oraz drucik, a następnie uformowaliśmy sam brykiecik. Wszystko umieściliśmy w bombie, zgodnie z instrukcją, następnie zważyliśmy wodę w kalorymetrze i na koniec umieściliśmy w nim wcześniej przygotowaną bombę. Rozpoczęliśmy pomiar i co pół minuty sprawdzaliśmy na odpowiednio przygotowanym termometrze, różnice temperatur. Poszczególne wyniki zostały spisane, a następnie umieszczone na wykresie:
Ostatecznie Δt = 3,9
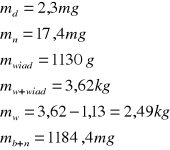
Posiadając różnicę temperatur, mogliśmy obliczyć zmianę energii wewnętrznej:
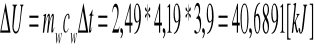
Nie jest to jednak ciepło spalania spalonego brykieciku, gdyż wewnątrz bomby uległa spaleniu nitka, oraz znacznemu ogrzaniu uległa nie tylko sama woda, ale również i kalorymetr z bombą. Zatem aby wyznaczyć ciepło spalania brykieciuku należy uwzględnić powyższe niedoskonałości całego układu, przez co uzyskujemy następujący wzór i obliczamy interesujące nas ciepło:
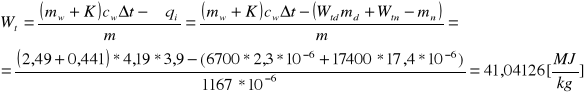
Wnioski:
Wyżej przeprowadzone doświadczenia miało za zadanie zilustrowanie I zasady termodynamiki, dlatego wartość ciepła spalania wyznaczona w tym doświadczeniu nie jest wartością rzeczywistą, lecz tylko przybliżoną. Jeżeli chcielibyśmy wyznaczyć popraną wartość ciepła spalania brykiecika, a co za tym idzie miału węglowego, musielibyśmy poświecić znacznie więcej czasu, który jest niezbędny do uwzględnienia zjawiska wymiany ciepła z otoczeniem jak również fakt mieszania wody przez mieszadełko. Mimo to wynik można uznać za w miarę zbliżony, do wyniku oczekiwanego i rzeczywistego ciepła spalania miału węglowego.
POMIAR CIEPŁA SPALANIA PALIWA STAŁEGO ZA POMOCĄ BOMBY KALORYMETRYCZNEJ
Zespół 3, Wtorek 9.00 - 12.00:
|
|
Krystian Lemański
Łukasz Boruc
Piotr Bareła
Łukasz Parda
Paweł Deres
Konrad Motyliński
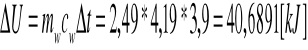
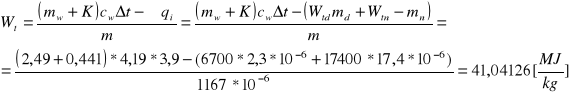
Wyszukiwarka
Podobne podstrony:
Sprawka Lab, Bomba Kalorymetryczna - spr, Ćwiczenie nr:
sprawko bomba kalorymetryczna ćw nr 7
bomba kalorymetryczna id 183603 Nieznany (2)
cwiczenie 1 bomba kalorym
Bomba kalorymetryczna
Bomba kalorymetryczna mac
Bomba kalorymetryczna, Technika cieplna
bomba kalorymetryczna
planowanie zywienia zadanie bomba kalorymetryczna
BOMBA KALORYMETRYCZNA nasza
Ciepło spalania i wartość Opałowa Bomba Kalorymetryczna
Ciepło spalania (bomba kalorymetryczna)
Termodynamika tableka laboratorium bomba kalorymetryczna ZUT
Bomba kalorymetryczna
Bomba kalorymetryczna
Bomba kalorymetrycznamhgf
więcej podobnych podstron