
1
WYZNACZANIE CIEPŁA SPALANIA PALIW ZA POMOCĄ BOMBY
KALORYMETRYCZNEJ
1. WSTĘP.
Jedną z najważniejszych cech charakteryzujących paliwa stałe takie jak węgiel
kamienny i brunatny, koks, trociny jest wartość opałowa paliwa. Wartość opałową paliwa
oblicza się na podstawie znajomości ciepła spalania paliwa oraz zawartości w nim wody i
wodoru. Tak ciepło spalania jak i wartość opałową mierzy się w kJ/kg.
Według definicji ciepłem spalania Q
c
nazywa się ilość ciepła odniesioną do jednego
kilograma paliwa, uzyskaną po całkowitym i zupełnym spaleniu próbki paliwa w bombie
kalorymetrycznej i po schłodzeniu produktów spalania do temperatury początkowej
substratów. Wartość opałowa Q
w
jest to ilość ciepła odniesiona do jednego kilograma
paliwa, uzyskana po całkowitym i zupełnym spaleniu próbki paliwa w bombie
kalorymetrycznej i po schłodzeniu produktów spalania do temperatury początkowej
substratów, zakładając, że woda znajdująca się w spalinach pozostaje w stanie pary.
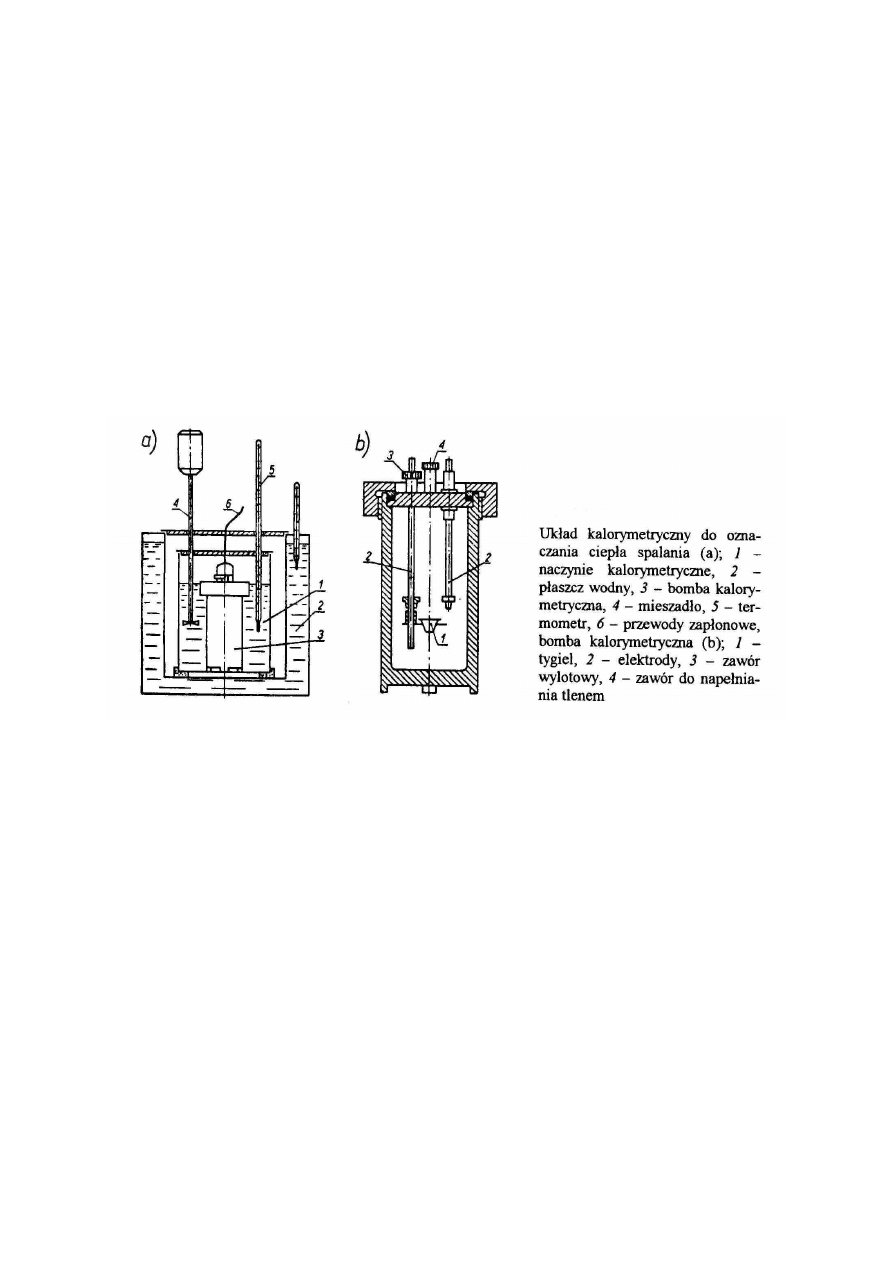
2. BOMBA KALORYMETRYCZNA.
Bezpośrednia metoda pomiaru wartości opałowej paliw stałych polega na spaleniu w
atmosferze tlenu odpowiednio przygotowanej próbki, umieszczonej w szczelnie
zamkniętym naczyniu zwanym bombą kalorymetryczną. Bomba ta zanurzona jest w
wodzie i ciepło wynikające ze spalenia próbki paliwa zostaje przekazane wodzie poprzez
ś
cianki bomby. Powoduje to wzrost temperatury wody.
Najbardziej znany jest kalorymetr Bertholta – Krokera – Mahlera. Bomba ta składa się z
naczynia cylindrycznego o średnicy ok. 6 cm i wysokości 12 cm, wykonanego ze stali
kwaso- i ognioodpornej, zamykanego od góry nakręcaną pokrywą. W pokrywie są dwa
otwory zamykane zaworami iglicowymi. Otwór wlotowy służy do napełniania bomby
tlenem, drugi zaś do opróżniania bomby. Rurka wstawiona w otwór wlotowy sięga
poniżej tygla, w którym umieszczamy próbkę paliwa i ma za zadanie tak skierować
strumień tlenu aby nie nastąpiło rozpylenie paliwa. W pokrywie bomby umieszczone są
dwa zaciski do przyłączenia źródła prądu stałego o napięciu 4..6 V. Jeden z nich (+) jest
izolowany od pokrywy, drugi zaś (-) połączony z korpusem bomby. Do zapłonu paliwa

2
służy cienki drucik ( o średnicy 0,1 .. 0,2 mm ) najczęściej stalowy ( Q
c
= 1600 kcal/kg )
zanurzony w próbce paliwa i dołączony do źródła prądu.
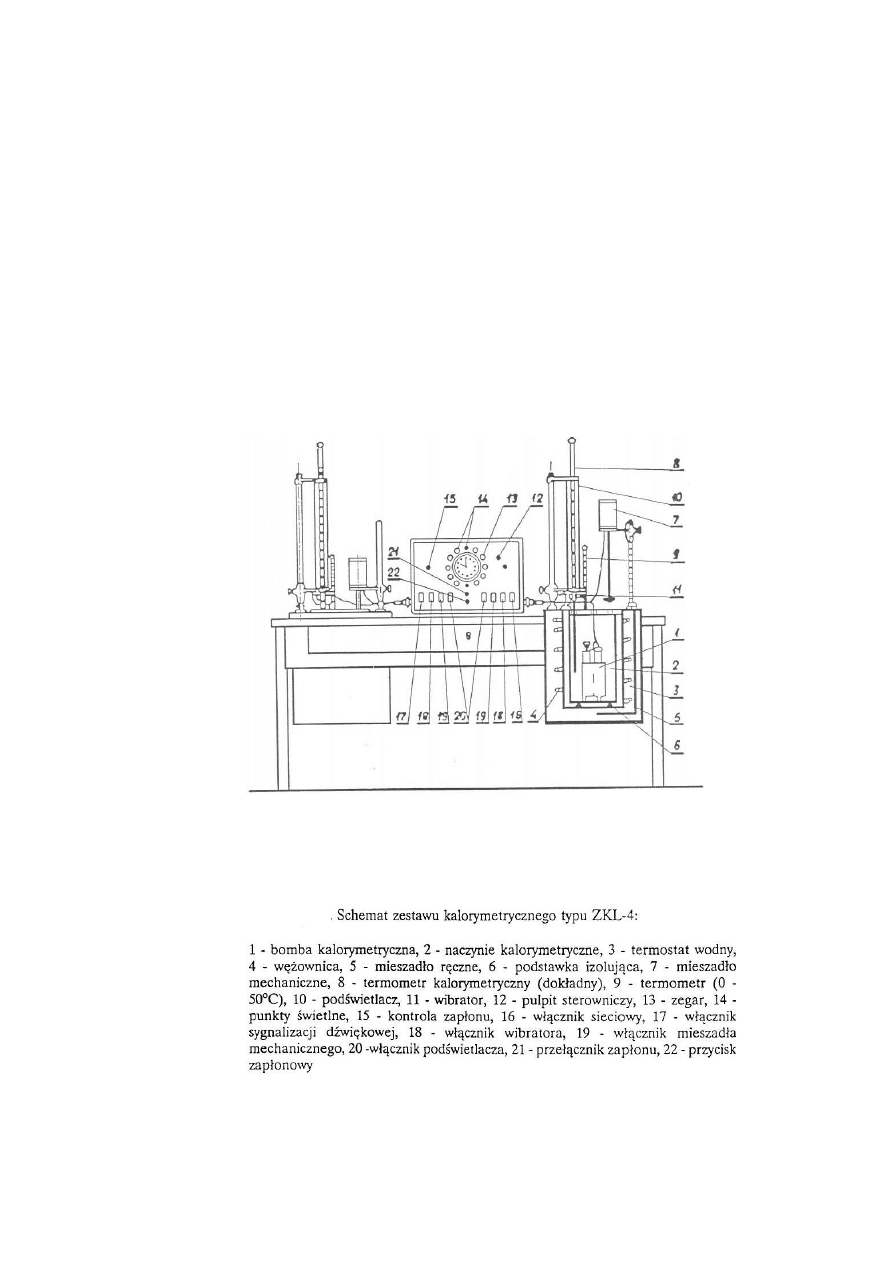
Widok stanowiska do pomiarów kalorymetrycznych.
3. PRZYGOTOWANIE PRÓBKI PALIWA.
Próbkę analityczną paliwa o bardzo małej ziarnistości ( zmielona ) należy dokładnie
wymieszać, po czym z różnych miejsc próbki pobrać co najmniej 3 porcje o takiej łącznej
masie aby po spaleniu temperatura wody w naczyniu kalorymetrycznym podniosła się o
1,8 .. 3,0
o
C ( warunek ten spełnia próbka paliwa o masie ok. 1 g ). Następnie próbkę
należy zważyć i umieścić w tyglu. Próbka może być umieszczona w tyglu:
•
luzem
•
w postaci uformowanej pastylki
3
Najdogodniejszym i najprostszym sposobem jest umieszczenie próbki paliwa luzem w
tyglu. W tym przypadku łatwiej jest ważyć paliwo już umieszczone w tyglu. Założenie
drutu oporowego o długości ok. 10 cm dokonuje się po zawieszeniu tygla w bombie.
Z paliwa, które daje się prasować, po sproszkowaniu tworzy się pastylki o średnicy ok. 8
mm i o wysokości 6 .. 10 mm. Drut zapłonowy uprzednio zważony musi zostać
wprasowany w pastylkę.
Jeśli w prasie formowano uprzednio pastylki innych próbek paliwa, należy odrzucić
dwie pierwsze pastylki aktualnie prasowanego paliwa aby uniknąć zanieczyszczeń
pastylki resztkami poprzedniego paliwa.
W przypadku paliw o dużej zawartości popiołów lub nie nadających się do
brykietowania zachodzi obawa niecałkowitego spalenia próbki. W takich przypadkach
pastylki tworzy się z mieszaniny paliwa i kwasu benzoesowego w stosunku 4:1, a wynik
pomiaru odpowiednio koryguje w oparciu o dokładnie znane ciepło spalania kwasu
benzoesowego ( Q
c
= 6323 kcal/kg ).
4. PRZYGOTOWANIE BOMBY DO POMIARU.
Na dno bomby należy wpuścić pipetą kilka mililitrów wody destylowanej, aby
umożliwić rozpuszczanie się w niej kwasów azotowego i siarkowego, powstających
podczas spalania. Ilość wody powinna być stale jednakowa, równa ilości wody użytej do
oznaczenia wartości cieplnej kalorymetru. Odważoną próbkę badanego paliwa umieszcza
4
się w bombie, zakręca szczelnie pokrywę i napełnia wnętrze bomby tlenem do ciśnienia
2,0
±
0,2 MPa przy badaniu węgla brunatnego, 2,5
±
0,2 MPa przy badaniu węgla
kamiennego. Bombę, podłączoną do źródła prądu umieszczamy w naczyniu
kalorymetrycznym wypełnionym wodą tak by cała bomba znajdowała się poniżej lustra
wody. Do naczynia kalorymetrycznego wkładamy termometr oraz mieszadło, które
zapewnia lepszą wymianę ciepła pomiędzy wodą i bombą kalorymetryczną. Należy
zwrócić uwagę aby termometr nie stykał się z bombą kalorymetryczną. Naczynie
kalorymetryczne zakrywamy pokrywą z winiduru aby wyeliminować wymianę ciepła z
otoczeniem.

5
5. POMIAR KALORYMETRYCZNY.
Po uruchomieniu mieszadła należy odczekać ok. 5 min w celu wyrównania
temperatury w kalorymetrze. Następnie przystępujemy do właściwego pomiaru
kalorymetrycznego. Składa się on z trzech okresów:
•
Okres początkowy- trwa 5 min i służy do określenia stopnia wymiany ciepła z
otoczeniem. Dokonuje się w nim pomiarów temperatury w 1-minutowych odstępach.
Bezpośrednio po szóstym pomiarze naciska się przycisk zapłonowy, obserwując czy
czerwona lampka kontrolna zapaliła się. Jeżeli czerwona lampka nie zapali się lub nie
zgaśnie po chwili od zapalenia pomiar należy przerwać.
•
Okres główny – rozpoczyna się z chwilą włączenia źródła napięcia, odczytów
dokonuje się w odstępach 30 sekundowych. Okres główny kończy się z chwilą gdy
dwie kolejne odczytane po sobie temperatury są jednakowe lub druga jest niższa
( okres ten trwa ok. 10 min ).
•
Okres końcowy – zaczyna się od ostatniego odczytu okresu początkowego. W okresie
tym dokonujemy 5 pomiarów w odstępach 1-minutowych.
6. OBLICZENIA
Obliczanie ciepła spalania dokonuje się według wzoru:
(
)
m
e
p
t
t
K
Q
c
Σ
−
−
−
=
1
*
gdzie:
Q
c
– ciepło spalania paliwa ( kJ/kg)
K – wartość cieplna kalorymetru ( stała K ) ( J/1
o
C )
p – poprawka temperatury wynikająca z wymiany ciepła układu kalorymetrycznego z
otoczeniem
t
1
– najwyższa temperatura okresu głównego (
o
C )
t – ostatnia temperatura okresu początkowego ( bezpośrednio przed zapaleniem próbki ) (
o
C )
Σ
e – suma ciepła uzyskana z efektów cieplnych nie związanych bezpośrednio z ciepłem
spalanego paliwa ( ciepło spalania drutu oporowego ) ( kJ/kg )
m – masa próbki paliwa ( kg )

6
-
wyznaczenie poprawki temperaturowej
p = 0,5 ( a
1
+ a
2
) + ( n – 1 ) a
2
gdzie:
a
1
, a
2
– średnie przyrosty temperatury w okresie początkowym i końcowym
n – liczba pomiarów w okresie głównym
a
1
= ( t
pk
- t
p0
) / 5
a
2
= ( t
kk
– t
k0
) / 5
t
pk
– końcowa temperatura okresu początkowego
t
p0
– pierwsza temperatura okresu początkowego
t
kk
– ostatnia temperatura okresu końcowego
t
k0
– pierwsza temperatura okresu końcowego
7. PRZEBIEG ĆWICZENIA - SPRAWOZDANIE.
•
Wyznaczenie wartości cieplnej kalorymetru.
•
Wyznaczenie ciepła spalania paliwa.
•
Obliczenie ciepła spalania paliwa.
•
Wykres t = f(T) ( temperatura w funkcji czasu ) dla kwasu benzoesowego oraz węgla.
•
Wykres
∆
t = f(T) ( przyrosty temperatury w funkcji czasu – dynamika wzrostu
temperatury ).
•
Wnioski.
8. LITERATURA.
1. „Pomiary w elektrowniach cieplnych”, Jerzy Wojciechowski, PWT 1958.
2. „Pomiary cieplne i energetyczne”, pod red. M. Mieszkowskiego, WNT 1981.
3. „Pomiary cieplne”, pod red. J. Kuleszy, tom 1 i 2, WNT 1993.
4. „Miernictwo energetyczne”, pod red. M. Sąsiadka, skrypt Politechniki Wrocławskiej.
Wyszukiwarka
Podobne podstrony:
D2 Kalorycznosc paliw id 130516 Nieznany
kalorymetria JT 2009 id 230631 Nieznany
Abolicja podatkowa id 50334 Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
katechezy MB id 233498 Nieznany
metro sciaga id 296943 Nieznany
perf id 354744 Nieznany
interbase id 92028 Nieznany
Mbaku id 289860 Nieznany
Probiotyki antybiotyki id 66316 Nieznany
miedziowanie cz 2 id 113259 Nieznany
LTC1729 id 273494 Nieznany
D11B7AOver0400 id 130434 Nieznany
analiza ryzyka bio id 61320 Nieznany
pedagogika ogolna id 353595 Nieznany
Misc3 id 302777 Nieznany
cw med 5 id 122239 Nieznany
więcej podobnych podstron