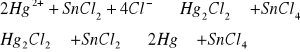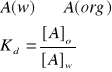
Nr ćwiczenia: 13 |
Data: 05.05.2009r. |
Imię i nazwisko: |
Wydział: Technologia Chemiczna Kierunek: Technologia Chem. |
Semestr: II |
Prowadzący: dr inż. Bogdan Wyrwas |
Przygotowanie: |
Wykonanie: |
Ocena: |
|
Temat: Rozdział przez ekstrakcję
Wstęp teoretyczny
Ekstrakcja to operacja służąca do rozdzielenia mieszanin ciał stałych i ciekłych. Rozdział następuje przez rozpuszczenie niektórych składników mieszaniny w cieczach, zwanych rozpuszczalnikami. Proces ekstrakcji może zachodzić zatem w układach dwufazowych: ciało stałe - ciecz lub ciecz - ciecz.
Najprostszy układ ekstrakcyjny składa się z dwóch nie mieszających się cieczy "A" i "C" oraz substancji "B" rozpuszczającej się w obu cieczach. "A" nazywamy rafinatem (rozpuszczalnikiem pierwotnym), a "C" ekstrahentem (rozpuszczalnikiem wtórnym). Substancja rozpuszczona "B" zwana ekstraktem, może być cieczą lub ciałem stałym. W przypadku gdy ekstrahent jest mieszaniną dwóch lub więcej cieczy, proces ten nosi nazwę ekstrakcji frakcyjnej.
W ekstrakcji siłą napędową procesu jest różnica stężeń ekstrahowanego składnika w rozpuszczalniku pierwotnym i rozpuszczalniku wtórnym, zatem jest to proces dyfuzyjny. Zjawisko przebiega tak długo, aż układ osiągnie stan równowagi termodynamicznej.
Kluczowym zagadnieniem przy wykonywaniu ekstrakcji jest odpowiedni dobór ekstrahenta. Dobiera się takie rozpuszczalniki, które selektywnie absorbują jeden związek chemiczny i nie absorbują (lub w znikomym stopniu) pozostałych. Efektywność procesu ekstrakcji zależy najbardziej od temperatury oraz od intensywności mieszania surowca i ekstrahenta.
Wynikiem procesu ekstrakcji ciecz - ciecz, jest układ dwóch nie mieszających się cieczy, które rozdziela się najczęściej w procesie filtracji lub odwirowania.
Przykładem procesu ekstrakcji w układzie ciało stałe - ciecz jest proces parzenia kawy lub herbaty. Zawarte w kawie substancje smakowe dyfundują z ziarna (surowiec) do wody (rozpuszczalnik wtórny).
Techniki ekstrakcyjne:
ciecz-ciecz - roztwór wodny i rozpuszczalnik organiczny umieszcza się w rozdzielaczu o wytrząsa do uzyskania stanu równowagi rozdzielenia się interesującej nas substancji między fazę organiczną i wodną.
ciecz-ciało stałe - przeprowadza się wówczas, kiedy trzeba wyekstrahować z próbki stałej składnik rozpuszczalny w użytym rozpuszczalniku. Inna nazwa to ługowanie. Klasycznym stosowanym do tego aparatem jest ekstraktor Soxlehta.
Stała podziału - opisuje stan równowagi reakcji przejścia substancji z rozpuszczalnika nieorganicznego do organicznego. Jest stała w danej temperaturze.
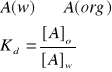
gdzie: [A] oznacza stężenie molowe składnika
Współczynnik podziału stanowi stosunek sumy stężeń wszystkich form substancji w fazie organicznej do sumy stężeń wszystkich form w fazie wodnej.
![]()
W celu scharakteryzowania efektywności procesu ekstrakcji wprowadzono pojęcie procentu ekstrakcji.
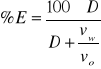
gdzie: v - objętość, D - współczynnik podziału.
Wykonywanie ćwiczeń i obserwacje:
1.1 Ekstrakcja ditizonu w zależności od pH.
1.1.1 Do probówki wlać ok. 2,5 cm3 wody (dwukrotnie destylowanej) a następnie dodać 2,5 cm3 roztworu ditizonu w tetrachlorku węgla (roztwór ten jest zielony). Dodać 3 - 4 krople 2 M amoniaku; wytrząsać a następnie dodać 5 - 6 kropel stężonego kwasu siarkowego(VI) i wytrząsać. Obserwować i zanotować zachodzące zmiany barwy.
Po dodaniu do roztworu ditizonu NH3 roztwór stał się żółty i wytrącił się różowy osad, a po dodaniu H2SO4 ponownie stał się zielono-przezroczysty i wytrącił się pomarańczowy osad.
1.2 Rozdzielanie przez ekstrakcję wobec regulowanego pH.
1.2.1 Ekstrakcja ditizonianu cynku.
Do 2 cm3 wody (dwukrotnie destylowanej) dodać 3 krople roztworu soli cynku i 1 - 2 kropel 2 M H2SO4, następnie dodać 2 cm3 roztworu ditizonu. Wytrząsnąć a potem dodać kilka kropli amoniaku zmieniając pH roztworu. Po ustaleniu się równowagi między fazą organiczną i wodną, ponownie zakwasić próbkę 2 M H2SO4 i wytrząsnąć.
Po dodaniu amoniaku warstwa organiczna zabarwia się na różowo, co świadczy o powstaniu ditizonianu cynku, po dodaniu kwasu H2SO4 ponownie roztwór zabarwia się na zielono, co świadczy o tym, że nastąpiła ekstrakcja Zn2+ z powrotem do fazy wodnej.
1.2.1 Rozdzielanie Zn2+ i Hg2+.
Jeżeli roztwór badany zawiera kationy Zn2+ i Hg2+to doprowadzając go do pH = 0,5 - 2,5 można ekstrahować najpierw jony Hg2+, a następnie przy pH w granicach 6,5 - 10 jony Zn2+ w postaci ditizonianów do tetrachlorku węgla. Trwały pomarańczowy ditizonian rtęci ulega ekstrakcji nawet z bardzo kwaśnych roztworów (pH ok. 0).
Do rozdzielacza wprowadzamy około 2 ml wody, 1 kroplę specjalnie przygotowanego i wydzielonego roztworu soli Hg(NO3)2 oraz 2 krople roztworu Zn(NO3)2; dodać 2 krople stężonego H2SO4 i ekstrahować ditizonian rtęci za pomocą 2 - 3 cm3 roztworu ditizonu. Oddzielić fazę organiczną. Czynność tą powtarzać aż do momentu całkowitej ekstrakcji Hg2+ z roztworu wodnego, tj. aż do uzyskania zielonej barwy kolejnej porcji ditizonu. Po całkowitym wyekstrahowaniu rtęci wytworzyć środowisko amoniakalne dodając amoniaku i następnie ekstrahować ditizonian cynku. Obserwować i opisać zmiany zarówno w fazie wodnej, jak i organicznej po każdym dodaniu nowego odczynnika.
Po dodaniu kwasu siarkowego otrzymaliśmy pomarańczowy ditizonian rtęci, następnie ekstrahowaliśmy aż do uzyskania zielonej barwy ditizonu. Po dodaniu amoniaku powstał czerwony kompleks ditizonu i cynku. Ponownie ekstrahowaliśmy do uzyskania zielonej barwy ditizonu.
Jony rtęci reagują z ditizonem w środowisku kwaśnym, natomiast a alkalicznym reagują jony cynku, ta własność pozwala na rozdzielenie tych jonów.
Kation |
Reakcje charakterystyczne |
pH |
Zabarwienie ditizonianu w CCl4 |
Zn2+ |
Zn2+ + S2- → ZnS↓ Zn2+ + CrO42- → ZnCrO4↓ |
zasadowe |
czerwony |
Hg2+ |
Hg2+ + S2- → HgS↓ Hg2+ + 2OH- → Hg(OH)2 → HgO↓ + H2O |
kwaśne |
pomarańczowy |
Ag+ |
Ag+ + Cl- → AgCl↓ 2Ag+ + 2OH- → 2AgOH↓ → Ag2O + H2O |
kwaśne |
pomarańczowo-czerwony |
Kompleksy Co2+ z jonami SCN-:
Co2+ + 6SCN- -> [Co(SCN)4]2- (kolor czerwony) (pK = 2,0)
Inne sposoby rozdziału i wykrywania kationów Ag+ i Hg2+:
a) Kationy ![]()
oraz ![]()
reagują z rodankami, tworząc białe osady, rozpuszczalne w nadmiarze odczynnika.
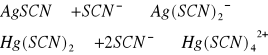
osad AgSCN nie rozpuszcza się w rozcieńczonym kwasie azotowym, ale w amoniaku tak:
![]()
b) Difenylokarbazon tworzy z rtęcią(II) w środowisku 0,1-0,2M kwasu azotowego kompleks o niebiesko-fioletowym zabarwieniu.
c) Reakcje redukcji:
reduktory redukują jony srebra do szaroczarnego srebra metalicznego:
![]()
d) Podczas powolnego ogrzewania słabo amonakalnego roztworu srebra z kwasem winowym w łaźni wodnej na ściankach próbówki tworzy się charakterystyczne lustro srebra.
e) Po dodaniu chlorku cyny do roztworu rtęci(II) wytrąca się biały osad Hg2Cl2, który powoli szarzeje, a następnie czernieje, w skutek wydzielania się rtęci metalicznej.