W której z podanych cząsteczek kąt między dwoma wiązaniami kowalencyjnymi jest najmniejszy a w której największy. a) BeF2 b) BF3 c) CH4 d) H2O
najmniejszy: ..................... największy .........................
|
2 |
|
Podaj typ hybrydyzacji atomów węgla i kształt cząsteczek:
H2O .................................................................................................................. NH4+ .................................................................................................................. CO2 .................................................................................................................. C6H6 .................................................................................................................. C2H2 .................................................................................................................. BCl3 ..................................................................................................................
|
3 |
|
Narysuj cząsteczkę tran-2-butenu i zaznacz wszystkie atomy leżące w jednej płaszczyźnie.
|
2 |
|
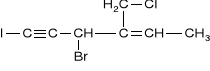
W podanym niżej związku podaj liczbę atomów węgla o hybrydyzacji sp, sp2 i sp3
liczba atomów węgla o hybrydyzacji sp ............... sp2 ............... sp3 ................ |
2 |
|
Naszkicuj zhybrydyzowane orbitale typu sp; sp2 i sp3
|
3 |
|
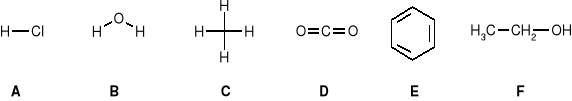
Zaznacz te cząsteczki w których moment dipolowy jest równy zeru:
|
2 |
|
Posługując się metodą VSEPR określ kształt cząsteczek
|
5 |
|
Narysować schemat powstawania orbitali molekularnych w cząsteczkach:
|
4 |
|
|
|
23 |
Określenie budowy przestrzennej; Hybrydyzacja - 3 / 3 - dom
Wyszukiwarka
Podobne podstrony:
CHEMIA NIEORGANICZNA 2
Chemia nieorganiczna zadania 4 Nieznany
Chemia nieorganiczna zadania 7 Nieznany
KationyV, Farmacja, I rok, Chemia nieorganiczna
egz 2010-pytania spisane(1), Chemia nieorganiczna- egzmain
Tlenowce(1), Chemia, Chemia nieorganiczna
testy chemia2, Biotechnologia PŁ, chemia nieorganiczna
CHEMIA KOSMETYCZNA Chemia nieorganiczna (tlenki, kwasy, sole
Chemia nieorganiczna egzamin
Chemia nieorganiczna sciaga
iloczynrozw, ~ NOTATKI, przedmioty obowiązkowe I rok, Chemia Nieorganiczna, Kolokwia
Nierganiczna cw teoria, semestr 1, Chemia, Nieorganiczna teoria
odp test 1, 1 ROK Biologia i geologia, spec.Ochrona przyrody, Chemia nieorganiczna
nieorgany-pytania2, Studia - Chemia kosmetyczna UŁ, II rok, III semestr, CHEMIA NIEORGANICZNA labora
KationyIIB, Farmacja, I rok, Chemia nieorganiczna
ligandy, Studia POLSL, STUDIA, Chemia nieorganiczna, teoria
WF-Zagadnienia Egz-22.05.2014, rok numero uno, chemia nieorganiczna
więcej podobnych podstron