TEST: Układ okresowy pierwiastków (wersja II)
1. Uzupełnij poniższe zdania.
a) Układ okresowy pierwiastków składa się z 18 ............ i 7 ................ .
b) Podstawę współczesnego układu okresowego pierwiastków stanowi ich konfiguracja elektronowa wyznaczająca podział na ................................... .
c) ................ szeregi układu okresowego - okresy, zawierają pierwiastki, których atomy mają ......................... powłok elektronowych - numeruje się je cyframi od ..... do ..... .
d) ........................ kolumny układu okresowego - grupy, zawierają pierwiastki, których atomy mają.............................................. konfigurację zewnętrznych powłok elektronowych - numeruje się je liczbami od ........ do ......... .
e) Grupy ..... i ..... tworzące blok s oraz grupy od ..... do .... tworzące blok p nazywają się grupam i ................... układu okresowego.
2. Na podstawie teorii Lewisa-Kossela wskaż helowce, których konfigurację elektronową uzyskają:
a) potas,
b) tlen,
wchodząc w reakcje chemiczne.
3. Podaj konfigurację elektronową atomu fluoru. Określ, które orbitale dwóch atomów fluoru uczestniczą
w tworzeniu orbitalu molekularnego w cząsteczce F2. Narysuj kontury tych orbitali i sposób ich nakładania
się oraz określ typ wiązania w cząsteczce F2.
4. Podaj definicję elektroujemności pierwiastka.
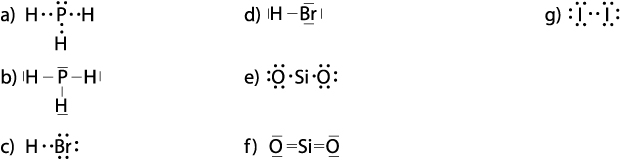
5. Poniżej przedstawiono wzory elektronowe cząsteczek. Wskaż te, które napisano poprawnie.
6. Uzupełnij tabelę, korzystając z układu okresowego pierwiastków.
Nazwa i symbol pierwiastka |
Numer grupy |
Numer okresu |
Liczba atomowa Z |
Liczba protonów |
Liczba elektronów |
Konfiguracja elektronowa |
Liczba powłok elektronowych |
Liczba elektronów walencyjnych |
|
|
|
|
13 |
|
|
|
|
|
|
|
|
|
|
1s22s22p6 |
|
|
|
1 |
1 |
|
|
|
|
|
|
7. Korzystając z tabeli elektroujemności pierwiastków według Paulinga, określ typy wiązań chemicznych
w następujących cząsteczkach:
a) KF
b) HI
c) S8
d) BaO
8. Co oznacza strzałka umieszczona pod szeregiem symboli pierwiastków?
Na Mg Al Si P S Cl
Podaj trzy odpowiedzi.
9. Wchodząc w reakcje chemiczne, atomy ulegają poniżej przedstawionym przemianom:
Mg Mg2+, O O2-
Napisz równania elektronowe tych przemian i wyjaśnij, dlaczego łatwo tworzą się te jony.
10. Określ, które z rysunków przedstawiają tworzenie wiązań σ, a które π:

11. Poniżej podano konfiguracje elektronowe czterech pierwiastków chemicznych:
a) 1s22s22p63s23p6
b) [Ar]4s23d1
c) 1s22s22p63s23p64s2
d) [Ar]4s23d104p3
Zakwalifikuj te pierwiastki do odpowiedniej grupy, okresu i bloku w układzie okresowym.
Podaj nazwy i symbole tych pierwiastków.
12. Przedstaw za pomocą równań elektronowych tworzenie się wiązania jonowego w cząsteczce NaCl.
13. Wybierz właściwą odpowiedź.
Właściwości pierwiastków chemicznych powtarzają się okresowo:
a) wraz ze wzrostem liczby atomowej,
b) wraz ze wzrostem wartościowości pierwiastków,
c) wraz ze wzrostem elektroujemności pierwiastków,
d) wraz ze wzrostem aktywności chemicznej.
14. Opisom oznaczonym liczbami przyporządkuj odpowiednie pojęcia oznaczone literami.
1. 14. grupa układu okresowego a) brom
2. pierwiastek chemiczny z czwartego okresu bloku p b) magnez
3. ma dwa elektrony walencyjne i trzy powłoki elektronowe c) fluor
4. pierwiastek z bloku d d) neon
5. charakteryzuje się największą elektroujemnością e) cynk
6. 1s22s22p63s23p4 f) siarka
g) węglowce
15. Określ, jaki typ wiązania występuje w cząsteczce CsCl i na tej podstawie podaj trzy typowe właściwości tej substancji. Odpowiedź uzasadnij.
16. W podanych konfiguracjach elektronowych popełniono błędy. Podkreśl je i napisz prawidłowe konfiguracje elektronowe.
16S 1s22s22p43s23p6
20Ca [Ne]4s2
Wyszukiwarka
Podobne podstrony:
1914 Regulamin straży obywatelskich w Zagłębiu
3781-i wojna światowa 1914 1918 sprawa polska podczas i wojny światowej
1 avgusta 1914
Historia Polski XX i XXIw, 1914-1984, 1914
TEST 1914-1918 A, Testy, sprawdziany, konspekty z historii
Tablice historyczne - 1815-1914, Stosunki międzynarodowe
Poezja polska 1914-1939. Antologia (poezja), Do ruchu rewolucyjnego należeli m
OKRES 1914, 1989r
3 Test Europa i ziemie RP 1860-1914 gr AB gimn
TEST 1914-1918 ODPOWIEDZI, Testy, sprawdziany, konspekty z historii
3 15 Ziemie RP i rozwój kolei w trzech zaborach 1864 1914
velikaja vojna i fevralskaja revoljucija 1914 1917 godov
Chernysh Na frontah Velikoy voyny Vospominaniya 1914 1918 446253
1914
1914
rossija v xix veke 1801 1914
1914
TEST 1914-1918 B, Testy, sprawdziany, konspekty z historii
1914
3 16 Europa w 1916r i front zachodni 1914 1918
więcej podobnych podstron