Chemia fizyczna
Imię i Nazwisko
|
Wydział
|
Grupa
|
Numer ewidencyjny |
Temat ćwiczenia ENTALPIA ZOBOJĘTNIANIA |
Data wykonania |
Data zaliczenia |
|
Cel ćwiczenia:
Zapoznanie się ze sposobem wyznaczania pojemności cieplnej kalorymetru oraz pomiaru entalpii rozpuszczania
i zobojętniania.
Sposób wykonania:
Procesowi rozpuszczania krystalicznego NH4Cl lub KCl w wodzie towarzyszy pewien efekt cieplny (ΔH), którego miarą może być zmiana temperatury układu (ΔT) zachodząca w czasie tej przemiany. Znając wartość molowej entalpii rozpuszczania tych związków oraz przyjmując zamiast rzeczywistej pojemności cieplnej (C) średnią pojemność cieplną w granicach temperatur T1, T2, można z następującej zależności wyznaczyć średnią pojemność cieplna kalorymetru:
ΔH = C * Δ1T (14.19)
Ponieważ:
![]()
więc:
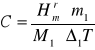
(14.20)
Gdzie:
C -średnia pojemność cieplna kalorymetru, ![]()
-molowa entalpia rozpuszczania NH4C1 lub KC1 (kJ*mol-1)
m1 -liczba gramów substancji rozpuszczonej, M1 - masa molowa substancji rozpuszczonej (g), ![]()
-zmiana temperatury zachodząca w procesie rozpuszczania.
Przekształcając równanie (14.20) do postaci:
![]()
(14.21)
można z niego obliczyć entalpię rozpuszczania dowolnej substancji (o masie molowej M2), mierząc zmianę temperatury ![]()
podczas rozpuszczania m2 gramów badanego związku w rozpuszczalniku (wodzie) o objętości takiej samej, jaka była stosowana do wyznaczania średniej pojemności cieplnej kalorymetru (C).
Zmiana entalpii towarzysząca reakcji zobojętniania wodorotlenku sodu stężonym kwasem siarkowym ( ΔHc -entalpia całkowita) jest sumą entalpii rozpuszczania kwasu siarkowego (ΔHr) i entalpii powstawania cząsteczek wody czyli entalpii zobojętniania (ΔHz):
ΔHC = ΔHr + ΔHz
Stąd:
ΔHZ = ΔHC - ΔHr
Ponieważ w reakcji tej tworzą się dwie cząsteczki wody, wiec:
![]()
Korzystając z zależności (14.13) Otrzymujemy ostatecznie:
![]()
(14.22)
Gdzie:
m2 - liczba gramów kw. siarkowego użytego do reakcji zobojętniani, M2 -masa molowa kw. siarkowego(g), c -średnia pojemność cieplna kalorymetru, ΔHrm -molowa entalpia rozpuszczania kw. siarkowego (obliczona ze wzoru 14.21) (kJ*mol-1 ) wyznaczona przez rozpuszczenie takiej samej ilości kwasu, jakiej użyto do reakcji zobojętniania, tj.m2
1.Wyznaczenie pojemności cieplnej kalorymetru (jego kalibracja)
Odważam w naczyńku wagowym ok. 5g NH4Cl lub KCl (z dokładnością do 0,0001g).
Do kalorymetru wlewam 100 cm3 wody i mierzę jej temperaturę w odstępach co 1 min w czasie 10 min.
Wsypuję do kalorymetru odważoną wcześniej ilość soli, ciągle mieszając odczytuję temperaturę przez pierwsze 5 min co 0,5 min, następnie co 1 min przez ok. 30 min, wyniki zapisuję w tabeli 1.
2. Wyznaczenie molowej entalpii rozpuszczania kwasu siarkowego VI
Do kalorymetru wlewam 100 cm3 wody i mierzę jej temperaturę w odstępach co 1 min w czasie 10 min.
Następnie wprowadzam do kalorymetru 2 cm3 stężonego kwasu siarkowego i mierzę zmiany temperatury przez pierwsze 5 min co 0,5 min, następnie co 1 min przez ok. 30 min, wyniki zapisuję w tabeli 2.
3. Wyznaczenie molowej entalpii zobojętniania w reakcji wodorotlenku sodu z kwasem siarkowym.
W zlewce, która zawiera 100cm3 wody rozpuszczam NaOH w ilości potrzebnej do zobojętnienia 2 cm3 stężonego kwasu siarkowego. Roztwór oziębiam do temperatury wody stosowanej w poprzednich pomiarach.
Oziębiony roztwór NaOH przelewam do kalorymetru i notuję zmiany temperatury w odstępach co 1 min w czasie 10 min.
Wprowadzam do kalorymetru 2 cm3 stężonego kwasu siarkowego i ciągle mieszając mierzę temperaturę przez pierwsze 5 min co 0,5 min, następnie co 1 min przez ok. 30 min.
Sposób przedstawienia wyników:
1. Wyznaczenie pojemności cieplnej kalorymetru
Zapisuję wskazania termometru w tabeli:
Czas (min.)
|
Okres początkowy |
Okres główny i końcowy |
||||||||||||||||||||||||||||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
10,5 |
11 |
11,5 |
12 |
12,5 |
13 |
13,5 |
14 |
14,5 |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
29 |
30 |
|
Temp. (ºC) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Substancja
Molowa entalpia rozpuszczania
Masa substancji
Objętość wody
Zmiana temperatury
- NH4Cl (KCl)
- 15,99 (18,33) kJ∙mol-1
- m1 = ……… g
- V = 100 cm3
- ∆1T = ………ºC
Sporządzam wykres zmian temperatury układu od czasu. Metodą graficzną wyznaczam wartość Δ1T i obliczam pojemność cieplną kalorymetru.
2. Wyznaczenie molowej entalpii rozpuszczania kwasu siarkowego VI w wodzie
Zapisujemy wskazania termometru w tabeli:
Czas (min.)
|
Okres początkowy |
Okres główny i końcowy |
|||||||||||||||||||||||||||||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
10,5 |
11 |
11,5 |
12 |
12,5 |
13 |
13,5 |
14 |
14,5 |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
29 |
30 |
||
Temp. (ºC) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
pojemność cieplna kalorymetru
masa H2SO4 (objętość 2 cm3)
objętość wody
zmiana temperatury
- C = ……… kJ∙K-1
- m2 = ……… g
- V = 100 cm3
∆2T = ……… ºC
Wykreślam wykres zmian temperatury układu od czasu. Metodą graficzną wyznaczam wartość Δ2T.
Obliczam molową entalpię rozpuszczania H2SO4.
3. Wyznaczenie molowej entalpii zobojętniania w reakcji wodorotlenku sodu z kwasem siarkowym.
Zapisujemy wskazania termometru w tabeli:
Czas (min.)
|
Okres początkowy |
Okres główny i końcowy |
|||||||||||||||||||||||||||||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
10,5 |
11 |
11,5 |
12 |
12,5 |
13 |
13,5 |
14 |
14,5 |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
29 |
30 |
||
Temp. (ºC) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
pojemność cieplna kalorymetru
molowa entalpia rozpuszczania H2SO4
masa H2SO4 (o objętości 2 cm3)
masa NaOH
zmiana temperatury
- C = ……… kJ∙K-1
- ∆Hm = ……… kJ∙mol-1
- m2 = ……… g
- mNaOH = ……… g
- ∆3T = ……… ºC
Sporządzam wykres zależności temperatury od czasu -T = f(t).
Obliczam molową entalpię zobojętniania mocnego kwasu (H2SO4) mocną zasadą (NaOH).
4. Wyznaczanie ∆T
Wykreślam krzywą idealnego wyrównania temperatur.
Obliczenia:
Wykresy:
Wnioski:
V-,
Wyszukiwarka
Podobne podstrony:
Entalpia zobojętniania Wojtek, Studia Politechnika Poznańska, Semestr I, Chemia, Chemia laboratoria,
entalpia zobojętnienia Guzika, Studia Politechnika Poznańska, Semestr I, Chemia, Chemia laboratoria,
Destylacja wojtek, Studia Politechnika Poznańska, Semestr I, Chemia, Chemia laboratoria, Destylacja
PROTOKÓŁ - analiza termiczna, Studia Politechnika Poznańska, Semestr I, Chemia, Chemia laboratoria,
potencjal wojtek, Studia Politechnika Poznańska, Semestr I, Chemia, Chemia laboratoria, Wyznaczanie
Rozpad nuklidu, Studia Politechnika Poznańska, Semestr I, Chemia, Chemia laboratoria, Stała rozpadu
galwanotechnika, Studia Politechnika Poznańska, Semestr I, Chemia, Chemia laboratoria, Galwanotechni
SPRAWOZDANIE WZOR nr2, Politechnika Poznańska (ETI), Semestr I i II, Metalurgia I Odlewnictwo, Ręczn
Reakcja oscylacyjna Wojtek, Studia Politechnika Poznańska, Semestr I, Chemia, Chemia laboratoria, Re
Wzór Sprawozdanie sem 4, Politechnika Poznańska, Inżynieria Bezpieczeństwa, 4. SEMESTR, Technologia
Reakcje oscylacyjne Guzika, Studia Politechnika Poznańska, Semestr I, Chemia, Chemia laboratoria, Re
Stała rozpadu Wojtek, Studia Politechnika Poznańska, Semestr I, Chemia, Chemia laboratoria, Stała ro
sprawozdanie - Entalpia zobojętniania, STUDIA POLIBUDA, INŻYNIERIA MATERIAŁOWA, SEMESTR I, Chemia, L
MO - sprawozdanie 2(1), Politechnika Poznańska, Mechatronika, SEMESTR I, Odlewnictwo
Tabelka pomiarowa do 21, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
egz TRB I 2009 c, Politechnika Poznańska, Budownictwo, Technologia Robót Budowlanych, Zaliczenie wyk
KONWENCJA BERNEŃSKA, MiBM Politechnika Poznanska, VII semestr TPM, Ochrona Własności Intelektualnej,
03 - Pomiar twardości sposobem Brinella, MiBM Politechnika Poznanska, IV semestr, labolatorium wydym
więcej podobnych podstron