Robert Maniura
Sprawozdanie z ćwiczenia nr 7: Stała dysocjacji słabego kwasu.
Wyniki ćwiczenia:
Opracowanie wyników:
Roztwory buforowe |
Absorbancja E |
||
Lp. |
pH |
Skład roztworu |
|
1 |
6,39 |
25 cm3 0,1 n KH2PO4 + 2,8 cm3 0,1 n NaOH (+ 0,1 cm3 0,01 n p-nitrofenolu) |
0,055 |
2 |
6,82 |
25 cm3 0,1 n KH2PO4 + 6,0 cm3 0,1 n NaOH (+ 0,1 cm3 0,01 n p-nitrofenolu) |
0,110 |
3 |
7,44 |
25 cm3 0,1 n KH2PO4 + 15,0 cm3 0,1 n NaOH(+ 0,1 cm3 0,01 n p-nitrofenolu) |
0,335 |
4 |
7,85 |
25 cm3 0,1 n KH2PO4 + 20,0 cm3 0,1 n NaOH (+ 0,1 cm3 0,01 n p-nitrofenolu) |
0,435 |
5 |
8,01 |
25 cm3 0,1 n KH2PO4 + 23,0 cm3 0,1 n NaOH (+ 0,1 cm3 0,01 n p-nitrofenolu) |
0,635 |
6 |
13,00 |
0,1 n NaOH (+ 0,1 cm3 0,01 n p-nitrofenolu) |
1,3 |
![]()
przy długości fali ![]()
2. Wstęp teoretyczny:
Przykładem słabego elektrolitu niech będzie w poniższych rozważaniach słaby kwas ![]()
. Jego cząsteczki ulegają w roztworze wodnym częściowej dysocjacji na jony wodorowe ![]()
i aniony ![]()
według równania:
![]()
Reakcja dysocjacji jest odwracalna, gdyż część jonów łączy się ponownie w cząsteczki nie zdysocjowane. W stanie równowagi, który ustala się natychmiast, liczba cząsteczek rozpadających się w jednostce czasu jest równa liczbie cząsteczek powstających w wyniku łączenia się jonów.
Zgodnie z prawem działania mas, stała równowagi tej reakcji, zwana stałą dysocjacji, wyraża się wzorem:
![]()
Stała dysocjacji (nazwana również stałą jonizacji) jest to więc stosunek iloczynu stężeń jonów, na które rozpadł się dany elektrolit, do stężenia cząsteczek nie zdysocjowanych.
Stała dysocjacji charakteryzuje elektrolit znacznie lepiej aniżeli stopień dysocjacji, ponieważ nie zależy od stężenia, lecz wyłącznie od temperatury i natury rozpuszczalnika.
W danej temperaturze stała dysocjacji jest wielkością stałą, natomiast wraz ze wzrostem temperatury jej wartość na ogół zwiększa się, co jest zrozumiałe, gdyż w wyższej temperaturze, w związku z energiczniejszymi ruchami cząsteczek, dysocjacja rośnie, zwiększa się iloczyn stężeń jonów, a tym samym rośnie też wartość ilorazu wyrażającego stałą dysocjacji.
Jak wiadomo, mimo rozcieńczenia roztworu stała dysocjacji nie ulega prawie żadnej zmianie, podczas gdy stopień dysocjacji wraz z rozcieńczeniem wyraźnie się zwiększa.
Z powyższego równania wynika, że podczas dysocjacji słabego elektrolitu ![]()
powstają jednakowe ilości jonów ![]()
i ![]()
. Jeśli przez ![]()
oznaczyć ogólne stężenie molowe elektrolitu, a przez ![]()
jego stopień dysocjacji, to stężenie obu rodzajów jonów będą równe ![]()
, natomiast stężenie nie zdysocjowanych cząsteczek ![]()
.
Po podstawieniu tych wyrażeń we wzorze na stałą dysocjacji otrzymujemy
![]()
Równanie ![]()
stanowi matematyczne ujęcie tzw. prawa rozcieńczeń, sformułowanego przez Ostwalda. Prawo to określa zależność między stopniem dysocjacji, stałą dysocjacji i stężeniem.
Dla elektrolitów słabo zdysocjowanych na jony, w roztworach niezbyt rozcieńczonych, stopień dysocjacji jest liczbą małą i dlatego, nie popełniając dużego błędu, można przyjąć, że ![]()
; wtedy
![]()
Na tej podstawie prawo rozcieńczeń Ostwalda można wyrazić następująco:
Stopień dysocjacji słabego elektrolitu jest odwrotnie proporcjonalny do pierwiastka kwadratowego ze stężenia tego elektrolitu w roztworze i wprost proporcjonalny do pierwiastka ze stałej dysocjacji.
Wynika z tego, że stopień dysocjacji zależy od stałej dysocjacji, jak również i od początkowego stężenia substancji dysocjującej; wraz ze zmniejszeniem tego stężenia, a więc wraz z rozcieńczeniem roztworu, stopień dysocjacji się zwiększa, tak jak to było powiedziane uprzednio.
Znając stałą dysocjacji danego kwasu lub zasady, można obliczyć stężenie jonów wodorowych lub wodorotlenowych w jego roztworze oraz stopień dysocjacji, lub znając stopień dysocjacji - jego stałą dysocjacji.
W doświadczeniu wykorzystuje się absorbancję poszczególnych roztworów. Dla reakcji dysocjacji ![]()
możemy napisać
![]()
oraz 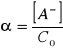
gdzie całkowite stężenie słabego kwasu ![]()
stąd ![]()
Wraz ze wzrostem stężenia NaOH rośnie absorbancja, osiągając dla jednego z roztworów ![]()
, co odpowiada całkowitej dysocjacji. Stąd dla poszczególnych roztworów:
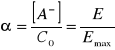
; 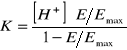
gdzie ![]()
oznacza absorbancję poszczególnych roztworów, ![]()
oznacza maksymalną absorbancję.
Obliczam stałą dysocjacji dla poszczególnych roztworów według powyższych równań oraz oszacuję błędy procentowy dla poszczególnych roztworów przyjmując stałą dysocjacji ![]()
Roztwory buforowe |
Absorbancja E |
Stała dysocjacji (obliczona) |
Błąd procentowy |
||
Lp. |
pH |
Skład roztworu |
|
|
|
1 |
6,39 |
25 cm3 0,1n KH2PO4 + 2,8 cm3 0,1n NaOH (+ 0,1 cm3 0,01 n p-nitrofenolu) |
0,055 |
1,79*10-8 |
70,97 % |
2 |
6,82 |
25 cm3 0,1n KH2PO4 + 6,0 cm3 0,1n NaOH (+ 0,1 cm3 0,01 n p-nitrofenolu) |
0,110 |
1,39*10-8 |
77,43 % |
3 |
7,44 |
25 cm3 0,1n KH2PO4 + 15,0 cm3 0,1n NaOH (+ 0,1 cm3 0,01 n p-nitrofenolu) |
0,335 |
1,26*10-8 |
79,67 % |
4 |
7,85 |
25 cm3 0,1n KH2PO4 + 20,0 cm3 0,1n NaOH (+ 0,1 cm3 0,01 n p-nitrofenolu) |
0,435 |
7,10*10-9 |
88,54 % |
5 |
8,01 |
25 cm3 0,1n KH2PO4 + 23,0 cm3 0,1n NaOH (+ 0,1 cm3 0,01 n p-nitrofenolu) |
0,635 |
9,33*10-9 |
84,95 % |
6 |
13,0 |
0,1 n NaOH (+ 0,1 cm3 0,01 n p-nitrofenolu) |
1,3 |
--- |
--- |
Obliczam średnią wartość stałej dysocjacji oraz błąd procentowy przyjmując stałą dysocjacji ![]()
.
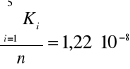
oraz błąd procentowy wynosi 80,31 %.
4. Wnioski:
Błędy, które wynikły podczas doświadczenia spowodowane są niedokładnością odmierzania objętości do sporządzenia poszczególnych roztworów buforowych. Podczas pomiaru pH dla tych roztworów mogły wystąpić również błędy spowodowane niedokładnym obmyciem elektrody po każdym pomiarze.
5. Literatura:
Kazimierz Gumiński „Wykłady z chemii fizycznej”.
3
Wyszukiwarka
Podobne podstrony:
Stała dysocjacji słabego kwasu, Studia, Politechnika
Stała dysocjacji słabego kwasu
Pomiary pH roztworów oraz wyznaczanie stałej dysocjacji słabego kwasu Ćw 4
,podstawy chemii nieorganicznej L,stała dysocjacji słabego elektrolitu
Pomiary pH roztworów oraz wyznaczanie stałej dysocjacji słabego kwasu Ćw 4
Wyznaczanie stopnia asocjacji kwasu octowego w rozpuszczalni, Studia, Politechnika
Rozpad nuklidu, Studia Politechnika Poznańska, Semestr I, Chemia, Chemia laboratoria, Stała rozpadu
Przemiana do kwasu acetylosalicylowego, Studia, Politechnika
gr4, Stała dysocjacji jest miarą mocy kwasu lub zasady
Stała rozpadu Wojtek, Studia Politechnika Poznańska, Semestr I, Chemia, Chemia laboratoria, Stała ro
ćwiczenie 6 wyznaczanie stałej dysocjacji pKa słabego kwasu metodą konduktometryczną
Prawo inżynierskie i ochrona własności intelektualnych. Wykład 3, Studia, Politechnika Łódzka - Pend
Testy biodegradacji, Studia, Politechnika
Chf9, Studia, Politechnika
Wyznaczanie stałej reakcji szybkości zmydlania estru, Studia, Politechnika
CH.F.L9, Studia, Politechnika
ZAKAAD CHEMI FIZYCZNEJ, Studia, Politechnika
C15, Studia, Politechnika
podstawowe informacje o ochronie prawnej wzorów przemysłowych, Studia - Politechnika Śląska, Zarządz
więcej podobnych podstron