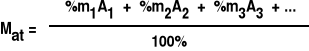Teorie budowy atomu
|
|||||||
Cząstki elementarne w atomie:
|
|||||||
jądro |
protony |
m = 1,674 * 10-27 kg = 1u |
ładunek dodatni 1,6*10-19 C |
||||
|
neutrony |
m = 1,675 * 10-27 kg = 1u |
ładunek obojętny |
||||
chmura elektronowa |
elektrony |
|
ładunek ujemny 1,6*10-19 C |
||||
|
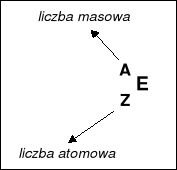
A = liczba nukleonów = liczba protonów + liczba neutronów
Z = liczba protonów = liczba elektronów |
||||||
|
|
||||||
Izotopy |
|
||||||
Izotopy wodoru: |
|||||||
|
|
|
|||||
p = 1; n = 0; e = 1 |
p = 1; n = 1; e = 1 |
p = 1; n = 2; e = 1 |
|||||
Masa atomowa pierwiastka - uśredniona masa atomu zależna od zawartości procentowej poszczególnych izotopów i ich liczb masowych:
|
|||||||
Nuklid - zbiór identycznych atomów np. zbiór atomów deuteru
Rdzeń atomowy = jądro + elektrony niewalencyjne |
|||||||
Konfiguracje elektronowe:
|
Powłoki elektronowe: max liczba elektronów na danej powłoce 2n2
K (max liczba el = 2); L (max liczba el = 8); M (max liczba el = 18); N (max liczba el = 32); O; P; Q
Kolejność obsadzania elektronami poszczególnych stanów kwantowych:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s
|
Konfiguracje elektronowe powłok walencyjnych:
|
BUDOWA ATOMU
1
Wyszukiwarka
Podobne podstrony:
CHEMIA NIEORGANICZNA 2
Chemia nieorganiczna zadania 4 Nieznany
Chemia nieorganiczna zadania 7 Nieznany
KationyV, Farmacja, I rok, Chemia nieorganiczna
egz 2010-pytania spisane(1), Chemia nieorganiczna- egzmain
Tlenowce(1), Chemia, Chemia nieorganiczna
testy chemia2, Biotechnologia PŁ, chemia nieorganiczna
CHEMIA KOSMETYCZNA Chemia nieorganiczna (tlenki, kwasy, sole
Chemia nieorganiczna egzamin
Chemia nieorganiczna sciaga
iloczynrozw, ~ NOTATKI, przedmioty obowiązkowe I rok, Chemia Nieorganiczna, Kolokwia
Nierganiczna cw teoria, semestr 1, Chemia, Nieorganiczna teoria
odp test 1, 1 ROK Biologia i geologia, spec.Ochrona przyrody, Chemia nieorganiczna
nieorgany-pytania2, Studia - Chemia kosmetyczna UŁ, II rok, III semestr, CHEMIA NIEORGANICZNA labora
KationyIIB, Farmacja, I rok, Chemia nieorganiczna
ligandy, Studia POLSL, STUDIA, Chemia nieorganiczna, teoria
WF-Zagadnienia Egz-22.05.2014, rok numero uno, chemia nieorganiczna
więcej podobnych podstron