Nr. ćwiczenia 7 |
Temat: Wyznaczanie stałej równowagi reakcji tworzenia kompleksów jodu z aromatami. |
grupa 34 |
Data wyk.
25,01,2000 |
Katarzyna Augustyn Tomasz Motyka |
zespół
|
OPIS ĆWICZENIA
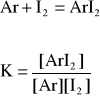
Celem ćwiczenia jest wyznaczenie stałej równowagi dla reakcji tworzenia kompleksów jodu z aromatami.
Stała ta jest niewielka co do wartości i dlatego do jej wyznaczenia stosujemy spektrofotometr.
Pozwala on określić stężenia powstających kompleksów,ponieważ ani czysty jod ani aromaty nie adsorbują w widmie 300 nm.
Dla roztworu jod - aromat absorbancja jest równa absorbancji jodu, aromatu i powstałego kompleksu.
Zgodnie z prawem Lamberta-Beera:
A = a b [Ar] + a b [I2] + a b [ArI2]
gdzie : A-absorbancja
a -absorbancja molowa
b -szerokość kuwety
![]()
Przy zastosowaniu znacznego nadmiaru aromatu w stosunku do jodu, stężenie aromatu można uznać w przybliżeniu za stałe; natomiast stężenie wolnego jodu jest równe różnicy stężenia początkowego [I2] oraz stężenia kompleksu [ArI2]; wówczas wyrażenia na stałą równowagi i absorbancję przybierają postać:
A = aAr b [Ar] + aI b ( [I2]0 - [ArI2] ) + aAr b [ArI2]
Obliczając z obu wyrażeń wartość [ArI2] i porównując je otrzymujemy równanie postaci
y = ax + b; gdzie x jest odwrotnością stężenia aromatu.
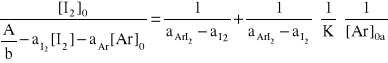
2. WYKONANIE ĆWICZENIA
2.1 Przygotowanie mieszanin roztworów jodu i aromatu z roztworów:
0,0004 mol I2 w n-heptanie
2 mol toluen w n-heptanie
Nr roztworu |
Stosunek objętości |
Objętość I2 [cm3] |
Objętość Ar [cm3] |
Objętość mieszaniny [cm3] |
1 |
1:0,09 |
3,0 |
0,27 |
3,27 |
2 |
1:0,3 |
2,5 |
0,75 |
3,25 |
3 |
1:1,5 |
1,4 |
2,1 |
3,5 |
4 |
1:2,1 |
1,0 |
2,1 |
3,1 |
5 |
1:3,0 |
0,8 |
2,4 |
3,2 |
6 |
1:7,5 |
0,4 |
3,0 |
3,4 |
2.2 Badanie wartości absorbancji przy pomocy spektrofotometru.
Roztwór |
T [%] |
A |
A |
Ar |
91,3 91,6 |
0,03953 0,03810 |
0,038815 |
I2 |
94,4 94,5 |
0,02502 0,02457 |
0,024795 |
1 |
72,0 72,0 |
0,1427 0,1427 |
0,1427 |
2 |
44,8 44,5 |
0,3487 0,3516 |
0,35015 |
3 |
49,2 49,2 |
0,3080 0,3080 |
0,3080 |
4 |
94,4 94,5 |
0,02502 0,02457 |
0,0248 |
5 |
53,9 53,9 |
0,2684 0,2684 |
0,2684
|
6 |
69,4 69,6 |
0,1586 0,1574 |
0,158 |
3. OBLICZENIA
![]()
3.1 Obliczenie absorbancji molowej „a”
gdzie: A- absorbancja,
b -stała kuwety (b=0,998)
c -stężenie
a I2 =62,1 [dm3/mol cm]
a Ar =0,0194 [dm3/mol cm]
3.2 Obliczenie wartości funkcji (A, [I2]0, [Ar]0 )
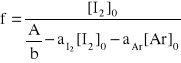
3.3 Obliczenie stałej równowagi K.
-z wykresu odczytujemy wartość funkcji w punkcie przecięcia z osią Y,
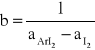
b=0,00021
-obliczenie współczynnika nachylenia prostej:
a= 0,000528
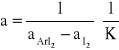
-obliczenie stałej K
K= 0,317
K= b/a
4. ZESTAWIENIE WYNIKÓW.
Lp. |
Objętość I2 [cm3] |
Objętość Ar [cm3] |
Stęż. [I2]0 w próbce [mol/l] 10-4 |
Stęż.[Ar]0 w próbce [mol/l] |
A |
1/[Ar]0 |
f( A,[I2]0, [Ar]0) |
1 |
3,00 |
0,27 |
3,670 |
0,165 |
0,1427 |
6,060 |
0,003140 |
2 |
2,50 |
0,75 |
3,080 |
0,450 |
0,3501 |
2,170 |
0,000956 |
3 |
1,40 |
2,10 |
1,600 |
1,200 |
0,3080 |
0,830 |
0,000580 |
4 |
1,00 |
2,10 |
1,290 |
1,350 |
0,2684 |
0,740 |
0,000549 |
5 |
0,80 |
2,40 |
1,000 |
1,500 |
0,2347 |
0,660 |
0,000500 |
6 |
0,40 |
3,00 |
0,470 |
1,760 |
0,1580 |
0,568 |
0,000388 |

4. ZESTAWIENIE WYNIKÓW.
Lp. |
Objętość I2 [cm3] |
Objętość Ar [cm3] |
Stęż. [I2]0 w próbce [mol/l] 10-4 |
Stęż.[Ar]0 w próbce [mol/l] |
A |
1/[Ar]0 |
f( A,[I2]0, [Ar]0) |
1 |
3,00 |
0,27 |
3,670 |
0,165 |
0,1427 |
6,060 |
0,003140 |
2 |
2,50 |
0,75 |
3,080 |
0,450 |
0,3501 |
2,170 |
0,000956 |
3 |
1,40 |
2,10 |
1,600 |
1,200 |
0,3080 |
0,830 |
0,000580 |
4 |
1,00 |
2,10 |
1,290 |
1,350 |
0,2684 |
0,740 |
0,000549 |
5 |
0,80 |
2,40 |
1,000 |
1,500 |
0,2347 |
0,660 |
0,000500 |
6 |
0,40 |
3,00 |
0,470 |
1,760 |
0,1580 |
0,568 |
0,000388 |
1
1
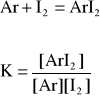
![]()
![]()
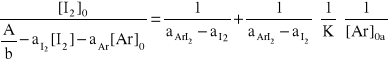
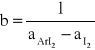
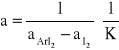

Wyszukiwarka
Podobne podstrony:
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
więcej podobnych podstron