![]()
Jony żelaza(III) tworzą z jonami tiocyjanianowymi w środowisku słabo kwaśnym czerwono zabarwione związki kompleksowe typu FeSCN2+, Fe(SCN)63-. Kompleksy te są dość słabe i dlatego intensywność zabarwienia zależy nie tylko od stężenia jonów żelaza(III) w roztworze, ale również od obecności innych substancji kompleksujących żelazo(III). Zbyt duża kwasowość powoduje zmniejszenie stężenia jonów tiocyjanianowych (tworzy się kwas tiocyjanianowy HSCN), co również wpływa na intensywność zabarwienia kompleksu.
Metody spektroskopii absorbcyjnej oparte są na selektywnej absorbcji promieniowania przez cząsteczki lub jony. Absorbcja promieniowania przechodzącego przez warstwę badanej substancji ma z reguły charakter selektywny, tzn. wielkość absorbcji zależy od długości fali użytego promieniowania. Graficzna postać tej zależności nosi nazwę widma absorbcyjnego i jest charakterystyczna dla danej substancji. Widma substancji absorbujących światło w zakresie widzialnym posiadają na ogół postać krzywej z jednym wyraźnie zaznaczonym maksimum.
Ilościowy opis absorbcji promieniowania przez materię opisuje prawo Lamberta Beera:
![]()
gdzie: c - stężenie czynnika absorbującego,
a - stężeniowy współczynnik absorbcji,
l - grubość warstwy pochłaniającej promieniowanie.
Jeśli stężenie wyrażone jest liczba moli substancji w 1 dm3 roztworu, współczynnik a jest nazywany współczynnikiem absorbcji i jest oznaczany przez ![]()
. Współczynnik ten jest wielkością charakterystyczna dla danej substancji niezależną od stężenia, grubości warstwy absorbujacej i natężenia promieniowania.
Spektrofotometria w zakresie widzialnym do niedawna nazywana kolorymetrią opiera się na pomiarze absorbcji promieniowania widzialnego. Podstawowymi przyrządami stosowanymi w tym celu są spektrofotometry lub kolorymetry z filtrem. Najczęściej stosowaną metodą wykonywania oznaczeń jest metoda krzywej wzorcowej. Polega ona na przygotowaniu szeregu wzorców oznaczanej substancji o różnych stężeniach w tym samym rozpuszczalniku, na pomiarze absorbancji tych roztworów przy wyznaczonej uprzednio długości fali ![]()
i w końcu na sporządzeniu wykresu zależności absorbancji od stężenia. W przypadku stosowania się roztworu do prawa Lamberta Beera zależność ta powinna być prostoliniowa. Następnie wykonuje się pomiar absorbancji badanego roztworu i odczytuje z wykresu jego stężenie.
Odczynniki:
Roztwór soli żelaza o stężeniu 0.1 mg/cm3,
2 M HNO3,
10% KSCN,
woda destylowana
Sprzęt laboratoryjny:
spektrofotometr,
kolbki o pojemności 100 cm3,
pipeta z podziałką na 10 cm3
Wykonanie ćwiczenia:
Do sześciu kolbek o pojemności 100 cm3 dodano kolejno 0,5, 1, 2, 4, 5 i 8 cm3 roztworu wzorcowego soli żelaza(III) o stężeniu 0,1 mg/cm3. Następnie do każdej próbki kolbki dodano po 2 cm3 2 molowego HNO3 oraz po 10 cm3 10% roztworu tiocyjanianu potasu i dopełniono wodą do kreski. Do siódmej kolbki dodano taką samą ilość reagentów z wyjątkiem soli żelaza(III). Roztwór ten służy jako roztwór porównawczy.
Wyznaczono krzywą absorbcji (widmo absorbcyjne) dla tiocyjanianu żelaza(III) w zakresie 400-600 nm. Pomiary wykonano w obszarze wysokich wartości absorbancji w odstępach, co 5 nm. Przy wyznaczaniu widma absorbcyjnego wykresu odczytano długość fali, odpowiadającą maksimum absorbcji dla danej soli.
Zmierzono absorbancję poszczególnych roztworów względem roztworu porównawczego przy długości fali odpowiadającej maksimum absorbancji. Z otrzymanych wyników wykreślono krzywą wzorcową a=f(c) odkładając na osi rzędnych wartość absorbancji A, a na osi odciętych stężenie żelaza c wyrażone w mol / dm3.
Do kolby z otrzymanym roztworem żelaza dodano takie same ilości kwasu azotowego oraz tiocyjanianu potasu jak do roztworów służących do sporządzania krzywej wzorcowej. Roztwór uzupełniono wodą do objętości 100 cm3 i dokładnie wymieszano. Zmierzono absorbancję tak otrzymanego roztworu, a z krzywej kalibracyjnej odczytano stężenie badanego roztworu.
Obliczono współczynnik ekstynkcji molowej wiedząc, że jest on równy współczynnikowi kierunkowemu krzywej kalibracji, a zatem równy tangensowi kąta nachylenia prostej przy grubości kuwety równej 1 cm.
Znając współczynnik ekstynkcji obliczono z równania Lamberta Beera stężenie otrzymanej soli żelaza(III) i porównano (w celu sprawdzenia poprawności obliczeń) z wynikami uzyskanymi z krzywej wzorcowej.
Wyniki doświadczenia:
Dodana objętość r-ru soli żelaza (cm3) |
Stężenie (mol/dm3) |
Długość fali (nm) |
Absorbancja |
0,5 |
8,952*10-6 |
475 |
0,075 |
1 |
1,790*10-5 |
475 |
0,147 |
2 |
3,581*10-5 |
475 |
0,268 |
4 |
7,162*10-5 |
475 |
0,528 |
6 |
1,074*10-5 |
475 |
0,807 |
8 |
1,432*10-4 |
475 |
1,048 |
roztwór otrzymany |
? |
475 |
0,530 |
Obliczenie stężenia molowego (przykład):
0,1 mg - 1 cm3 0,05 mg - 100 cm3 1 mol - 55,85 g
x - 0,5 cm3 y - 1000 cm3 z - 5*10-4 g
x = 0,05 mg y = 0,5 mg = 5*10-4 g z = 8,952*10-6 mol
c = 8,952*10-6 mol/dm3
Wyznaczenie masy Fe(III) zawartej w badanej próbce:
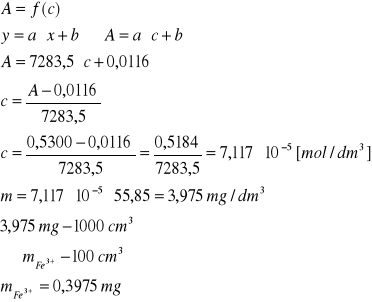
Masa próbki żelaza wyznaczona poprzez zmierzoną przy długości fali ![]()
Absorbancję równą ![]()
, wynosi ![]()