Wydział Chemiczny.
Kierunek
Papiernictwo i Poligrafia.
Ćwiczenie Nr 22
OZNACZENIE STAŁEJ SZYBKOŚCI HYDROLIZY ESTRU W ŚRODOWISKU ZASADOWYM.
Ćwiczenie wykonano:14.04.2003 r.
Sprawozdanie złożono:17.04.2003 r.
Poprawione sprawozdanie; 24.04.2003 r
Ćwiczenie wykonała:
Agnieszka Andruszkiewicz
Część teoretyczna.
Celem ćwiczenia jest oznaczenie stałej szybkości hydrolizy estru w środowisku zasadowym.
Hydroliza octanu etylu, estru, w środowisku zasadowym przebiega według reakcji;
CH3COOC2H5 + OH- --------------- CH3COO-+ C2H5OH
Natomiast szybkość tej reakcji opisana jest równaniem, jest to reakcja drugiego rzędu;
![]()
= k ( a-x )( b-x)
a - stężenie początkowe jonów hydroniowych
b - stężenie początkowe estru
x - ubytek stężenia estru,
natomiast stałą szybkości można obliczyć z zależności;
![]()
ln![]()
= k t
2.Wykonanie i opis ćwiczenia.
1.Umieszczan 3 kolby a) 250ml-wodorotlenek sodu
b) 250ml - octan etylu
c) 750ml-pusta.
umieszczam te 3 kolby w termostacie o temp.25 C
2.Następnie 20ml HCl o znanym mianie ok.0,05m miareczkuję roztworem Ba(OH)2 wobec fenoloftaleiny, V1 -15,1ml
V2 - 18,1ml
V3 - 18,0ml
Na tej podstawie miareczkowania obliczam stężenie wodnego roztworu wodorotlenku baru
CBa(OH) =![]()
CHCl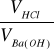
=![]()
0,05![]()
= 0,0277 mlo/dm3
3.Po 15 -20 minutach wlewam roztwory do pustej kolby ,(czas 13.30)
4. Z kolby pobieram ok. 100ml roztworu i wstawiam do termostatu o temp.60 C, próbka ta określa wartość V&
5.Po 5 min. pobieram 50ml, roztworu i wlewam do erlenmeyerki zawierającej 20 ml 0,05m HCl. Nadmiar odmiareczkowuje Ba(OH)2. Widzimy że z upływem czasu zwiększa n się stężenie katalizatora, co powoduje wzrost ilości [ml] Ba(OH)2 potrzebnej do odmiareczkowania nadmiaru.
t[czas] minury |
15 |
30 |
45 |
60 |
75 |
90 |
V[ml] Ba(OH)2 |
9,7 |
10,5 |
11,2 |
11,9 |
12,5 |
13,2 |
6. Reakcja hydrolizy przebiega stosunkowo szybko i nie można określić stężenia początkowego jonów hydroksylowych Ba(OH)2 (wartość a)przez pobranie próbki mieszaniny reakcyjnej, dlatego do określenia tej wartości muszę przygotować tzw. ślepą próbę zawierającą; 20ml HCl + 25ml H20 + 25 ml NaOH.
V0 Ba(OH) - 6,7ml wartość ślepej próby.
Objętość Ba(OH)2 zużyta do zmiareczkowania tej próbki pozwala obliczyć wartość a
a =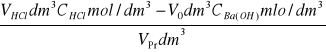
a = ![]()
= ![]()
= =16,276mol/dm3
7. Następnie miareczkuję próbkę z termostatu o temp 60 C, uzyskana wartość odpowiada wartości V& V &1 - 14,4 ml
V&2 - 14,2 ml
8. Obliczam początkowe stężenia estru b
b = 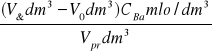
= 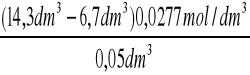
= ![]()
= ![]()
= 4,2104mol/dm3
9. Obliczam chwilowe stężenie produktów reakcji ;
x = 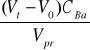
[ mol/dm3 ]
Obliczone chwilowe wartości stężeń produktu reakcji
t[czas] minuty |
15 |
30 |
45 |
60 |
75 |
90 |
V[ml] Ba(OH)2 |
9,7 |
10,5 |
11,2 |
11,9 |
12,5 |
13,2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
x stężęnie [ mol/dm3 ] |
1,668 |
2,105 |
2,493 |
2,8808 |
3,2132 |
3,601 |
Wykonanie wykresu

Obliczone wartości stałej szybkości hydrolizy estru, dla określonych czasów.
|
Czas [min] |
Y |
k |
1 |
15 |
0,0328 |
0,002189 |
2 |
30 |
0,0459 |
0,001532 |
3 |
45 |
0,0605 |
0,0013457 |
4 |
60 |
0,07933 |
0,001322 |
5 |
75 |
0,101 |
0,001348 |
6 |
90 |
0,1394 |
0,001549 |
|
|
|
0,009288 |
|
|
|
0,001548 |
Otrzymana wartość stałej szybkości hydrolizy estru w środowisku zasadowym wynosi;
wartość obliczona k = 0,001548 min-1 lub k = 2,58 10-5 s-1.
wartość z wykresu k = 0,0014 min -1 lub k = 2,33 10-5 s-1.
otrzymane wartości są porównywalne.
Szybkość reakcji chemicznej definiowana jest jako ubytek stężenia substratu lub przyrost stężenia produkty w jednostce czasu; r = ![]()
. Rzeczywista szybkość jest pochodną stężenia substratu lub produktu względem czasu. Szybkość reakcji jest funkcją stężenia reagentów.
Obserwacje;
Podczas wykonywania ćwiczenia, zaobserwowałam wzrost ilości [lm] roztworu Ba(OH)2, którym miareczkowałam, roztwór CH3COOC2H5 + OH- z dodatkiem 20ml HCl wobec fenolowtaleiny, podczas przebieg reakcji hydrolizy octanu etylu, estru, w środowisku zasadowym przebiegającej według reakcji;
CH3COOC2H5 + OH- --------------- CH3COO-+ C2H5OH.
Zauważyłam zwiększenie się objętości Ba(OH)2 wraz z upływem czasu, spowodowane jest to zwiększaniem się stężenia użytego katalizatora HCl.
4
Wyszukiwarka
Podobne podstrony:
5994
5994
5994
5994
5994
5994
5994
5994
051id 5994
więcej podobnych podstron