Laboratorium fizyki |
|
Ćwiczenie nr C4. Wyznaczanie ciepła właściwego ciał stałych. |
|
Pluton II |
Gajewski Tomasz Gochnio Michał |
12 marca 2003 |
Ocena: |
Celem ćwiczenia było wyznaczenie ciepła właściwego ołowiu .
Ciepłem właściwym nazywamy ilość energii potrzebną do zmiany temperatury jednostki masy substancji (1 kg) o jednostkowy przyrost temperatury (1K).
Jednostką ciepła właściwego w układzie SI jest [c]=J/kg K .
Przebieg ćwiczenia :
Do znajdującej się w kalorymetrze wody został włożony ołów ,który został wcześniej ogrzany do temperatury 74,2 K .Na wskutek wymiany ciepła pomiędzy ciałem o wyższej temperaturze z ciałem o temperaturze niższej . Zakładając że kalorymetr izoluje układ ciał
od wpływów czynników zewnętrznych odpowiedni , a wymiana ciepła zachodzi zgodnie z zasadą zachowania energii można zapisać równanie bilansu cieplnego .
Qo=Qp
gdzie : Qo - energia oddawana przez ołów ,
Qp - energia pobrana przez wodę i kalorymetr .
wzory na odpowiednie ciepła są odpowiednie :
Qo =cx mc (Tc-Tk)
Qw =cw mw (Tk-Tw)
Qk =ck mk (Tk-Tw)
gdzie:Qw - energia pobrana przez wodę
Qk - energia pobrana przez kalorymetr
cx- ciepło właściwe badanego ciało
cw - ciepło właściwe wody
ck - ciepło właściwe kalorymetru
mc - masa badanego ciala
mw - masa wody
mk - masa kalorymetru
Tc - temperatura ciała
Tk - temperatura kalorymetru
Tw - temperatura wody
Masa |
Badane ciało
|
mc[kg] |
0.25572 |
|
10-5 |
|
Kalorymetr
|
mk[kg] |
0.09188 |
|
10-5 |
|
Woda
|
mw[kg] |
0.17937 |
|
10-5 |
Temperatura |
Początkowa ciała |
Tc[K] |
348,7 |
|
0,1
|
|
Początkowa kalorymetru |
Tw[K] |
296,7 |
|
0,1 |
|
Końcowa
|
Tk[K] |
297 |
|
0,1 |
Ciepło Właściwe |
Wody
|
cw[J/kg*K] |
4200 |
|
|
|
Kalorymetru
|
ck[J/kg*K] |
|
|
|
|
Badanego ciała |
cx[J/kg*K] |
|
|
|
Czas
Temperatura |
T1 |
T2 |
T3 |
T4 |
T5 |
T6 |
T7 |
T8 |
T9 |
T10 |
t (0C) |
27,0 |
26,5
|
26,1
|
25,8 |
25,8
|
25,8
|
25,8
|
25,8
|
25,8
|
25,8
|
Tabela 2 „Przebieg zmian temperatury cieczy w kalorymetrze po wrzuceniu ogrzanego ciał
3.Obliczenia.
W naszym doświadczeniu ogrzane ciało umieszczamy w kalorymetrze wypełnionym wodą o niższej temperaturze. Ilość energii oddanej przez to ciało, ochłodzone od temperatury początkowej do temperatury końcowej opisać można wzorem:
Q=cx*mc*(Tc - Tk),
Gdzie:
cx to ciepło właściwe
mc to masa ciała
Tc to temperatura początkowa
Tk to temperatura końcowa
Energię pobraną przez wodę opisać można zgodnie z równaniem: Q1=cw*mm*(Tk-Tw)
Gdzie:
cw to ciepło właściwe wody
mw to masa wody
Tw to temperatura początkowa kalorymetru
Tk to temperatura końcowa kalorymetru
Energie pobraną przez kalorymetr wraz z mieszadełkiem obliczyć można korzystając z zależności
Q2= ck*mk *(Tk - Tw).
Gdzie:
mk to masa naczynia kalorymetrycznego wraz z mieszadłem,
ck to ciepło właściwe, z którego wykonany jest kalorymetr;.
Aby obliczyć ciepło właściwe ciała stałego korzystamy z bilansu cieplnego ułożonego dla wymiany energii pomiędzy ołowiem ogrzanym do określonej temperatury, a kalorymetrem napełnionym cieczą o niższej temperaturze, stąd otrzymujemy równanie:
Q=Q1+Q2
A zatem:
cx*mc*(Tc-Tk)=cw*mw*(Tk-Tw)+ck*mk*(Tk-Tw)
Z równania tego otrzymamy:
(cw*mw + ck*mk) * (Tk - Tw)
Cx=-------------------------------------
mc * (Tc - Tk)
Ze względu na postać tego wzoru, możemy mierzyć temperaturę zarówno w skali Celsiusza jak i Kelwina.
Podstawiając wartości liczbowe z tabeli nr1 otrzymujemy:
(4200 J/kg*K * 0.17937 kg + 902.5 J/kg*K * 0.09188 kg)*( 296,7 K - 298.8 K)
Cx=------------------------------------------------------------------------------------------------
0.25572 kg*(348,7 K - 296,7 K)
Cx=132.07 [J/kgK]
Pomiar ciepła właściwego obarczony jest błędem, ponieważ zarówno pomiar masy na wadze elektronicznej, pomiar temperatury jak i wartość ciepła właściwego wody obarczone są błędem.
Stąd błąd w obliczeniu ciepła właściwego ołowiu obliczamy zgodnie ze wzorem:
![]()
![]()
cw+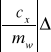
mw+![]()
ck+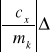
mk+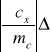
mc+![]()
Tc+![]()
Tw+![]()
Tk
Wnioski :
Wartość jaką otrzymaliśmy wyniosła 132.07 J/kg K jest to wartość zbliżona do wielkości
tablicowej , która wynosi 160J/kg K. Wartość błędu bezwzględnego obliczona za pomocą
całki zupełnej wyniosła J/kg K. Jest to wartość stosunkowa duża.
Na tak duży błąd mogło wpłynąć niezbyt sprawne przekładanie ołowiu z ultratermostatu
do kalorymetru z wodą.
Wyszukiwarka
Podobne podstrony:
C4-7, SGSP, Fizyka, Fizyka lab, laborki fizyka
Laboty krztychu C4, SGSP, Fizyka, Fizyka lab, laborki fizyka
fiza, SGSP, Fizyka, Fizyka lab, laborki fizyka
O3-4gs, SGSP, Fizyka, Fizyka lab, laborki fizyka
laborki J1, SGSP, Fizyka, Fizyka lab, laborki fizyka
C@2, SGSP, Fizyka, Fizyka lab, laborki fizyka
Zeimer, SGSP, Fizyka, Fizyka lab, laborki fizyka
C4, SGSP, Semestr 1, Fizyka, Fizyka lab
J1-1, SGSP, Fizyka, Fizyka lab, laborki fizyka
J1-6, SGSP, Fizyka, Fizyka lab, laborki fizyka
fire, SGSP, Fizyka, Fizyka lab, laborki fizyka
J1-6Krzychu cwiczenia J!, SGSP, Fizyka, Fizyka lab, laborki fizyka
Tabela2, SGSP, Fizyka, Fizyka lab, laborki fizyka
Tabele1i3, SGSP, Fizyka, Fizyka lab, laborki fizyka
laborki O3 GAJOS, SGSP, Fizyka, Fizyka lab, laborki fizyka
laborki J1-jaiczeski, SGSP, Fizyka, Fizyka lab, laborki fizyka
więcej podobnych podstron