TEST
Pierwiastek o konfiguracji elektronowej 1s22s22p63s23p64s13d5:
leży w bloku s, grupie 6, okresie 4,
leży w bloku d, grupie 8, okresie 3,
leży w bloku d, grupie 6, okresie 4,
to chrom o liczbie atomowej 24.
Liczby kwantowe - n=4, l=2, ml=2 opisują:
jeden z orbitali 4d,
jeden z orbitali 2d,
jeden z orbitali 4f,
jeden z orbitali 4p.
Równania: h1= s + 21/2py , h2 = s + (3/2)1/2 px - (1/2)1/2 py , h3 = s - (3/2)1/2 px - (1/2)1/2 py
opisują trzy hybrydyzowane orbitale sp2,
opisują trzy hybrydyzowane orbitale sp,
opisują trzy hybrydyzowane orbitale sp3
opisują elektrony pierwszej powłoki rdzeniowej.
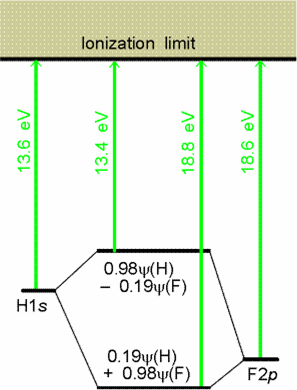
Na podstawie przedstawionego diagramu poziomów energetycznych można stwierdzić iż:orbital p ma większy udział w wiążącym orbitalu molekularnym,
elektrony tworzące wiązanie są przesunięte w kierunku atomu fluoru,
nie powstaje wiązanie, gdyż energia wiążącego orbitalu molekularnego jest mniejsze od obu orbitali atomowych przedstawionych na diagramie,
orbital p ma większy udział w antywiążącym orbitalu molekularnym.
Treść zakazu Pauliego jest następująca:
wszystkie elektrony o tej samej głównej liczbie kwantowej należą do tej samej powłoki elektronowej,
orbitalom należącym do tego samego typu (to jest trzem orbitalom typu p, pięciu typu d, siedmiu typu f) odpowiada dla danej liczby kwantowej n ta sama energia,
liczba niesparowanych elektronów w danej podpowłoce powinna być możliwie największa,
w atomie nie mogą znaleźć się dwa elektrony o wszystkich identycznych liczbach kwantowych.
W ogniwie galwanicznym Zn | ZnSO4(r) | klucz elektrolityczny | CuSO4(r) | Cu , potencjały standardowe redoks wynoszą: Zn ↔ Zn2+ + 2e- , E = - 0,76 V, Cu ↔ Cu2+ + 2e-, E = + 0,34 V.
cynk ulega utlenieniu na katodzie, miedź ulega redukcji na anodzie,
na katodzie miedź ulega utlenieniu, a cynk na anodzie redukcji,
cynk ulega redukcji na katodzie, miedź ulega utlenieniu na anodzie,
miedź ulega redukcji na katodzie, natomiast cynk ulega utlenieniu na anodzie.
Atom węgla numer 3 w 3-etylo-2,4-dimetyloheptanie jest atomem węgla:
pierwszorzędowym,
drugorzędowym,
trzeciorzędowym,
czwartorzędowym.
Cząsteczka jest liniowa. Cztery atomy leżą wzdłuż jednej linii prostej. Chmury elektronowe tworzące wiązania węgiel-wodór i węgiel-węgiel są cylindrycznie symetryczne względem linii łączącej jądra, są to więc wiązania δ. Każdy z atomów węgla do utworzenia orbitali sp użył tylko jednego ze swych trzech orbitali p . Każdy z dwóch pozostałych orbitali składa się z dwóch równych pętli, których osie skierowane są pod kątem prostym do osi pozostałego orbitalu p oraz osi orbitalu sp. Powyższy opis dotyczy:
cząsteczki acetylenu,
cząsteczki etenu,
cząsteczki etanu,
żadnej cząsteczki, gdyż sam jest niezgodny z zasadami kwantomechanicznymi opisu rozmieszczenia elektronów w cząsteczkach.
N-etylo-2-butyloamina jest aminą:
pierwszorzędową
drugorzędową
trzeciorzędową
czwartorzędową
Które twierdzenie dotyczące aldehydów i ketonów jest prawdziwe:
cząsteczki tych związków nie mogą tworzyć wiązań wodorowych między sobą,
cząsteczki o mniejszych masach cząsteczkowych są dobrze rozpuszczalne w wodzie ze względu na możliwość tworzenia się wiązań wodorowych między cząsteczkami związku karbonylowego i wody,
grupa karbonylowa jest przestrzenie płaska, węgiel posiada trzy orbitale shybrydyzowane sp2 tworzące trzy wiązania δ z dwoma atomami tlenu i jednym atomem węgla.
Występowanie zdelokalizowanych elektronów π w cząsteczce benzenu oraz ich udział w tworzeniu wielu wiązań:
powoduje zwiększenie trwałości cząsteczki,
powoduje zmniejszenie trwałości cząsteczki,
nie ma wpływu na trwałość cząsteczki,
jest twierdzeniem nieprawdziwym, gdyż cząsteczka benzenu nie spełnia warunku Hückla.
W reakcji H2PO4- + H2O Ⴋ H3O+ + HPO42- , anion H2PO4- jest:
utleniaczem,
zasadą sprzężoną z HPO42-,
solą,
reduktorem.
Odczyn roztworu po hydrolizie octanu sodu CH3COONa będzie:
kwaśny,
alkaliczny,
obojętny.
Areny to związki organiczne:
nasycone węglowodory cykliczne,
węglowodory posiadające grupę funkcyjną OH,
to związki o wiązaniu podwójnym,
węglowodory z czwartorzędowymi atomami węgla.
Wskaż równanie, które nie jest procesem redoks:
4NH3 + 5O2 --> 4NO + 6H2O,
2H2S + 3O2 --> 2SO2 + 2H2O,
Zn + 2HCl --> ZnCl2 + H2O,
Ba(OH)2 + 2HNO3 --> Ba(NO3)2 + 2H2O.
Wyszukiwarka
Podobne podstrony:
testy 1rok egz2, Inżynieria Środowiska PW semestr I, chemia, sesja
11. testy 1rok v4, Inżynieria Środowiska PW semestr I, chemia, sesja
9. testy 1rok v4a, Inżynieria Środowiska PW semestr I, chemia, sesja
testy 1rok egz3, Inżynieria Środowiska PW semestr I, chemia, sesja
8. testy 1rok vegz, Inżynieria Środowiska PW semestr I, chemia, sesja
12. testy 1rok egz4, Inżynieria Środowiska PW semestr I, chemia, sesja
16. egzamin test 1rok, Inżynieria Środowiska PW semestr I, chemia, sesja
13. egzamin 17 09 04, Inżynieria Środowiska PW semestr I, chemia, sesja
SESJA ZIMOWA 2006, Inżynieria Środowiska PW semestr I, chemia, sesja
zestawy 28 pyt Ai B mini, Inżynieria Środowiska PW semestr I, chemia, sesja
wszystkie pytania - ciąg - sciąga - długopisy, Inżynieria Środowiska PW semestr I, chemia, sesja
egzamin test v3, Inżynieria Środowiska PW semestr I, chemia, sesja
sciaga chemia, Inżynieria Środowiska PW semestr I, chemia, sesja
egzamin 2004sciaga, Inżynieria Środowiska PW semestr I, chemia, sesja
więcej podobnych podstron