III Kolokwium chemia lekow
Zasady organiczne i ich sole
Wiadomości ogólne
Najczęściej aminy trzech rzędów, heterocykle zawierające azot, będący centrum zasadowości związku. Wartości pKb od 1,7 do 13,4 a pH od 2,8 do 11,5.
Reakcje charakterystyczne dla wszystkich zasad i ich soli:
z odczynnikiem Dragendorffa (KBiI4 w CH3COOH), który wytrąca osady barwy czerwonopomarańczowej o wzorze: Zasada*KBiI4*HI (Wyjątek: pochodne ksantyny pierwszorzędowe aminy)
płynem Lugola, który w środowisku kwasowym tworzy nierozpuszczalne w wodzie nadjodku zasad o zabarwieniu brunatnym
nasyconym roztworem kwasu pikrynowego, który ze związkami azotowymi (wyj. poch. ksantyny) tworzy trudno rozpuszczalne w wodzie sole barwy żółtej które różnicuje się na podstawie temperatury topnienia co może być w wykorzystane w analizie jakościowej.
roztworem taniny, która wytrąca białe osady rozpuszczalne w nadmiarze odczynnika
Ponadto stosuje się odczynnik Mayera K2HgI4, Nesslera, kwas fosfomolibdenowy, krzemowolframowy, fosfowolframowy, tetrafenyloboran sodu, chlorki rtęci i kadmu - dające osad barwy białej, oraz szereg związków dających barwne osady: jodoplatynian potasu, sól Reineckego.
Tok analizy
Wstępem do analizy jakościowej jest badanie rozpuszczalności w wodzie oraz badanie pH związku co umożliwia rozróżnienie wolnych zasad od ich soli choć istnieją liczne wyjątki.
TLC
Rozpuszczalność w rozpuszczalnikach organicznych.
Chemiczna analiza jakościowa zasad heterocyklicznych
Haloperidol - daje reakcje charakterystyczna dla aktywnej grupy metylenowej występującej w sąsiedztwie grupy karbonylowej. Reakcja z 1,3-dinitrobenzenem w obecności 15% KOH zabarwienie fioletowe
Piperazyna - daje reakcje heterocyklicznych zasad azotowych. Do specyficznych reakcji należą próby z cyjanożelazianem potasu (czerwone wobec NaHCO3), nitroprusydkiem sodu (granatowe) i ninhydryny (żółte zab.)
Cynnaryzyna - pochodna Piperazyna. Posiada rodnik difenylometanowy, który łatwo polimeryzuje w środowisku 96% kwasu siarkowego
Urotropina (metanamina) - słabo reaguje z odczynnikiem Dragendorffa, z azotanem srebra tworzy osad rozpuszczalny w nadmiarze odczynnika i HNO3
(CH2)6H4*3AgNO3
jest także wrażliwa na czynniki hydrolityczne: w środowisku kwasowym hydroliza do formaldehydu w zasadowym do amoniaku.
Pentetrazol - reakcje z solami metali ciężkich oraz specyficzna z chromianem potasu w obecności kwasu siarkowego i nadtlenku wodoru do warstwy organicznej (chloroform, benzen) przechodzi związek o zabarwieniu fioletowym (kompleks nietrwały rozkładający się już w temperaturze pokojowej).
Pochodne pirazolu
- reakcje charakterystyczne dla zasad + reakcje charakterystyczne dla związków z ugrupowaniem enolowym. Oraz wrażliwość na utlenianie.
Utlenianie aminofenazonu: proces dwuetapowy - w pierwszej fazie powstają rodniki o zabarwieniu fioletowym w drugiej ich dimery o zabarwieniu żółtobrunatnym. W reakcji stosuje się łagodne utleniacze: AgNO3, FeCl3, HNO2
W przypadku nowalginy w pierwszym etapie tworzy się sól srebrowa a następnie pojawia się niebieskie zmętnienie przechodzące w zielony produkt kondensacji:
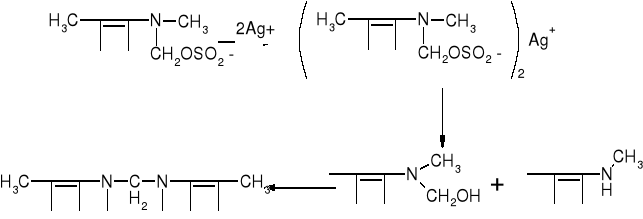
Aminofenazon pod wpływem silniejszych środków utleniających (KMnO4) się do N-metylo-N-acetylo-dimetyloksamylofenylohydrazyny.
Fenazon dzięki obecności aktywnego atomu wodoru może tworzyć formę enolowo-betainową oraz uczestniczyć w reakcjach kondensacji i podstawienia:
z jodem tworzy się rozpuszczalny w acetonie i etanolu 4-jodofenazon
z kwasem azotowym III lub NaNO3 powstaje w obecności kwasu siarkowego zielono zabarwiony 4-nitrozofenazon ulegający kondensacji z α-naftolem (w środowisku zasadowym) do pomarańczowo zabarwionego produktu.
Fenazon i propyfenazon tworzą kompleksy barwy fioletowej z CrO5, reagują z zabarwieniem czerwonym z aldehydem 4-dimetyloaminobenzoesowym z zabarwieniem czerwonym.
Aminofenazon i nowalgina zabarwiają się w reakcji Emersona na czerwono:

Nowalgina ulega w środowisku kwasowym rozkładowi z wydzieleniem SO2 i formaldehydu.
Pochodne benzodiazepiny
W środowisku silnie kwasowym (20% HCl) ogrzewane pod chłodnicą zwrotną (0,5 h) ulegają hydrolizie z rozszczepieniem układu diazepiny Obok glicyny i metyloaminy (wykrywalne z ninhydryną) powstają pochodne, benzofenonu, które dają reakcje charakterystyczne dla grupy Ar-NH2
Nitrazapam i klonazepam można wykryć, ponieważ zawierają grupę nitrową reagującą z NaOH i redukującą się wodorem in statu nascendi.
Rozróżnienie poszczególnych pochodnych dokonuje się na podstawie wykrycia grupy metylenowej, atomu chlorowca etc.
Kofeina
Zarówno kofeina jak i jej pochodne wytrącają białe osady z roztworem taniny i HgCl2 rozpuszczalne w nadmiarze odczynnika. Reagują w stosunku 1:1 z roztworem jodu w KI w obecności HCl. Utleniają się także pod wpływem perhydrolu w stężonym kwasie solnym do tetrametylomureksydu. Kofeina nie daje pozytywnych reakcji z azotanem srebra, Parri, teofilidynowej (w odróżnieniu od teobrominy i teofiliny)
Etofilina utlenia się w obecności 96% kwasu siarkowego - w ciągu minuty K2Cr2O7 zabarwia się na zielono. Fenetylina reaguje z odczynnikiem Marquisa z barwą jasnopomarańczową.
Sole zasad organicznych.
Substancje krystaliczne barwy białej lub żółtej, z reguły dobrze rozpuszczalne w wodzie, najczęściej pochodne amin aromatycznych/alifatycznych różnych rzędów lub heterocykle zawierających zasadowy atom azotu.
Pochodne amin alifatycznych
Lignokaina - obecność drugorzędowej grupy aminowej warunkuje reakcje barwną z 10% chlorkiem kobaltu. Po hydrolizie w środowisku silnie kwasowym lidokaina daje reakcje grupy Ar-NH2
Prenylamina - biały osad z odczynnikiem Mayera (K2HgI4), solą Reinecke'a, oraz standardowe reakcje pierścienia aromatycznego.
Prokainamid - reakcje grupy Ar-NH2, oleiste krople z 15% roztworem NaOH.
TETRACYKLINY - substancje o zabarwieniu żółtym najczęściej chlorowodorki, amfoteryczne: rozpuszczają się w kwasach jak i w zasadach. Obecność III rzędowej grupy minowej warunkuje charakter zasadowy, a grupy enolowe i fenolowe warunkują słabe właściwości kwasowe.
czerwonobrunatne zabarwienie z FeCl3,
sprzęganie go pomarańczowych produktów z diazozwiąkami (w obecności węglanu sodu)
2 mol/l roztwór NaOH żółtopomarańczowe zabarwienie z fluorescencją (zależną od rodzaju związku) w UV
z 1% roztworem aldehydu dimetyloaminobenzoesowego w 96% H2SO4 żółte zabarwienie przechodzące w brunatne pod wpływem temperatury
Pochodne alkoholamin
Efedryna i bametan w środowisku zasadowym barwią się z roztworem siarczanu miedzi. (zabarwienie warstwy organicznej (po dodaniu eteru) - purpurowe, wodnej - niebieskie:
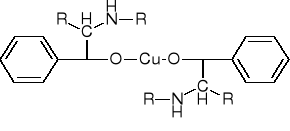
Fenyloetyloaminy z II rzędową grupą alkoholowa łatwo utleniają się ponadto pod wpływem ninhydryny, nadmanganianu potasu, cyjanożelazianu potasu, jodu, nadjodanów.
Suksametonium - z 30% NaOH nieprzyjemny zapach (trimetyloetanoloamina), szmaragdowozielone zabarwienie z CoCl2 i heksacyjanożelazianem potasu, pozytywna reakcja z rezorcynolem (kwas bursztynowy)
Adyfenina - z odczynnikiem Marquisa pomarańczowe zabarwienie, z 65% kwasem azotowym fioletowe przechodzące pod wpływem zasad w „aci” fioletowoczerwone, standardowe reakcje grupy estrowej.
Edan - z 10% NaOH bezbarwne oleiste krople, z 10% kwasem siarkowym podczas ogrzewania wydziela się zapach kwasu octowego, reakcje zacylowanej grupy fenolowej i transestryfikacji. Po hydrolizie pozytywna reakcja z chlorkiem żelaza.
Prokaina - reakcje aromatycznej grupy aminowej, z 15% roztworem NaOH bezbarwne oleiste krople przechodzące w biały krystaliczny osad.
Oksyfenoina - reakcja z błękitem bromofenolowym w obecności wodorofosforanu potasu i węglanu sodu. Reakcja na wykrywanie jonu bromkowego.
Sole heterocyklicznych zasad alifatycznych
Atropina - próba Vitaliego: po rozpuszczeniu w 65% kwasie azotowym odparowaniu do sucha na łaźni wodnej i dodaniu niewielkiej ilości rozcieńczonego KOH pojawia się charakterystyczne fioletowe zabarwienie (4-nitroapoatropina), pod wpływem K2Cr2O7 w 96% kwasie siarkowym wydziela się charakterystyczny zapach aldehydu benzoesowego. Reakcja Wasicky'ego z aldehydem dimetyloaminobenzoesowym pojawia się czerwonofioletowe zabarwienie pogłębiające się po dodaniu kilku kropel wody.
Kodeina - reaguje z odczynnikami zawierającymi 96% kwas siarkowy przechodząc w epomorfinę lub jej 3,4-chinon. Z odczynnikiem Marquisa produkt o zabarwieniu fioletowym (stabilizowana mezomerycznie forma jonu oksoniowego). Z roztworu jej soli, kodeiny nie można wytrącić amoniakiem a wyłącznie NaOH lub KOH.
Hydroksyzyna - próby na obecność fluorowca organicznie związanego. Ze stężonym (96%) kwasem siarkowym zabarwienie żółtoczerwone.
Pochodne imidazolu i imidazoliny
Pilokarpina - w roztworach wodnych nietrwała i ulega różnym przemianom chemicznym - między innymi do kwasu pilokarpowego. Rozróżnienie metodą TLC. Fioletowe zabarwienie warstwy organicznej w reakcji z CrO5. Utlenienie HgCl2 do wolnej rtęci. W 10% NaOH oleiste krople.
Pochodne imidazoliny hydrolizują w środowisku zasadowym do pochodnych etylenodiaminy, które dają reakcje na grupę aminową a poszczególne związki rozróżnia się na podstawie licznych reakcji barwnych (Marquisa, Erlicha, solą Reineckego, kwasem azotowym). Fioletowe zabarwienie w reakcjach z ninhydryną oraz nitroprusydkiem sodu wobec NaOH i NaHCO3.
Antazolina ulega sprzęganiu z solą diazoniową 4-nitroaniliny.
Pochodne chinoliny i izochinoliny
Wytrącają czerwone osady z odczynnikiem Dragendorffa, w obecności kwasów tlenowych wykazują niebieską fluorescencję, dają reakcje charakterystyczne dla wiązania nienasyconego. Pozytywne próby: talejochinowa i erytrochinowa.
Papaweryna po ogrzaniu z bezwodnikiem octowym w 96% kwasie siarkowym wykazuje intensywna jasnozieloną fluorescencję. Pod wpływem mieszaniny nitrującej roztwór zabarwia się na fioletowo (zw. sulfonowy), porem czerwono (6'-nitropapaweryna*H2SO4) a po dodaniu wody krystalizuje żółta nitropapaweryna. Z 10% FeCl3 zabarwienie zielone przechodzące w fioletowe a pod wpływem kwasu azotowego ciemnoczerwone.
Chlorochina - próby na obecność fluorowca organicznie związanego, w reakcji z dwuchromianem potasu w kwasie siarkowym zabarwienie czerwone.
Alkaloidy chinowe - z kwasem siarkowym (16%) niebieska fluorescencja, reakcje wiązania nienasyconego, reakcja talejochinowa - zielone zabarwienie, erytrochinowa - czerwone. 10% roztwór jodu w etanolu wobec kwasu octowego i siarkowego - osad w kształcie rombów.
Pochodne hydrazynoftalazyny, dibenzoazepiny, akrydyny i fenotiazyny.
Mono i di hydrazynoftalazyny reagują z odczynnikami łagodnie utleniającymi: brom, jod, odczynniki Tollensa i Fehlinga.
Hydralazynoftalazyny - reakcje podstawienia hydrazynowego, z 10% NaOH zabarwienie żółte, 50% roztwór chlorku żelaza - zabarwienie niebieskie, nitroprusydek sodu w 20% NaOH czerwonofioletowe, pozytywne reakcje z Fe2+ (amarantowa barwa) i Hg2+ (pomarańczowa)
Etakrydyna - zielonkawa fluorescencja roztworu wodnego, żółty osad z kwasem siarkowym (16%) i dwuchromianem potasu. Ciemnoczerwone zabarwienie z 10% roztworem HNO2. Pozytywna reakcja z odczynnikiem Erlicha. Niebieskozielony osad z 0,05 mol/l roztworem jodu.
Fenotiazyny - obecność atomu siarki organicznie związanej, czerwone lub niebieskie zabarwienie z 96% kwasem siarkowym, prometazyna daje różowy osad z AgNO3 w 0,001mol/l kwasie siarkowym, z kwasem azotowym białe osady (wyjątek prometazyna - roztwór i osad różowy), duża wrażliwość na obecność światła i tlenu atmosferycznego, tworzenie barwnych wolnych rodników:
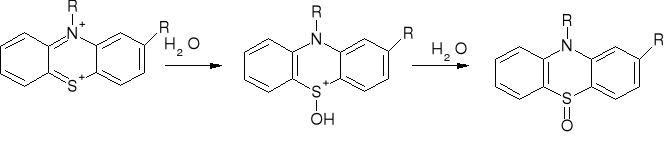
RÓŻNICOWANIE WSZYSTKICH ZWIĄZKÓW NA PODSTAWIE: ABSORPCJI UV/IR CHROMATOGRAFII CIENKOWARSTWOWEJ (TLC), ORAZ POMIARÓW TEMPERATURY TOPNIENIA SAMYCH ZWIĄZKÓW BĄDŹ ICH POCHODNYCH (NAJCZĘŚCIEJ PIKRYNIANÓW), PARAMETRÓW FIZYKOCHEMICZNYCH, ROZPUSZCZALNOŚCI W ROZPUSZCZALNIKACH ORGANICZNYCH JAK I WODNYCH ROZTWORACH.
6
Wyszukiwarka
Podobne podstrony:
Zasady org. i ich sole dla studentów, Chemia leków CM UMK
Chemia leków tabela1, Chemia leków CM UMK
sulfonamidy i ich sole, Chemia leków CM UMK
LEKI OBWODOWEGO UKADU NERWOWEGO, Chemia leków CM UMK
NIESTEROIDOWE LEKI PRZECIWZAPALNE, Chemia leków CM UMK
9 ZDROWIE PUBL. wykł. dla W. Lek, V rok Lekarski CM UMK, 19 - Zdrowie publiczne, materiały
koło2, II rok, II rok CM UMK, Giełdy, od Joe, FIZJOLOGIA, KOLOKWIA, NEUROFIZJOLOGIA, Neurofizjologia
przysadka cw histologia, II rok, II rok CM UMK, Giełdy, 2 rok, histologia
cw 3 Genetyka medlowska Dziedziczenie grup krwi CM UMK
KWASY KARBOKSYLOWE I ICH SOLE, farmacja cm umk, Farmacja III rok, chemia leków
cw 2, Dietetyka CM UMK, Chemia ogólna i żywności
tabelka pochodne kwasow karboksylowych, farmacja cm umk, Farmacja III rok, chemia leków
tabelka sulfonamidy i ich sole, farmacja cm umk, Farmacja III rok, chemia leków
UK PSYMP, farmacja cm umk, Farmacja III rok, chemia leków
tabelka zasady organiczne i ich sole, farmacja cm umk, Farmacja III rok, chemia leków
zadania fizyczna ćw. 4, Chemia fizyczna dr Cysewski farmacja CM UMK Bydgoszcz
więcej podobnych podstron