1. Część teoretyczna.
ogniwo elektrochemiczne - układ w którym wymiana elektronów pomiędzy reagentami zachodzi poprzez przewodnik zamykający obwód między elektrodami.
SEM ogniwa (siła elektromotoryczna) - jest to potencjał elektrostatyczny drutu przyłączonego do elektrody znajdującej się na schemacie ogniwa po stronie prawej, mierzony w stanie równowagi względem potencjału drutu z tego samego metalu, przyłączonego do elektrody lewej.
potencjał standardowy elektrody - jest to siła elektromotoryczna ogniwa zbudowanego w taki sposób, że lewym półogniwem jest standardowa elektroda wodorowa, a prawym badana elektroda. W związku z tym, że wartość potencjału standardowej elektrody wodorowej została przyjęta jako wzorcowa, równa zero, to mierzona siła elektromotoryczna jest równa potencjałowi standardowemu elektrody badanej
równanie Nernsta
![]()
gdzie:
![]()
- bezwzględna wartość współczynnika stechiometrycznego elektronów w równaniach połówkowych.
K - stała równowagi reakcji, K=f(T,p)
![]()
- aktywność danego składnika podniesiona do potęgi równej co do wartości współczynnikowi stechiometrycznemu tego składnika.
F - stała Faradaya, ![]()
W doświadczeniu wykorzystuje się pH -metr, którego głównym elementem jest ogniwo, zbudowane z elektrody szklanej i kalomelowej.
2. Cześć eksperymentalna.
Lp. |
Stężenie HCl [mol/dm3] |
SEM [V] |
|||
|
|
E1 |
E2 |
E3 |
Eśr |
1 |
|
|
|
|
|
2 |
|
|
|
|
|
3 |
|
|
|
|
|
4 |
|
|
|
|
|
5 |
|
|
|
|
|
6 |
|
|
|
|
|
7 |
|
|
|
|
|
3. Opracowanie wyników.
c |
√c |
Eśr |
y= Eśr-0,118 log m |
[mol/dm3] |
- |
[mv] |
[v] |
0,05 |
0,2236 |
32,91 |
0,03306 |
0,03 |
0,1732 |
29,06 |
0,02924 |
0,01 |
0,1 |
22,15 |
0,02239 |
0,005 |
0,07071 |
17,13 |
0,01740 |
0,002 |
0,05477 |
6,79 |
0,007011 |
Wykres zależności:
![]()
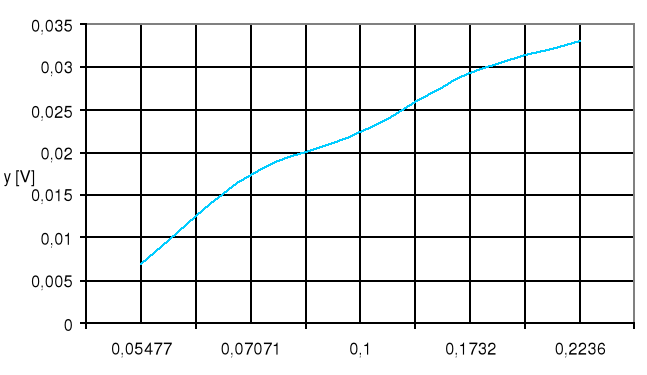
Ekstrapolacja prostej:
![]()
Ekstrapolowana wartość y, kiedy ![]()
:
Eo=y=![]()
[V]
Obliczenie teoretycznej wartości Eo:
ΠoAgCl=0,222 V
ΠoCh= 0,699 V
Zgodnie ze schematem ogniwa:
Ag| AgCl| HCl(m)|Q, QH2| Pt
Eo= ΠoCh- ΠoAgCl=0,699-0,222=0,477 V
4. Rachunek błędu.
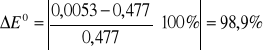
5. Uwagi i wnioski.
Zmierzona wartość obarczona jest dużym błędem. Moim zdaniem wynika on zarówno z metody pomiaru i obliczeń, jak również z błędu wykonania pomiaru. Z metody dlatego, że ekstrapolacja stanowi przybliżenie i powoduje błąd sama z siebie. Błąd wykonania pomiaru może wynikać z zbyt krótkiego czasu od wstawienia elektrody do próbki do pomiaru, w wyniku czego wskazanie woltomierza mogło nie uzyskać dostatecznego stanu równowagi, gwarantującego poprawny odczyt. Również stężenia przygotowywanych roztworów mogły charakteryzować się lekkim błędem w stosunku do zadanej wartości, aczkolwiek błąd ten, spowodowany niedokładnością stężenia uważam za bardzo mały.
![]()
![]()
Wyszukiwarka
Podobne podstrony:
Sprawozdanie 59, Studia, Pracownie, I pracownia, 59 Rezonans elektromagnetyczny, Waldek
Sprawozdanie i konspekt 59 Dominika, Politechnika Łódzka Biotechnologia, Chemia fizyczna LABORKI
Badanie propagacji mikrofal (59), Sprawolki
2 definicje i sprawozdawczośćid 19489 ppt
PROCES PLANOWANIA BADANIA SPRAWOZDAN FINANSOWYC H
W 11 Sprawozdania
Wymogi, cechy i zadania sprawozdawczośći finansowej
Analiza sprawozdan finansowych w BGZ SA
W3 Sprawozdawczosc
1 Sprawozdanie techniczne
59 04
2011 03 05 21;10;59
Karta sprawozdania cw 10
eksploracja lab03, Lista sprawozdaniowych bazy danych
2 sprawozdanie szczawianyid 208 Nieznany (2)
Fragmenty przykładowych sprawozdań
Lab 6 PMI Hartownosc Sprawozdan Nieznany
więcej podobnych podstron