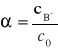Wydział
|
Kierunek
|
Grupa |
Data: |
|
Imię i nazwisko
|
Nr pary |
Nr ewidencyjny |
Prowadzący |
|
13. Stała dysocjacji
Cel ćwiczenia
Przedstawienie możliwości spektrofotometrycznego oznaczenia stopnia dysocjacji słabego kwasu w środowisku o różnym pH oraz stałej dysocjacji tego kwasu w przypadku, gdy kwas w formie niezdysocjowanej absorbuje światło w innym zakresie widmowym aniżeli jego anion.
Zasada pomiaru
W roztworach wodnych o-nitrofenol dysocjuje następująco:
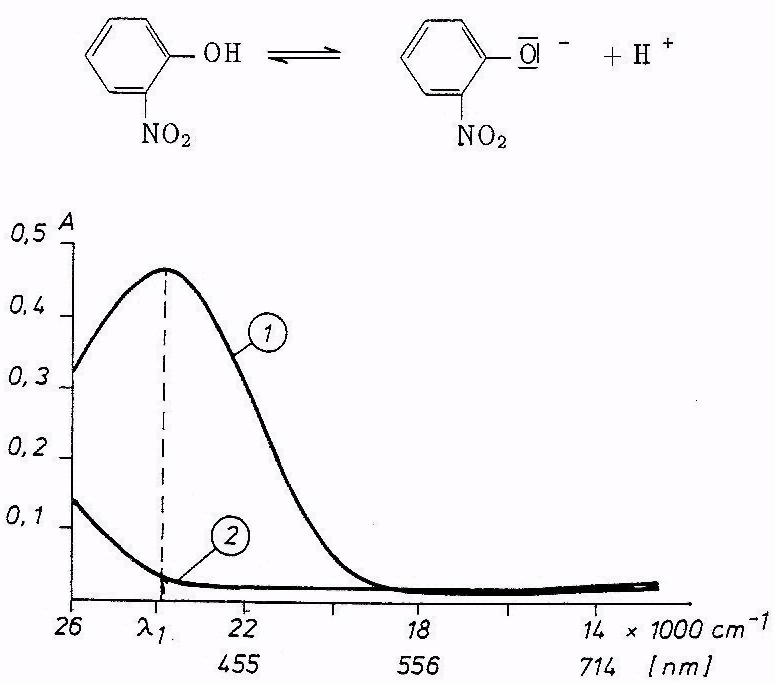
Ryc. Widma absorpcyjne (VIS) o-nitrofenolu w roztworze: l - zasadowym, 2 - kwaśnym
Cząsteczki niezdysocjowane o-nitrofenolu są bezbarwne, natomiast jego anion jest żółty. Czyli: niezdysocjowany kwas absorbuje promieniowanie w innym zakresie widmowym aniżeli jego anion, co przedstawiono na rycinie powyżej. Fakt ten umożliwia wyznaczenie stałej dysocjacji o-nitrofenolu metodą
kolorymetryczną, z wykorzystaniem równań.
![]()
![]()
W przypadku pomiarów absorpcji światła przez o-nitrofenol w widzialnym zakresie widma przy długości fali λ1 rycina powyżej, przy której absorbuje praktycznie tylko forma zdysocjowana (B-) tego kwasu, a forma niezdysocjowana (HB) nie absorbuje, czyli molowy współczynnik absorpcji εHB tej formy przy λ1 równy jest w przybliżeniu zeru, wyrażenie (13.27) na stopień dysocjacji znacznie się upraszcza:
![]()
gdzie A - wartość absorpcji o-nitrofenolu w buforze o pH pośrednim, zawierającym obie formy: zdysocjowaną i niezdysocjowaną, A∞ - wartość absorpcji o-nitrofenolu w roztworze silnie zasadowym, zawierającym jedynie jony fenolanowe B-.
Wartość A∞ otrzymujemy, mierząc absorpcję roztworu otrzymanego przez rozpuszczenie o-nitrofenolu w roztworze wodorotlenku sodowego o stężeniu 0,01 mol dm-3. W takim roztworze można w przybliżeniu założyć całkowitą dysocjację tego związku. Spełniona jest wówczas zależność A∞ = εB- ∙ c0 ∙ l. Należy podkreślić, że stopień dysocjacji można obliczyć za pomocą równania (powyżej) tylko wówczas, gdy stężenie całkowite (c0) o-nitrofenoln w buforze jest takie samo jak w roztworze wodorotlenku stosowanym do pomiaru A∞ oraz gdy roztwór o-nitrofenolu (a dokładniej jony fenolanowe) spełnia prawo Lamberta- Beera.
W przypadku, gdy zależność wartości absorpcji od stężenia fenolanu (cB-) nie jest linią prostą (układ nie spełnia prawa Lamberta-Beera), wówczas stężenie cB- może być oznaczone tylko graficznie z krzywej wzorcowej i oblicza się stopień dysocjacji (α). Stężenie jonów wodorowych (CH30-) oblicza się z wartości pH użytego buforu.
Stopień dysocjacji o-nitrofenolu (słaby elektrolit) zależy od pH środowiska, co można stwierdzić rozpuszczając go w buforach o różnym stężeniu jonów wodorowych.
Wykonanie ćwiczenia
1. Sporządzenie krzywej wzorcowej (zależności wartości absorpcji od stężenia fenolanu):
- przygotować w zlewkach o pojemności 25 cm3 10 roztworów wzorcowych zawierających różne stężenia jonów fenolanowych. Do ich przygotowania użyć o-nitrofenolu o stężeniu 5∙10-4 mol dm-3 w 0,01-molowym NaOH i roztwór wodny NaOH o stężeniu 0,01 mol dm-3 w ilościach podanych w tabeli I. Roztwory dokładnie wymieszać;
- zmierzyć wartości absorpcji tych roztworów przy λ1, tj. przy analitycznej długości fali, której wartość należy ustalić na podstawie widma. o-nitrofenolu, wykonanego w roztworze zasadowym, zamieszczonego na rycinie powyżej, korzystając ze skali liniowej długości fali, wyrażonej w centymetrach do potęgi minus pierwszej (cm-1), oraz z zależności:
![]()
gdzie 1/1 - analityczna długość fali (cm-1). Pomiary wartości absorpcji wykonać względem NaOH o stężeniu 0,01 mol dm-3
- wyniki zestawić w tabeli I.
2. Pomiar wartości absorpcji o-nitrofenolu w zależności od zmian wartości pH z zachowaniem stałego stężenia początkowego o-nitrofenolu.
- w zlewkach na 25 cm3 przygotować pięć roztworów buforowych w zakresie pH 4-8, po 10 cm3 każdego, przez zmieszanie odpowiednich ilości kwasu cytrynowego o stężeniu 0,1 mol dm-3 z kwaśnym fosforanem dwusodowym o stężeniu 0,:2 mol dm-3 (roztwory do przyrządzenia buforów pobierać za pomocą biuret);
- do każdego z pięciu przygotowanych buforów oraz do szóstego roztworu zawierającego 10 cm3 NaOH o stężeniu 0,01 mol dm-3 dodać po l cm3 wodnego roztworu o-nitrofenolu o stężeniu 5∙10-3 mol dm-3
- zmierzyć pH powyższych roztworów oraz wartość ich absorpcji względem roztworu NaOH o stężeniu 0,01 mol dm-3. Wyniki zebrać w tabeli II.
Uwaga. Opis spektrofotometru oraz sposób pomiaru wartości absorpcji znajduje się w opisie do ćwiczenia 11. lub 12., zależnie od rodzaju zastosowanego kolorymetru. Pomiary absorpcji powtórzyć trzykrotnie, a do obliczeń stosować wartość średnią.
Pomiar pH metodą potencjometryczną
Potencjometryczna metoda pomiaru pH polega na wykorzystaniu faktu, że potencjał takich elektrod jak wodorowa, chinhydronowa czy szklana zależy od stężenia jonów wodorowych w roztworze. Wielkość tego potencjału mierzymy przez pomiar siły elektromotorycznej ogniwa złożonego z elektrody odniesienia o stałym potencjale, jak np. kalomelowej, chlorosrebrowej, z jedną z wyżej wymienionych elektrod roboczych, np. szklaną.
Pomiaru pH dokonujemy pehametrem N5123 wyposażonym w elektrodę zespoloną złożoną z elektrody szklanej i chlorosrebrowej.
1. Uruchomienie pehametru:
- przed włączeniem zasilania należy przełącznik zakresów ustawić na „T”,
- przełącznik biegunowości ustawić na „-”, włączyć zasilanie klawiszem "Wł".
Po 5-10 min wstępnego wygrzewania pehametru można przystąpić do jego cechowania, a następnie do pomiaru pH. Pehametr należy wycechować za pomocą roztworu wzorcowego (o znanym pH, zwykle stosujemy odpowiedni bufor).
2. Cechowanie pehametru:
- wyjąć elektrodę z nasyconego roztworu KCl, w którym jest przechowywana, dokładnie opłukać wodą destylowaną, a następnie zanurzyć do roztworu wzorcowego,
- pokrętłem regulacji temperatury "TEMP" ustawić wskazówkę miernika na temperaturę roztworu wzorcowego,
- przełącznik rodzaju pomiaru ustawić w pozycji pH 14,
- pokrętłem "AP" ustawić wskazówkę miernika na wartość pH właściwą dla roztworu wzorcowego.
Po tych czynnościach pehametr jest gotowy do pomiaru pH roztworów badanych.
Uwaga. Od tej chwili nie wolno zmieniać położenia pokrętła "AP",
3. Pomiar pH:
- przełącznik zakresów ustawić w pozycji „T”,
- elektrodę opłukać dokładnie wodą destylowaną, osuszyć bibułą, po czym zanurzyć w roztworze badanym,
- pokrętłem regulacji temperatury ustawić wskazówkę miernika na temperaturę roztworu badanego, która powinna być zbliżona do temperatury roztworu wzorcowego,
- przełącznik zakresów ustawić w pozycji pH 14,
- odczytać na dolnej skali wartość pH roztworu badanego,
- przełącznik zakresów ustawić w pozycji „T”.
Przed każdym kolejnym pomiarem elektrodę dokładnie opłukać.
Sposób przedstawienia wyników
Tab. I. Zależność wartości absorpcji o-nitrofenolu od stężenia w roztworze zasadowym
Nr próby |
5∙10-4- molowy o-nitrofenol w 0,01-molowym roztworze NaOH (cm3) |
0,01-molowy NaOH (cm3) |
Stężenie fenolanu cB- (mol dm-3) |
Wartość absorpcji |
|||
|
|
|
|
pomiary |
wartość średnia |
||
|
|
|
|
I |
II |
III |
|
1 |
1 |
1 |
|
|
|
|
|
2 |
2 |
2 |
|
|
|
|
|
3 |
3 |
3 |
|
|
|
|
|
4 |
4 |
4 |
|
|
|
|
|
5 |
5 |
5 |
|
|
|
|
|
6 |
6 |
6 |
|
|
|
|
|
7 |
7 |
7 |
|
|
|
|
|
8 |
8 |
8 |
|
|
|
|
|
9 |
9 |
9 |
|
|
|
|
|
10 |
10 |
10 |
|
|
|
|
|
Grubość kuwety l = ………………cm
Analityczna długość fali λanal. = …………….nm
Tab. II. Wartości absorpcji o-nitrofenolu w roztworach o różnym pH
Nr próby |
0,1-molowy kwas cytrynowy (cm3) |
0,2-molowy Na2HPO4 (cm3) |
pH |
Wartość absorpcji |
Stężenie fenolanu cB-(mol dm-3) |
Stopień dysocjacji |
Stała dysocjacji |
|||
|
|
|
|
pomiary |
wartość średnia |
|
|
|
||
|
|
|
|
I |
II |
III |
|
|
|
|
l |
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
|
|
6 |
10 cm3 0,0 l- -molowego NaOH |
12,0 |
|
|
|
|
|
1 |
- |
|
Objętość 5∙10-3 - molowego o-nitrofenolu w H2O V = ……………….cm3
Stężenie o-nitrofenolu w próbach c0 = ………….……mol dm-3
Grubość kuwety l = ……………….cm
Analityczna długość fali λanal. = ………….……nm
Obliczenia
1. Wykreślić krzywą wzorcową, tj. zależność wartości absorpcji jako funkcji stężenia jonów fenolanowych (A = ƒ(cB-)) na podstawie pomiarów zebranych w tabeli I. Na wykres nanieść średnie wartości absorpcji. Skalę dobrać w ten sposób, aby krzywa była nachylona pod kątem około 45° do osi x.
2. Korzystając z krzywej wzorcowej i wartości absorpcji roztworów buforowych o-nitrofenolu (tab. II) odczytać stężenie jonów fenolanowych (cB-) w poszczególnych roztworach.
3. Obliczyć stopień dysocjacji (α) o-nitrofenolu w różnych buforach.
4. W przypadku spełnienia przez układ prawa Lamberta - Beera w badanym zakresie stężeń (patrz punkt 1.), obliczyć stopień dysocjacji (α) z równania α = A/A∞ przy czym jako A∞ wstawić wartość absorpcji otrzymaną dla próby nr 6 w tabeli II. Porównać otrzymane wartości stopnia dysocjacji z tego równania z wartościami uzyskanymi w punkcie 3.
5. Obliczyć wartość stałej dysocjacji (Ka) o-nitrofenolu w badanych buforach oraz jej wykładnik pKa(pKa = -lgKa). Do obliczeń tych stosować wartość α uzyskaną w punkcie 3., natomiast wartość CH3O- obliczyć z zależności:
![]()
zatem
![]()
Uwaga. Rezultaty obliczeń wstawić do tabel I i II. Średnią wartość stałej dysocjacji podać w przedziale ufności (α = 0,05).
Wyszukiwarka
Podobne podstrony:
13 stała dysocjacji
13 Stała Dysocjacji, 13. Stała dysocjacji
Moduł III cz 2 stała i stopien dysocjacji, zobojetnianie
stała dysocjacji infykatora
stałą dysocjacji
Stała dysocjacji
Chemia fizyczna - Ćw. 13 i 14 - Dysocjacja, Dysocjacja, hydroliza, pH,
pH stala dysocjacji zadania , 1
sprawozdanie stała dysocjacji
sprawozdanie stala dysocjacji
10 3 Stała i stopień dysocjacji
01 Stala i stopien dysocjacjiid Nieznany (2)
Moduł III-cz.2 -stała i stopien dysocjacji, zobojetnianie
,podstawy chemii nieorganicznej L,stała dysocjacji słabego elektrolitu
chem.fiz.stała dysocjacji, Inżynieria środowiska, inż, Semestr III, Chemia fizyczna, laboratorium
14 chemiaogolna wyklad 171109, Stała dysocjacji K zależy od temperatury
8.Dysocjacja elektrolityczna - stopień i stała dysocjacji, Chemia ogólna ćwiczenia
sprawozdanie stała dysocjacji
Stała dysocjacji słabego kwasu, Studia, Politechnika
więcej podobnych podstron