Kamila Ziobro
SPRAWOZDANIE Z CHEMII ANALITYCZNEJ ŚRODOWISKA
Potencjometria - porównanie tradycyjnej metody alkacymetrycznej z miareczkowaniem potencjometrycznym
1. TEORIA:
Aby dokonać porównania tych dwóch metod najpierw wyjaśnię na czym one polegają:
Alkacymetria - jeden z ważniejszych działów analizy miareczkowej, zwanej też analizą objętościową, w którym ustala się dokładne stężenie kwasów lub zasad poprzez miareczkowanie roztworów z użyciem odpowiednio zasad lub kwasów. W trakcie miareczkowania alakacymetrycznego zachodzi reakcja zobojętniania, która prowadzi do zmian pH mieszaniny. Zmiany te rejestruje się z użyciem chemicznych wskaźników pH, lub pH-metrów. Metody alkacymetryczne stosuje się powszechnie do oznaczania kwasów i zasad, zarówno organicznych jak i nieorganicznych. Metodę ta cechuje szybkość i prostota wykonania. Alkacymetria stanowi podstawę kontroli analitycznej produkcji kwasu siarkowego, azotowego, fosforowego, wodorotlenku sodu i innych produktów wielkoprzemysłowych. Wiele materiałów ze względu na późniejsze zastosowanie nie może zawierać kwaśnych składników. Oznaczanie ich metodami alkalimetrycznymi pozwala wydać opinię, czy dany produkt nadaje się do określonego zastosowania.
Alkacymetria dzieli się generalnie na:
alkalimetrię - oznaczanie w roztworze zawartości kwasów za pomocą miareczkowania mianowanym roztworem zasady,
acydymetrię - oznaczanie ilości zawartych w badanym roztworze zasad za pomocą miareczkowania mianowanym roztworem kwasu.
W praktyce alkacymetrii wyróżnia się trzy typy miareczkowania:
miareczkowanie mocnych kwasów i mocnych zasad
miareczkowanie słabych kwasów i słabych zasad
miareczkowanie kwasów i zasad o różnej mocy.
We wszystkich przypadkach titrantem (roztworem wkraplanym) jest roztwór mocnego kwasu lub mocnej zasady. Nie stosuje się miareczkowania roztworami słabych kwasów bądź słabych zasad. Należy też wspomnieć o tak zwanym współczynniku równoważności, który oblicza się dla kwasów i zasad biorących udział w miareczkowaniu, aby później można było wyznaczyć stężenie oznaczanego składnika. Współczynnik równoważności jest stosunkiem stałych dysocjacji składników podzielonych przez ich masę cząsteczkową.
Rodzaje reakcji alkacymetrycznych:
Reakcje mocnych kwasów z mocnymi zasadami :
Podczas miareczkowania roztworów mocnych kwasów roztworami mocnych zasad i odwrotnie, zmienia się w pewien ciągły sposób stężenie jonów hydroniowych (H3O+). Zmiany te można przedstawić graficznie za pomocą krzywej miareczkowania. Krzywe te wykreślane są w układzie współrzędnych: na osi odciętych odłożona jest objętość roztworu miareczkującego (do zobojętnienia), na osi rzędnych odłożona jest wartość pH roztworu w danym punkcie miareczkowania. Na krzywej można zaobserwować, że pH oznaczanego roztworu (mocnego kwasu lub mocnej zasady) zmienia się podczas miareczkowania nieznacznie i dopiero w pobliżu punktu równoważności następuje gwałtowny skok tej wartości. Duży skok pH w okolicy w punkcie równoważności, któremu odpowiada pH = 7, a więc odczyn obojętny, jest charakterystyczny dla tej właśnie reakcji.
Reakcje słabych kwasów z mocnymi zasadami :
Zmiany pH zachodzące podczas miareczkowania słabych kwasów mocnymi zasadami, na przykład kwasu octowego wodorotlenkiem sodu, są podobne do zmian zachodzących we wcześniej omawianym przypadku, z tą różnicą, że punkt równoważności w tych reakcjach znajduje się między pH=8-9. Jest to spowodowane tym, że w punkcie tym powstaje sól o odczynie zasadowym (w omawianym przypadku jest to octan sodu). Górny przebieg krzywej miareczkowania jest analogiczny jak w poprzednim przypadku. dodawanie nadmiaru zasady po osiągnięciu punktu równoważności wywołuje już tylko nieznaczne zmiany pH.
Reakcje mocnych kwasów ze słabymi zasadami :
Podczas miareczkowania słabej zasady mocnym kwasem krzywa miareczkowania przebiega odwrotnie niż w poprzednich przypadkach. Zaczyna się ona przy wyższym pH i kończy przy pH niewielkim. Skok krzywej obserwuje się w okolicach pH= 7-4, a punkt równoważności jest położony poniżej pH=7. W wyniku miareczkowania powstaje sól mocnego kwasu i słabej zasady, która ma odczyn kwaśny.
Reakcja słabego kwasu ze słabą zasadą nie znajduje praktycznego zastosowania, gdyż punkt końcowy jest niewyraźny i trudny do uchwycenia.
Potencjometria jest metodą wykorzystującą zależność między aktywnością oznaczanego jonu w roztworze, a potencjałem elektrycznym elektrody. Praktycznie wyznacza się stężenie oznaczanego składnika na podstawie SEM ogniwa utworzonego z elektrody wzorcowej i pomiarowej (dla roztworów rozcieńczonych).
gdzie:
E 0 - normalny potencjał elektrody (aMn+= 1)
R - stała gazowa (8,31441 J K-1 mol-1)
T - temperatura bezwzględna (K)
F - stała Faraday'a (96486,7± 0,54 C mol-1)
n - liczba elektronów biorąca udział w reakcji
aMn+ - aktywność jonów metalu
aM0 = 1
Mierząc stężenie jonów wodorowych wkraczamy w zakres PEHAMETRII.pH jest ujemnym log [H+] z wartości stężenia jonów wodorowych.
Pomiaru stężenia jonów dokonuje się praktycznie np. mierząc SEM ogniwa złożonego z dwóch elektrod wchodzących w skład tzw. elektrody kombinowanej (rys).
1 - elektroda wyprowadzająca chlorosrebrowa
2 - roztwór wewnętrzny elektrody chlorosrebrowej (0,1 mol/dm3 HCl)
3 - membrana szklana (niskooporowa;100-500 MW)
4 - elektroda porównawcza chlorosrebrowa
5 - roztwór wewnętrzny elektrody porównawczej (nasycony roztwór KCl nasycony AgCl)
6 - przewód wyprowadzający sygnał
7 - wlew roztworu wewnętrznego
Elektroda szklana, najbardziej popularna elektroda jonoselektywna, służąca do pomiaru pH roztworu. Membrana (w kształcie kulistej bańki) wykonana jest z odpowiedniego szkła przenikalnego tylko dla jonów hydroniowych.
Wewnątrz bańki szklanej znajduje się roztwór o określonej aktywności tych jonów, do którego wprowadzona jest elektroda kalomelowa lub chlorosrebrowa, spełniająca rolę kontaktu elektrycznego. Stosunek aktywności jonów wodorowych po obydwu stronach bańki szklanej (określony poprzez pomiar siły elektromotorycznej) pozwala wyznaczyć pH roztworu.
Elektroda szklana jest odporna na działanie metali ciężkich, utleniaczy i reduktorów, może być także stosowana w roztworach niewodnych.
2. Doświadczenie 1:
Mamy 3 probówki, z czego 2 zmiareczkujemy metodą alkacymetryczną jedno metodą potencjometryczną. Będziemy mieszać NaOH z 0,1mol r-r HCl. W pierwszym wypadku będziemy miareczkować do zniknięcia zabarwienia fenoloftaleiny. W drugim będziemy dodawać równe porcje kwasu i mierzyć jego pH oraz potencjał po kolejnym dodatku kwasu.
M. alkacymetryczna:
1) 2,49ml
2) 2,37ml
3) 2,42ml
![]()
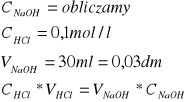
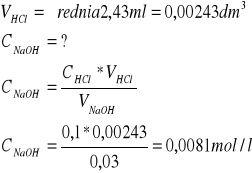
3. Doświadczenie 2:
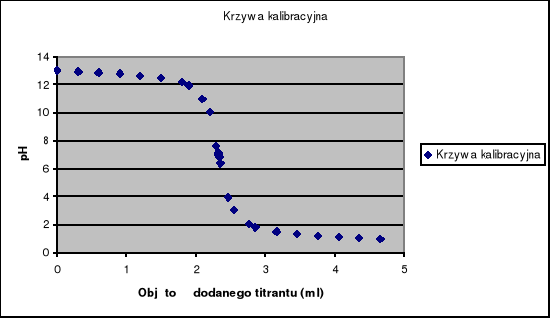
Badaną próbkę NaOH miareczkujemy dodając równe porcje kwasu. Po każdym dodaniu porcji kwasu mieszamy i dokonujemy pomiaru pH, wyniki przedstawiam w poniższej tabeli:
L.p. |
Objętość dodanego HCl [ml] |
całkowita objętość HCl [ml] |
pH |
1 |
0 |
0 |
13,01 |
2 |
0,3 |
0,3 |
12,94 |
3 |
0,3 |
0,6 |
12,88 |
4 |
0,3 |
0,9 |
12,76 |
5 |
0,3 |
1,2 |
12,65 |
6 |
0,3 |
1,5 |
12,47 |
7 |
0,3 |
1,8 |
12,16 |
8 |
0,1 |
1,9 |
11,96 |
9 |
0,2 |
2,1 |
10,99 |
10 |
0,1 |
2,2 |
10,06 |
11 |
0,1 |
2,3 |
7,59 |
12 |
0,02 |
2,32 |
7,19 |
13 |
0,01 |
2,33 |
7 |
L.p. |
Objętość dodanego HCl [ml] |
całkowita objętość HCl [ml] |
pH |
14 |
0,01 |
2,34 |
6,81 |
15 |
0,02 |
2,36 |
6,41 |
16 |
0,1 |
2,46 |
3,94 |
17 |
0,1 |
2,56 |
3,01 |
18 |
0,2 |
2,76 |
2,04 |
19 |
0,1 |
2,86 |
1,84 |
20 |
0,3 |
3,16 |
1,53 |
21 |
0,3 |
3,46 |
1,35 |
22 |
0,3 |
3,76 |
1,24 |
23 |
0,3 |
4,06 |
1,12 |
24 |
0,3 |
4,36 |
1,06 |
25 |
0,3 |
4,66 |
0,99 |
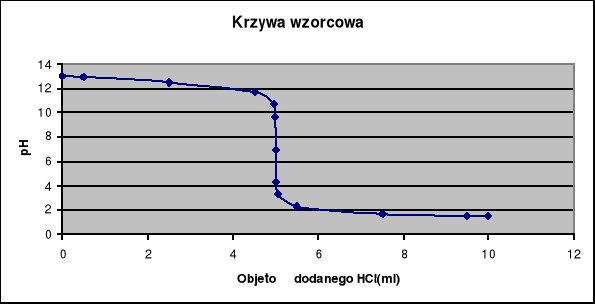
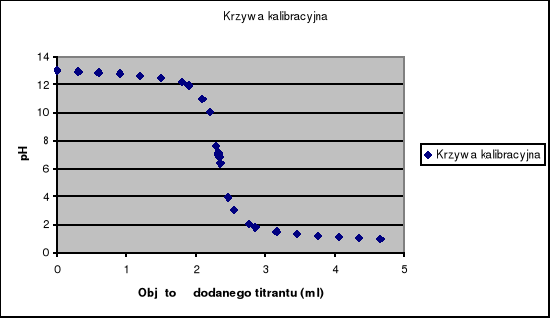
4. Krzywa wzorcowa:
W etapie 0, przed przystąpieniem do miareczkowania pH NaOH wynosiło 13. (Zakładamy, że stężenie NaOH wynosiło 0,1M, podobnie jak stężenie HCl).
pOH = -log[OH] = -logCNaOH = 1
pH = 14 - pOH = 13
Objętość zasady, której nadmiar nie został zmiareczkowany wynosi 100-10=90ml roztworu 0,1 M. objętość sumaryczna roztworu wynosi 100+10=110ml. Stężenie molowe obliczamy po jego rozcieńczeniu.
C1/C2 = V1/V2
Gdzie: C1 - stężenie molowe NaOH, V1 - objętość 0,1M roztworu NaOH z nadmiarem niezdysocjowanej zasady, C2 - stężenie roztworu po dodaniu porcji HCl, V2 - objętość końcowa (roztwór NaOH + HCl)
0,1M/C2 = 90/110
C2 = 0,08(18)M
pOH = -log[OH] = -logCNaOH = -log0,08(18)M = 1,087150185
pH = 14-1,087150185=12,91284982
Podobnie obliczamy stężenie zasady, do punktu równowagi. 50ml; 90ml; 99ml; 99,9ml - kolejno dodawane objętości HCl. a) 100ml zasady + 50ml HCl = 150ml, b) 100-50 = 50ml -nadmiar niezmiareczkowanej zasady, c) obliczamy stężenie zasady: 0,1M/C2 = 50/150ml,
C2 = 0,0(3)
pOH = 1,477121254
pH = 12,52287875
0,1M/C2 = 10ml/190ml
C2 = 0,0052631M
pOH =2,278758378
pH = 11,72124162
0,1M/C2 = 1ml/199ml
C2 = 0,0005025M
pOH = 3,298863934
pH = 10,70113607
0,1M/C2 = 0,1ml/199,9ml
C2 = 0,00005M
pOH = 4,301029996
pH = 9,69897004
W PR pH=7 ponieważ [H+]=[OH-], a zatem [H+]2=10-14
Po przekroczeniu PR pH = [H+], jony wodorowe pochodzą z nadmiaru kwasu
[H+][OH-]=10-14
[OH-]=10-14/[H+]
pH=[H+]
Do sporządzenia krzywe wzorcowej podstawiamy następujące objętości HCl: 100,1ml; 101ml; 110ml; 150ml; 190ml; 200ml. Aby obie krzywe miareczkowania były porównywalne objętość titranta [ml] należy zmniejszyć w przypadku krzywej wzorcowej z przedziału 0-200 do wartości 0-10 zastosowanych na wykresie krzywej z ćwiczeń. W tym celu wartość skali należy pomniejszyć 20 razy.
A)0,1M/C2 = 0,1 ml /200,1 C2 =0,000049 pH = 4,3
B) 0,1M/C2 = 1ml/201 C2= 0,00049 pH= 3,3
C) 0,1M/C2 = 10/210 C2= 0,00476 pH = 2,3
D) 0,1M/C2 = 50/250 C2= 0,02 pH= 1,6
E) 0,1M/C2 = 90/290 C2= 0,031 pH= 1,5
F) 0,1M/ C2 = 100/300 C2= 0,033 pH= 1,47
L.p. |
Objętość [ml] dodanego HCl [V1] |
Wartość objętości na skali 0-10 [V1/20] |
pH |
Etap miareczkowania |
1 |
0 |
0 |
13 |
0 |
2 |
10 |
0,5 |
12,91284982 |
I |
3 |
50 |
2,5 |
12,52287875 |
I |
4 |
90 |
4,5 |
11,72124162 |
I |
5 |
99,0 |
4,95 |
10,70113607 |
I |
6 |
99,9 |
4,995 |
9,69897004 |
I |
7 |
100 |
5 |
7 |
II |
8 |
100,1 |
5,005 |
4,30125 |
III |
9 |
101 |
5,05 |
3,3032 |
III |
10 |
110 |
5,5 |
2,3222 |
III |
11 |
150 |
7,5 |
1,69897 |
III |
12 |
190 |
9,5 |
1,5082 |
III |
13 |
200 |
10 |
1,4771 |
III |
Wnioski:
Metoda alkacymetryczna jest szybka i prosta do wykonania. Oznaczanie tą metodą pozwala wydać opinię czy dany produkt nadaje się do określonego zastosowania. Potencjometria wykorzystuje zależność między aktywnością oznaczonego jonu w roztworze, a potencjałem elektrycznym metody. Jest to metoda bardziej pracochłonna i wymagająca więcej czasu ale co z tym się wiąże jest bardziej precyzyjna i pokazująca więcej zależności. Dlatego uważam że jest ona lepsza.
Wyszukiwarka
Podobne podstrony:
Chromatografia Cieczowa, Ochrona Środowiska, Sprawozdania z Chemii Analitycznej Środowiska
Chromatografia cieczowa 2, Ochrona Środowiska, Sprawozdania z Chemii Analitycznej Środowiska
gazowka, Ochrona Środowiska, Sprawozdania z Chemii Analitycznej Środowiska
oznaczanie ortofosforanów w coca-coli, Ochrona Środowiska, Sprawozdania z Chemii Analitycznej Środow
Spektrofotometria UV-VIS, Ochrona Środowiska, Sprawozdania z Chemii Analitycznej Środowiska
pwsz ioś kalisz moje sprawozdanie PEHAMETRIA, inżynieria ochrony środowiska kalisz, a pwsz kalisz io
CHEMIA FIZYCZNA-Proces analityczny sc, Ochrona Środowiska pliki uczelniane, Chemia
Monitoring środowiskaĆW - Laboratorium AKS - Sprawozdanie, Nauka, Ochrona środowiska
Program, Ochrona Środowiska, Chemia analityczne środowiska
Sprawozdanie - Laboratorium 1 - MS, Ochrona Środowiska, Monitoring środowiska, Moje, Laboratorium, L
Sprawozdanie z ochrony środowiska lab koagulacja
Sprawozdanie z ochrony srodowiska t.gleba1, AGH Kier. GiG rok I Sem. I, ochrona srodowiska, Sprawoz
redoksymetria zadania, studia, ochrona środowiska UJ, chemia analityczna, wyrównawcze
sprawozdanie-chromatografia, ochrona środowiska UJ, IV semestr, chemia ograniczna, sprawozdania
sprawozdanie hałas Ochrona Srodowiska, ochrona rodowiska
krystalizacja sprawozdanie, ochrona środowiska UJ, IV semestr, chemia ograniczna, sprawozdania
Sprawozdanie 8 (tabela), studia, ochrona środowiska UJ, chemia ogólna i nieorganiczna, sprawozdania
Sprawozdanie z ochrony srodowiska t gleba
Roztwory II, studia, ochrona środowiska UJ, chemia analityczna, wyrównawcze
więcej podobnych podstron