Ćwiczenie wykonali: grupa 22, zespół 6 |
Nr ćwiczenia : |
Data : |
Maciej Listek , Wojciech Bieleń , Piotr Tarnowski , Magdalena Smoleń |
5
|
29. 05 .2001 |
Temat: Wyznaczanie stałej równowagi reakcji tworzenia kompleksów jodu z aromatami |
||
Cząsteczka jodu tworzy połączenia z donorami elektronów. Elektrony z pierścienia np.benze- nowego ulegają przesunięciu w kierunku bliższego atomu jodu. Stałe równowagi reakcji tworzenia tych kompleksów są niewielkie.
Ar + I2 = ArI2
![]()
W widmie w nadfiolecie pojawiają się bardzo silne pasma pochłaniania przy około 300 nm. W obszarze tym nie absorbuje ani czysty jod , ani aromat. Umożliwi to zastosowanie spektro- fotometru do badania stężenia powstających kompleksów. Dla niewielkich stężeń absorbancja jest wielkością addytywną. Dla roztworu jodu i aromatu, mierzona wielkość jest równa sumie
absorbancji jodu, aromatu i kompleksu. Zgodnie z prawem Lamberta-Beera, absorbancja dla
każdego z tych składników jest równa iloczynowi absorbancji molowej a, szerokości kuwety b oraz stężenia składnika:
A =aArb[Ar] + aIb[I2] + aArb[ArI2]
Stężenie wolnego jodu [I2] jest równe stężeniu początkowemu [I2]0 minus stężenie kompleksu
[ArI2], podobnie stężenie wolnego aromatu [Ar] = [Ar]0 - [ArI2]. Po przekształceniach otrzymujemy następujące równanie:
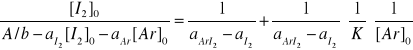
które ma postać linii prostej y= b + a*x , gdzie x to odwrotność stężenia aromatu, a a i b to stałe. Kreśląc wykres tej funkcji i wyliczając współczynniki regresji liniowej można wyliczyć stałą K (ze współczynnika b wylicza się aArI2 i wstawiając do współczynnika a wylicza się K )
Widmo - rozkład natężenia promieniowania w zależności od jego energii, częstotliwości
lub długości fali
Widmo dostarcza wielu informacji o źródle danego promieniowania (tzw. Widmo emisyjne)
a często i o ośrodku , przez który ono przechodziło (tzw. widmo absorpcyjne)
Gdy fale elektromagnetyczne rozchodzą się w jakimś ośrodku, wtedy na ogół prędkość rozchodzenia
będzie różna dla fal o różnych długościach(dyspersja fal). Różnice miedzy falami elektromagnetycznymi o różnych częstotliwościach uwydatniają się szczególnie wyraźnie w wytwarzaniu i wykrywaniu promieniowania elektromagnetycznego. Stąd właśnie pochodzi
idea podziału całego widma elektromagnetycznego na szereg zakresów.
Kryterium podziału stanowią właściwości promieniowania, a także sposoby jego wytwarzania
i detekcji
Fale radiowe |
mikrofale |
podczerwień |
Fale widzialne |
Nadfiolet |
Promienie Roentgena |
Promienie gamma |
109 1012 5* 1014 1015 1017 1021
Częstotliwość w Hz
10-1 10-3 10-6 10-7 10-8 10-12
Długość fali w m
Klasyfikacja widm. Wszystkie ciała pobudzone do świecenia wysyłają promieniowanie elektromagnetyczne w zakresie widzialnym lub w podczerwieni i nadfiolecie. Widma takie
nazywamy emisyjnymi.
Prócz widm emisyjnych istnieją również widma absorpcyjne. Obserwujemy gdy na drodze światła
znajdzie się ciało np. gaz lub ciecz, które pochłania promieniowanie o długościach * . Wówczas
z widma źródła światła zostają wycięte charakterystyczne linie(lub cale pasma) absorpcyjne.
Przykładem linii absorpcyjnych mogą być linie Fraunhofera występujące na tle ciągłego widma Słońca.
Związek pomiędzy widmem emisyjnym , a absorpcyjnym jest uwarunkowany samą budową atomów
lub cząsteczek danej substancji. Atom może przechodzić do wyższych stanów energetycznych
pochłaniając foton o energii dopasowanej do dozwolonych przejść energetycznych w tym atomie.
Następnie przechodząc na poziom niższy lub inaczej do stanu energetycznie niższego wysyła foton
(lub kilka fotonów , jeśli stan podstawowy osiąga przez kolejne przechodzenie przez kilka coraz
niższych poziomów)
Dlatego widmo absorpcyjne jest jakby odwróceniem widma emisyjnego
Absorpcja promieniowania , a struktura cząsteczki — absorpcja promieniowania elektromagnetycznego przez cząsteczkę może wywołać w niej różne zmiany energetyczne związane
ze wzbudzeniem poziomów energii rotacyjnej, oscylacyjnej lub elektronowej. Energie te są kwantowane ( mogą przybierać tylko ściśle określone wartości. Przejście miedzy poziomami
rotacyjnymi wywołane są przez promieniowanie mikrofalowe, między poziomami oscylacyjnymi
przez promieniowanie podczerwone, natomiast przejścia miedzy poziomami zewnętrznych powłok
elektronowych są wywołane przez promieniowanie widzialne i nadfioletowe.
Wartości energii: rotacyjnej, oscylacyjnej i elektronowej maja się do siebie w przybliżeniu jak
Erot : Eosc : Eel = 1 : 10 : 1000
Absorpcja promieniowania elektromagnetycznego w zakresie nadfioletu i światła widzialnego zależy
przede wszystkim od liczby i rozmieszczenia elektronów w absorbujących cząsteczkach.
W związkach nieorganicznych absorpcja następuje wówczas, gdy nie zapełniony poziom energetyczny
elektronów d lub f jest osłonięty lub chroniony przez całkowicie zapełniony poziom energetyczny
wytworzony zwykle przez wiązanie kowalencyjne lub koordynacyjne z innymi atomami.
Nasycone związki organiczne nie wykazują selektywnej absorpcji w zakresie widzialnym
i nadfiolecie.
W związkach organicznych absorpcja związana jest z przejściem elektronów walencyjnych wiązań
pojedynczych (elektrony * w prostych wiązaniach węglowodorów alifatycznych) i wielokrotnych
(elektrony * w nienasyconych węglowodorach i zw. aromatycznych) oraz elektronów wolnych par
elektronowych (elektronów n) , które nie biorą udziału w wiązaniach , a występują w tlenie , azocie czy siarce.
Obliczenia:
Lp. |
obj.jodu [ml] |
obj.arom[ml] |
[I2]0[mol/m3] |
[Ar]0[mol/m3 |
A 320[nm] |
A 525[nm]
|
1/[Ar]0 |
y |
1. |
3 |
0,27 |
3,67*10-7 |
0,16*10-3 |
0.14700 |
0.19347 |
6250 |
2,51*10 |
2. |
3 |
0,90 |
3,08*10-7 |
0,46*10-3 |
0.29147 |
0.16750 |
2173,9 |
1,05·10-6 |
3. |
2 |
1,30 |
2,43*10-7 |
0,78*10-3 |
0.36071 |
0.13083 |
1282,1 |
6,73·10-7 |
4. |
1,25 |
1,87 |
1,60*10-7 |
1,19*10-3 |
0.32626 |
0,083115 |
840,3 |
4,96·10-7 |
5. |
1 |
2,10 |
1,29*10-7 |
1,35*10-3 |
0.28744 |
0,077213 |
740,7 |
4,49·10-7 |
6. |
0,75 |
2,25 |
1,00*10-7 |
1,50*10-3 |
0.24193 |
0,054845 |
666,6 |
4,14·10-7 |
7. |
0,5 |
1,90 |
8,33*10-8 |
1,58*10-3 |
0.20993 |
0,046400 |
632,9 |
3,97·10-7 |
8. |
0,4 |
3,00 |
4,71*10-8 |
1,76*10-3 |
0.12880 |
0,028924 |
568,2 |
3,66·10-7 |
9. |
0,33 |
2,80 |
4,22*10-8 |
1,79*10-3 |
0.12738 |
0,015333 |
558,7 |
3,32·10-7 |
10. |
0,33 |
3,16 |
3,78*10-8 |
1,81*10-3 |
0.11809 |
0,022040 |
552,5 |
3,21·10-7 |
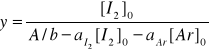
AI=0,011675 AAr= 0,027801
z prawa Lamberta-Beera:
AI= aIb[I2] aI=AI/b[I2] aI=29,1292= aArb[Ar] aAr=AAr/b[Ar] aAr=0,01387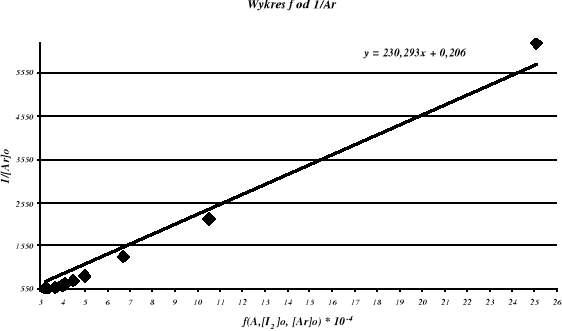
Ar
A
Obliczamy stałą równowagi K, korzystając z wartości współczynników a i b obliczonych dla prostej y = ax + b, (y = 230,293x + 0,206)
K=![]()
K=![]()
Wnioski:
Niedokładność naszego pomiaru mogła wyniknąć z zanieczyszczenia roztworów aromatu
i jodu, a także, co jest bardziej prawdopodobne, z niedokładnego wysuszenia kuwetki po przemyciu acetonem lub zanieczyszczenia jej powierzchni palcami przy wyjmowaniu kuwetki
ze spektrofotometru. Mogliśmy też niedokładnie sporządzić roztwory wyjściowe.
5
Wyszukiwarka
Podobne podstrony:
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
więcej podobnych podstron