Politechnika Szczecińska
Wydział Technologii i Inżynierii Chemicznej

REAKTORY CHEMICZNE
PÓŁPRZEPŁYWOWY REAKTOR ABSORPCYJNY
WYKONANIE:
TOMASZ KLAMA
EMILIA KOSMALSKA
URSZULA KOZIEŁ
KATARZYNA KOC
PAULINA KLYM
Cel ćwiczenia
Celem ćwiczenia jest określenie stopnia absorpcji oraz szybkości procesu utleniania SO2 w roztworze w zależności od temperatury, zawartości katalizatora w zawiesinie, stężenia katalizatora w roztworze przy różnych składach mieszaniny gazowej zasilającej reaktor półprzepływowy.
2. Opis ćwiczenia
W reaktorze półprzepływowym (półokresowym) reakcja biegnie w warunkach nieustalonych. Najczęściej stosowany wariant pracy reaktora zakłada, że jeden z substratów umieszcza się w całości w przestrzeni reakcyjnej, a drugi z nich doprowadza się ciągłym strumieniem Stężenie doprowadzanego substratu jest stałe, a stężenie w reaktorze i na wylocie (w przypadku reaktora absorpcyjnego) zmieniają się w czasie. Spowodowane jest to przebiegiem reakcji, zmianą objętości roztworu reakcyjnego i niekiedy odparowywaniem jednego ze składników roztworu.
Reaktor absorpcyjny jest szczególnym typem reaktora półprzepływowego. Zasadę funkcjonowania układu absorpcyjnego przedstawiono na poniższym rysunku.
W układzie tym stosuje się cyrkulację roztworu, ponieważ jednorazowe jego przejście przez absorber odbywa się w czasie zbyt krótkim dla uzyskania zadawalającej wydajności procesu. Krotność cyrkulacji zależy od szybkości procesu i wymiarów aparatury. Gaz przepływa w przeciwprądzie do cieczy, poprzez przegrodę perforowaną, powodująca dyspersje strumienia na drobne pęcherzyki.
Przedstawiony wyżej sposób prowadzenia procesu stosowany jest w instalacjach badawczych i na większą skalę - instalacjach doświadczalnych.
W praktyce przemysłowej stosowany jest również nieco inny wariant układu absorpcyjnego, w którym do reaktora doprowadza się stopniowo świeży roztwór absorpcyjny, a ze zbiornika odprowadza roztwór do dalszej przeróbki. Dodatkowy dopływ j odpływ roztworu zaznaczono na rysunku linią przerywaną
W niniejszym ćwiczeniu należy dokonać oceny przebiegu procesu, który prowadzony jest w reaktorze pół przepływowym, pracującym w układzie absorpcyjnym wg I wariantu. Podstawą tego procesu jest reakcja.
SO2+1/2O2 →H2SO4
której przebieg katalizują, jony metali zmienno wartościowych z bloku 3d. Katalizator może być wprowadzony do roztworu absorpcyjnego w formie soli odpowiednich metali (np. soli Fe) lub do zawiesiny w formie tlenków, np. FeO*TiO2. Powyższa reakcja umożliwia oczyszczanie gazów odlotowych, odpadowy SO2 przeprowadzany jest w użyteczny produkt - kwas siarkowy. Bardzo charakterystyczną jej cechą jest spadek szybkości postępujący ze wzrostem stężenia tworzącego się H2SO4.
W omawianym procesie przemiana chemiczna (utlenianie SO2) jest jednym z etapów Najpierw musi nastąpić absorpcja gazowych reagentów (SO2 i O2), której towarzyszą procesy unikania masy i przenikaniu masy z fazy gazowej do ciekłej. W literaturze bilans masy i energii oraz równania projektowe reaktora półprzepływowego formułowane są głównie dla reakcji biegnących w układzie homogenicznym. Stąd też opisy formalne nie mogą być ekstrapolowane do warunków pracy reaktora absorpcyjnego, w którym przebiega skomplikowany omówiony wyżej proces.
Dla oceny przebiegu procesu zaproponowano następujący sposób postępowania. Przyjmując jako składnik kluczowy w układzie reakcyjnym dwutlenek siarki (A) i oznaczając ilości moli na wlocie jako n0A = n0SO2 a na wylocie nA =nSO2, z różnicy n0A - nA możemy obliczyć ilość moli przereagowanego SO2.
Natomiast wyrażenie (1) .
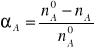
pozwoli na określenie względnej ilości moli przereagowanego substratu w stosunku do ilości wlotowej. Wielkość αA nazywa się stopniem przemiany. Gdy przedstawimy ją jako ułamek jedności zawiera się ona w przedziale O ≤ αA ≤ l, a jeśli określamy ją procentowo to 0% ≤ αA ≤ 100%.
Powyższy wzór jest wzorem definicyjnym, określającym sens fizyczny stopnia przemiany. W praktyce dogodniej jest stosować stężenia składnika kluczowego na wlocie i wylocie z reaktora. Gdy możemy przyjąć, że objętość fazy gazowej jest siała w czasie przebiegu procesu stopień przemiany możemy obliczyć po określeniu stężeń objętościowych (%) na wlocie i wylocie:
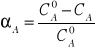
Komentarza wymaga fakt, że przedstawiona wcześniej reakcja przebiega ze zmianą objętości. Należy jednak zauważyć, że zawartości SO2 w gazach odlotowych są na ogół rzędu ułamków procenta i przereagowanie tak niewielkich względnie ilości substancji wywołuje nieznaczną zmianę objętości fazy gazowej.
Z przedstawionych wcześniej właściwości reaktora półprzepływowego oraz zachodzącej w nim reakcji wynika, że stężenie wlotowe C0A= const, a stężenie Cp produktu (kwasu siarkowego) rośnie. Wzrost stężenia H2SO4 powoduje obniżanie szybkości reakcji i stopniowe zwiększanie stężenia CA na wylocie.
Chcąc oceniać przebieg procesu względem składnika kluczowego, którym jest SO2 należy zauważyć, że wzór na αA umożliwia obliczanie kolejnych, chwilowych wartości stopnia przemiany SO2. Ponieważ stężenie wlotowe jest zmienne w czasie (τ) -CA= f (τ), to również αA= f1 (τ).
Komplikacje te powodują, że konieczne jest wprowadzenie do obliczeń średniego stopnia przemiany (stopnia absorpcji), który można obliczyć ze wzoru (3 ):
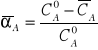
gdzie ![]()
A oznacza średnie stężenie wylotowe w czasie τ. Wielkość tę należy traktować jako średnią wartość funkcji CA = f (τ) w przedziale 0 ÷ τ
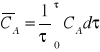
Charakter funkcji CA = f(τ) zmienia się w różnych przedziałach czasowych oraz w zależności od analizowanego parametru i poziomu jego wartości. Zależności tej nie możemy wyrazić za pomocą funkcji elementarnych, znamy jedynie zbiór jej wartości w izolowanych punktach. Jest to częsty przypadek w analizie matematycznej, który wymaga zastosowania całkowania przybliżonego np. metoda graficzna.
W każdej serii doświadczeń uzyskuje się pęk krzywych dla różnych wartości zmienianego parametru np. temperatury lub stężenia katalizatora w roztworze. Całkowanie graficzne wymaga planimetrowania odpowiednich pól pod wykresami funkcji. Stąd poszukiwane średnie stężenie wylotowe wyniesie:
![]()
Wprawdzie stężenie wlotowe jest stałe, lecz ze względu na możliwość wprowadzenia uproszczeń w dalszym postępowaniu możemy je przedstawić podobną zależnością:
![]()
Współczynnik k ![]()
jest współczynnikiem przeliczeniowym jednostek powierzchni na jednostki fizyczne w układzie stężenie-czas. Można łatwo zauważyć, że po podstawieniu (5) i (6) do zależności (3) upraszcza się czynnik ![]()
oraz k i uzyskujemy wzór obliczeniowy (7)

Planimetrowanie pól jest bardzo żmudne i opatrzone błędem. Można wprowadzić kolejne uproszczenie polegające na zastąpieniu pól ich masami.
![]()
![]()
gdzie k' ![]()
jest współczynnikiem umożliwiającym przejście z masy pól na pola powierzchni lub odwrotnie.
Uwzględniając zależności (8) otrzymamy kolejny wzór:
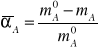
Umożliwia on obliczanie stopnia absorpcji SO2 gdy wyznaczone zostaną masy pola ,,wlotowego" i „wylotowego", które zaznaczono na rysunku. Należy kategorycznie podkreślić, że wzory (7) i (9) nie mają sensu fizycznego i są wyłącznie wzorami obliczeniowymi, tożsamościowo równymi ze wzorami, w których występują jednostki stężenia.
Wartości stopnia absorpcji, wyznaczone dla różnych wartości analizowanego parametru, umożliwiają określenie odpowiadających im wartości szybkości procesu (rA). Zależność na szybkość procesu można wyprowadzić na podstawie obliczeń bilansowych. Oznaczając przez V 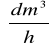
objętościowe należenie oraz przeliczając![]()
na ułamek objętościowy![]()
można obliczyć objętość SO2 doprowadzanego do reaktora
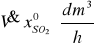
a mnożąc przez stopień absorpcji obliczyć objętość przereagowanego SO2:
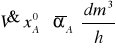
Po podzieleniu przez objętość molową SO2 VM = 21,86 [dm3/mol] uzyskamy ilość moli przereagowanego SO2:
![]()
Z kolei po podzieleniu przez objętość roztworu reakcyjnego Vr = 0,1 [dm3] uzyskamy ostatecznie szybkość procesu odniesiona do jednostki czasu i jednostki objętości reaktora:
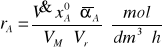
3. Wykonanie ćwiczenia
Po otrzymaniu zapisów z rejestratora, na których przedstawione są przebiegi CA= f(τ) dla różnych wartości parametru, którego wpływ na przebieg procesu jest badany, należy jednorazowo wyznaczyć masę pola „wlotowego". Następnie kolejno dla poszczególnych krzywych wyznaczyć masy pól „wylotowych". Uzyskane dane użyć do obliczeń wartości stopnia absorpcji oraz szybkości procesu według przedstawionej powyżej metodyki.
4. Opracowanie wyników
Wyniki należy najpierw przedstawić w postaci stabelaryzowanej. Kolumny tabeli powinny zawierać takie pozycje jak kolejny numer doświadczenia, wartości badanego parametru, wartości stopnia absorpcji SO2 oraz szybkości procesu. Uzyskane dane przedstawić w formie graficznej ![]()
lub rA jako funkcja wartości parametru
Wyniki powinny być zinterpretowane odpowiednimi wnioskami, w których należy uwzględnić złożoność procesu, a zwłaszcza zmiany rozpuszczalności gazowych reagentów w roztworach elektrolitów przy różnych stężeniach i temperaturach..
Wyszukiwarka
Podobne podstrony:
reaktory 2(2), Studia, Politechnika
reaktory, Studia, Politechnika
Prawo inżynierskie i ochrona własności intelektualnych. Wykład 3, Studia, Politechnika Łódzka - Pend
Testy biodegradacji, Studia, Politechnika
Chf9, Studia, Politechnika
Wyznaczanie stałej reakcji szybkości zmydlania estru, Studia, Politechnika
CH.F.L9, Studia, Politechnika
ZAKAAD CHEMI FIZYCZNEJ, Studia, Politechnika
C15, Studia, Politechnika
podstawowe informacje o ochronie prawnej wzorów przemysłowych, Studia - Politechnika Śląska, Zarządz
Sprawko spawalnictwo 1, studia, studia Politechnika Poznańska - BMiZ - Mechatronika, 2 semestr, obro
dziadek25, Studia, Politechnika
4 2 vademecum echosondy (w tym przykładzie wodnej), studia, studia Politechnika Poznańska - BMiZ - M
LABORKA7, Studia, Politechnika
Wyznaczanie stopnia asocjacji kwasu octowego w rozpuszczalni, Studia, Politechnika
deacon1, Studia, Politechnika
Destylacja wojtek, Studia Politechnika Poznańska, Semestr I, Chemia, Chemia laboratoria, Destylacja
więcej podobnych podstron