REDOKSYMETRIA
Reakcja utleniania-redukcji polega na wymianie elektronów pomiędzy sprzężonymi reakcjami utleniania i redukcji (reakcji utleniania musi towarzyszyć reakcja redukcji).
Redukcja - reakcja polegająca na przyłączeniu elektronów. Związana jest ze zwiększeniem się ładunku ujemnego redukowanego atomu, a tym samym obniżeniem jego stopnia utlenienia.
Utlenienie - reakcja polegająca na oddaniu elektronów. Związana jest ze zwiększeniem się ładunku dodatniego utlenianego atomu i zmniejszeniem jego ładunku ujemnego, a tym samym zwiększeniem jego stopnia utlenienia.
Jedna z tych reakcji może zajść pod warunkiem, że w tym samym czasie zachodzi druga (np. reakcja redukcji nie zajdzie bez sprzężonej z nią reakcji utleniania)
PRZYKŁAD:
od góry:
- utlenienie (reakcja połówkowa sprzężona z reakcją redukcji)
- redukcja (reakcja połówkowa sprzężona z reakcją utleniania)
- równanie redoks
OGÓLNIE:
gdzie:
Oks - utleniacz
Red - reduktor
n - liczba elektronów
UTLENIACZ - atom, jon lub cząsteczka, która ma właściwość przyłączania elektronów - elektronobiorca; ulega redukcji
niemetale VI i VII grupy układu okresowego, np. Cl2 (redukuje się do Cl-), Br2 (redukuje się do Br-), O2 (redukuje się do O2-)
jony metali na wyższym stopniu utlenienia, np. Fe3+ (redukuje się do Fe2+)
jony metali szlachetnych, np. Cu2+ (redukcja do Cu) lub Ag+ (redukcja do Ag)
jon wodorowy: H+ (redukcja do H2)
często stosowane: KMnO4, K2Cr2O7, HNO3, H2O2
REDUKTOR - atom, jon lub cząsteczka, która ma właściwość odłączania swoich elektronów - elektronodawca; ulega utlenieniu
niemetale IV, V i VI grupy układu okresowego, np. N (ulenienienie do N+5), S (utlenienie do S+6), C (utlenienie do C+4)
metale lekkie, np. Zn (utlenienie do Zn2+), Na (utlenienie do Na+), Al (utlenienie do Al3+)
jony metali i niemetali na niższym stopniu utlenienia, np. Fe2+ (utlenienie do Fe3+), Sn2+ (utlenienie do Sn4+), S2- (utlenienie do S0)
AMFOTER RED-OKS: substancja, która wobec odpowiednio silnego utleniacza (elektronobiorcy) występuje w charakterze reduktora, a wobec odpowiednio silnego reduktora (elektronodawcy) zachowuje się jak utleniacz. Należą tu jony lub cząsteczki zawierające atom pierwiastka na pośrednim stopniu utlenienia, np. H2O2
Zachowanie wody utlenionej w stosunku do utleniacza (KMnO4) -
Tlen na -1 stopniu utlenienia w nadtlenku wodoru oddaje elektron i utlenia się do wolnego tlenu
Mangan na +7 stopniu utlenieniu w KMnO4 redukuje się do Mn2+ przyjmując 5 elektronów
Woda utleniona jest reduktorem.
Zachowanie wody utlenionej w stosunku do reduktora (Fe2+):
Tlen na -1 stopniu utlenienia przyjmuje 1 elektron i redukuje się do tlenu na 2 stopniu utlenienia w H2O
Żelazo na +2 stopniu utlenienia oddaje 1 elektron i utlenia się do żelaza na 3 stopniu utlenienia
POTENCJAŁ RED-OKS
Potencjał red-oks - różnica potencjałów między platyną z elektrody platynowej, a roztworem w którym jest ona zanurzona i w którym znajduje się utleniacz i częściowo jego zredukowana postać (np. Fe3+ i Fe2+ lub MnO4- i Mn2+). Zależy od:
charakteru utleniacza i reduktora
stężeń utleniacza i reduktora w roztworze
Jeżeli przyjmiemy, że reakcja redoks jest odwracalna, potencjał red-oks możemy wyrazić za pomocą wzoru Nernsta:
[oks] [red] - aktywne stężenie utlenionej i zredukowanej postaci związku
E - potencjał redoks układu
Eo - normalny potencjał redoks - potencjał red-oks układu w przypadku gdy stężenia postaci utlenionej i zredukowanej związku są sobie równe ([oks] = [red]) - wielkość stała charakteryzująca dany układ, wyznacza się go doświadczalnie w odniesieniu do elektrody wodorowej, której potencjał przyjęto umownie jako równy zeru.
n - liczba elektronów biorąca udział w reakcji
Im większa różnica w potencjałach red-oks dwóch różnych układów tym energiczniej będą one ze sobą reagować.
Utleniacz - układ o wyższym potencjale red-oks
Reduktor - układ o niższym potencjale red-oks
Wzrost stężenia produktu obniża potencjał układu (np. jony Mn2+, które powstają w wyniku redukcji KMnO4 zmniejszają zdolności utleniające nadmanganianu)
STAŁA RÓWNOWAGI REAKCJI REDOKS
Każda reakcja redoks jest reakcją odwracalną, w związku z tym jej stałą K możemy wyrazić wzorem ogólnym:
WPŁYW pH NA WYSOKOŚĆ POTENCJAŁU RED-OKS:
pH wpływa na wysokość potencjałów tych utleniaczy, które zawierają w swym składzie tlen, np. KMnO4 lub K2Cr2O7, np.:
Im większe stężenie jonów H+ (mniejsze pH środowiska), tym wyższa wartość potencjału red-oks. Wraz ze wzrostem wartości potencjału wzrastają również zdolności utleniające danego utleniacza (w tym przypadku MnO4-) - utleniacz będzie utleniał wszystkie układy, które mają niższy potencjał red-oks (wyższy potencjał = można utlenić więcej układów).
Przykłady:
1) KMnO4: przy pH = 6 utlenia tylko jodki
przy pH = 3 utlenia jodki i bromki
przy pH < 3 utlenia jodki, bromki i chlorki
układ AsO43-/AsO33- i układ I2/2I- mają tą samą wartość potencjału (+0,58 V)
w pH zasadowym: utlenianie AsO33- do AsO43-
w pH kwasowym: redukcja AsO43- do AsO33-
3) Arsenian nie utlenia bromków w normalnych warunkach, ponieważ ich potencjał jest wyższy niż potencjał arsenianu (to bromki są utleniaczami). Jednak po zakwaszeniu środowiska potencjał arsenianu wzrośnie na tyle, by mógł utlenić bromki
POTENCJAŁ FORMALNY/RZECZYWISTY - potencjał danego układu red-oks po uwzględnieniu obecności innych substancji i pH roztworu. Zależy od:
wartości współczynników aktywności
siły jonowej roztworu
obecności substancji, które tworzą trudno rozpuszczalne osady ze składnikami roztworu
obecności odczynników kompleksujących składniki układu
stężenia jonów wodorowych (w b. dużym stopniu)
Znaczenie potencjału formalnego:
pozwala obliczyć potencjał w roztworze o określonym składzie
ZMIANY POTENCJAŁU REDOKS PODCZAS MIARECZKOWANIA
1. Różnica między potencjałami obu układów maleje, ponieważ:
zwiększa się stężenie formy zredukowanej utleniacza zmniejsza się potencjał redoks utleniacza
zwiększa się stężenie formy utlenionej reduktora zwiększa się potencjał redoks reduktora
Następuje moment zrównania się potencjałów obu układów stan równowagi dynamicznej pomiędzy składnikami układów, dalszy przebieg reakcji możliwy dopiero po wprowadzeniu kolejnej porcji utleniacza lub reduktora.
Miareczkowanie REDUKTORA utleniaczem:
potencjał utleniający roztworu wzrasta - początkowo powoli, w miarę zbliżąnia się do punktu równoważnikowego coraz szybciej
skok potencjału w pobliżu punktu równoważnikowego
Wartości potencjału redoks:
przed osiągnięciem punktu równoważnikowego - potencjał zależy od układu miareczkowanego (tego co jest w kolbce) i obliczamy go ze wzoru Nernsta:
po przekroczeniu punktu równoważnikowego - potencjał zależy od układu titranta (tego co jest w biurecie) i obliczamy go jak wyżej (ale podstawiając inne dane oczywiście):
c) w punkcie równoważnikowym: E1 = E2
stosunek stężeń postaci utlenionej do zredukowanej reduktora musi być równy stosunkowi stężeń postaci zredukowanej do utlenionej utleniacza
Wzór na potencjał redoks w punkcie równoważnikowym:
Krzywa miareczkowania symetryczna względem PR jeżeli n1 = n2 (w równaniach połówkowych występują takie same liczby elektronów)
Krzywa miareczkowania niesymetryczna względem PR jeżeli n1 ≠ n2
Rozcieńczanie roztworu podczas miareczkowania NIE MA wpływu na kształt krzywej miareczkowania, ponieważ we wzorze na potencjał redoks występuje stosunek stężeń, a ten nie ulega zmianie podczas rozcieńczania.
SZYBKOŚĆ REAKCJI REDOKS:
Reakcje utleniania-redukcji przebiegają stosunkowo powoli. Jest to spowodowane odmiennym mechanizmem zachodzenia reakcji w porównaniu z metodami redoksymetrycznymi, w których zobojętnienie ładunków zachodziło natychmiastowo.
zachodzi wymiana elektronów (często pomiędzy jonami jednoimiennymi, które się odpychają)
reakcje te przebiegają etapami - reduktor stopniowo oddaje elektrony, a utleniacz przyłącza je w kilku fazach (Mn7+ Mn4+ Mn3+ Mn2+)
Szybkość reakcji redoks zależy od:
szybkości najwolniej przebiegającej reakcji pośredniej
stężenia jonów wodorowych (jeżeli biorą one udział w reakcji) im większe to stężenie tym większa szybkość reakcji (zgodnie z prawem działania mas)
obecność czasem niewielkich ilości niektórych substancji działających jak ujemne lub dodatnie katalizatory, np. utlenianie kwasu szczawiowego KMnO4 zostaje przyspieszone obecności Mn2+
WSKAŹNIKI REDOKSYMETRYCZNE
Wskaźniki specyficzne - dostosowane do rodzaju używanego utleniacza lub reduktora, np. skrobia (w obecności wolnego jodu zabarwia się na niebiesko-fioletowo)
Titrant - wskaźnikiem może być również titrant (jeżeli ma odpowiednie zabarwienie), np. w manganianometrii wskaźnikiem jest sam KMnO4 (punkt końcowy = barwa titrantu nie zanika po dodaniu jego kropli do roztworu).
Wskaźniki nieodwracalne - stosowane w bromianometrii - w obecności wolnego bromu ich struktura ulega trwałemu uszkodzeniu i następuje odbarwienie, np. oranż metylowy, czerwień metylowa.
Wskaźniki red-oks - wskaźniki zmieniające swą barwę w zależności od potencjału utleniającego roztworu. Mają charakter utleniaczy i reduktorów - 2 postaci: utleniona i zredukowana mają różne barwy, np. ferroina (kompleksowy związek o-fenantroliny z jonem żelaza(II): Fe(C12H8N2)32+)
Barwa czerwona wobec potencjału 1,11V zmiana barwy na bladoniebieską (tworzy się taki sam związek, tyle że w środku kompleksu jest Fe3+ zamiast Fe2+).
NADMANGANIOMETRIA
Nadmanganiometria = oznaczanie reduktorów za pomocą mianowanego roztworu KMnO4.
Właściwości KMnO4:
bardzo wysoki potencjał utleniający (jeden z najczęściej stosowanych w praktyce utleniaczy)
silne zabarwienie roztworów brak konieczności używania wskaźników
przebieg redukcji zależy od środowiska:
w środowisku kwasowym redukcja do Mn2+
2 KMnO4 + 5 Na2SO3 + 3 H2SO4 2 MnSO4 + 5 NaSO4 + K2SO4 + 3 H2O
w środowisku obojętnym redukcja do Mn4+
2 KMnO4 + 3 Na2SO3 + H2O 2 MnO2 + 3 Na2SO4 + 2 KOH
w środowisku zasadowym redukcja do Mn6+
2 KMnO4 + Na2SO3 + 2 KOH 2 K2MnO4 + Na2SO4 + H2O
d) nie uzyskujemy mianowanego roztworu KMnO4 przez rozpuszczenie ściśle odważonej ilości w wodzie, ponieważ:
trudno uzyskać czysty KMnO4 (głównie domieszki MnO2)
w wodzie destylowanej znajdują się zanieczyszczenia organiczne (kurz, bakterie), które mogą zredukować KMnO4 do MnO2 i zmienić jego miano
w celu ustalenia miana:
rozpuścić nieco więcej KMnO4 niż jest teoretycznie potrzebne
przed oznaczaniem miana przesączyć roztwór przez tygiel Goocha
szkodliwość MnO2 polega na:
występowaniu w postaci zawiesiny nierównomiernie rozmieszczonej w roztworze, przez co wpływa na miano roztworu (zwiększa je, ponieważ reaguje z również reaguje z reduktorem)
katalitycznym przyspieszeniu samorzutnego rozpadu nadmanganianu na MnO2 i tlen: 4 MnO4- + 2 H2O 4 MnO2 + 4 OH- + 3 O2
przyczyna samorzutnego rozkładu: potencjał redoks nadmanganianu (1,5 V) jest znacznie większy niż potencjał tlenu z powietrza (1,0 V)
szybkość rozkładu zwiększana jest przez:
wzrost stężenia H+
wzrost temperatury
obecność światła
NASTAWIANIE MIANA KMnO4:
odważyć ok. 3,2 g KMnO4 (nieco więcej niż teoretycznie potrzeba)
wsypać do butli z ciemnego szkła i uzupełnić wodą destylowaną do 1 l
zostawić na kilkanaście dni w celu utlenienia zanieczyszczeń
przesączyć przez tygiel Goocha
przelać do ciemnej butli i wstrząsnąć by wyrównać stężenie
ustalić molowość
Substancje wzorcowe do nastawiania miana:
Na2C2O4
H2C2O4 ∙ 2H2O (może ulec zwietrzeniu)
powyższe reakcje zachodzą początkowo powoli, później katalizowane są przez Mn2+, który powstaje w reakcji
wpływ na szybkość reakcji ma temperatura (optymalna: 55-60°C)
zbyt wysoka temperatura rozpad nadmanganianu i kwasu szczawiowego (na CO2, CO i wodę)
reakcja przebiega w środowisku kwaśnym
nie zakwaszać HCl - reakcja między nadmanganianem a kwasem szczawiowym indukuje reakcję między nadmanganianem i HCl zbyt duże zużycie KMnO4arszenik - As2O3
miareczkowanie na gorąco w obecności śladów jodanu lub jodku (katalizator)
zakwaszenie kwasem solnym
sól Mohra: Fe(NH4)2(SO4)2 ∙ 6 H2O
duża masa cząsteczkowa
trudno otrzymać w stanie czystym
roztwór zakwasić kwasem siarkowym i miareczkować mianowanym roztworem KMnO4 do momentu uzyskania trwałej barwy różowej
można dodać kilka ml kwasu fosforowego aby lepiej było widać zmianę barwy (kwas ten wiąże jony żelaza w bezbarwny kompleks)
przeszkadzają: Cl- oraz HCl - tzw. indukcja chemiczna nadmanganian utlenia je do wolnego chloru albo HClO zawyżenie wyników miareczkowania - można dodać jonów MnO42-, które obniżają potencjał KMnO4 tak, że nie starcza on do utlenienia chlorków
roztwór wprowadzać powoli energicznie mieszając
jeżeli analizowane żelazo jest trójwartościowe to trzeba je zredukować:
dodanie SnCl2:dodanie SO2, H2S
usunięcie nadmiaru reduktora:(Hg2Cl2 jest nierozpuszczalny w wodzie i nie reaguje z KMnO4)
redukcja na gorąco, usunięcie nadmiaru reduktora na zimnozbyt duży nadmiar reduktora:
(Hg reaguje z KMnO4 - utlenienie do Hg2+)
po redukcji w roztworze jest dużo Cl- i żeby umożliwić otrzymanie prawidłowego wyniku dodaje się tzw. roztwór Zimmermanna-Reindhardta:
MnSO4 - zmniejsza potencjał utleniający KMnO4 i katalitycznie przyspiesza reakcję z Fe2+
kwas fosforowy i kwas siarkowy - tworzą z żelazem(III) bezbarwne kompleksy zanika żółta barwa jonów i łatwiej zauważyć punkt końcowy miareczkowania; poza tym zmniejsza się potencjał układu Fe2+/Fe3+ rzez co utlenianie jest łatwiejsze
roztwór soli Mohra zakwasza się H2SO4 rozcieńcza wodą destylowaną do 300 ml i miareczkuje do uzyskania stałego różowego zabarwienia
brak konieczności redukcji
reakcja katalizowana przez Mn2+
do roztworu H2O2 dodaje się stabilizatorów: mocznika, kwasu moczowego, acetanilidu w celu zwiększenia trwałości roztworu. Redukują one KMnO4 9z wyjątkiem mocznika) przez co otrzymany wynik jest za duży
w środowisku obojętnym lub słabo kwaśnym
jeżeli miareczkowanie wykonuje się w obecności soli wapnia, baru, magnezu lub cynku wytrącają się manganiny tych metali, np. Zn(HMnO3)2 - ich skład jest zmienny ale cały czterowartościowy mangan znajduje się wtedy w postaci osadu
wytrąca się Fe w postaci Fe(OH)3 za pomocą nadmiaru zawiesiny tlenku cynku
miareczkuje się Mn2+ na gorąco mianowanym roztworem KMnO4
Wytrącenie wapnia w postaci szczawianu
rozpuszczenie osadu szczawianu w kwasie siarkowym
Miareczkowanie kwasu szczawiowego roztworem mianowanym KMnO4
środowisko kwaśne
na gorąco
miareczkujemy gorący, zakwaszony roztwór KMnO4 (o znanej ilości KMnO4) roztworem azotynu
na gorąco, w środowisku kwaśnym
redukujemy azotan odmierzonym nadmiarem mianowanego roztworu FeSO4
nadmiar reduktora odmiareczkowujemy mianowanym roztworem KMnO4
Oznaczenia oksydymetryczne:
miareczkowanie bezpośrednie
mianowany roztwór jodu
oznaczamy substancje o potencjale utleniającym niższym niż potencjał układu I2/2I-, np. As2O3, H2SO3, S2O32-, S2-, Sn2+
Oznaczenia reduktometryczne:
miareczkowanie podstawieniowe
mianowany roztwór Na2S2O3
substancja oznaczana utlenia jodki do wolnego jodu, który następnie jest miareczkowany mianowanym roztworem tiosiarczanu
oznaczane są substancje o potencjale utleniającym wyższym niż potencjał układu I2/2I-, np. MnO4-, BrO3-, Fe3+, Cu2+, Cr2O72-
Wskaźnik: zawiesina skrobii - w obecności jodku tworzy z jodem związek o zabarwieniu szafirowym
słaba rozpuszczalność w wodzie
łatwo ulatnia się jod z powodu dużego ciśnienia paryjod rozpuszcza się w stężonym roztworze KI:
światło przyspiesza utlenianie jodku tlenem z powietrza (zwiększenie miana):
oczyszczenie przez sublimację:
mieszaninę stałego jodu (10 g), KI (1 g) - reaguje z zanieczyszczeniami i CaO - wysusza jod (2 g) rozetrzeć w moździerzu
przenieść do zlewki bez dziobka i zakryć zlewką kolbą okrągłodenną wypełnioną zimną wodą
ogrzewać zlewkę słabym płomieniem palnika dopóki cały jod nie osiądzie w postaci kryształków na zimnej powierzchni kolby
powtórzyć bez dodatku KI i CaO
Odważyć około 1,27 g przesublimowanego jodu
Przesypać przez suchy, czysty lejek do kolbki 100 ml
Puste naczynko wagowe zważyć w celu obliczenia masy jodu w kolbce
Spłukać lejek roztworem 4 g KI w jak najmniejszej ilości wody
Zawartość wymieszać aż do całkowitego rozpuszczenia i uzupełnić wodą destylowaną do współmierności
Pozostawić na ½ h w celu osiągnięcia przez roztwór temperatury pokojowej (rozcieńczanie i rozpuszczanie jodu to procesy endotermiczne)
As2O3 (arszenik) lub kwas arsenawy (H3AsO3)
Na2S2O3 (tiosiarczan sodu)
utlenia się do czterotionianu sodu: Na2S4O6
wydzielające się 2 elektrony redukują jod do jodku: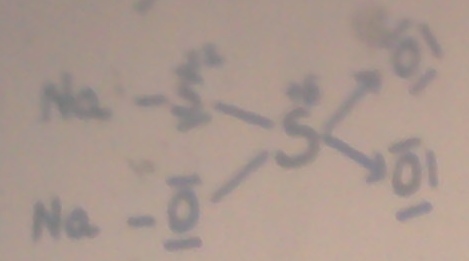
wzór elektronowy tiosiarczanu:wzór elektronowy czterotionianu:
podstawowa reakcja jodometryczna:
mocniejsze utleniacze oraz jod w środowisku zasadowym utleniają tiosiarczan do siarczanu (jest to reakcja niekorzystna, bo zużywa się aż 8 moli jodu na 1 mol tiosiarczanu) dlatego miareczkowanie roztworem tiosiarczanu zawsze w środowisku kwasowym lub obojętnym
nietrwałość roztworów tiosiarczanu:
K2Cr2O7:
szybkość zależy od stężenia H+ reakcję przeprowadzamy w mocno kwaśnym środowisku
zbyt dużo H+ - zachodzi utlenianie jodowodoru tlenem z powietrza
dodatek KI zredukowanie utleniacza i przeprowadzenie wolnego jodu w KI3
KI nie może zawierać jodanu bo w środowisku kwaśnym zajdzie reakcja:
odważyć 0,49 g dwuchromianu
rozpuścić do 100 ml w kolbie miarowej
przenieść objętość pipety do kolbki stożkowej, dodać 2 g KI i 20 ml H2SO4
zakryć korkiem, wymieszać, na 15 minut zostawić w ciemnym miejscu
miareczkować wydzielony jod roztworem tiosiarczanu (przy zabarwieniu żółtozielonym dodać skrobii i dalej do zmiany barwy z niebieskiej na jasnozieloną)
KMnO4 (mianowany roztwór):
do kolby stożkowej wlać określoną objętość mianowanego roztworu KMnO4
dodać 10 ml H2SO4 i 2 g KI
zostawić w ciemnym miejscu na 5 minut
miareczkować wydzielony jod roztworem tiosiarczanu (przy zabarwieniu jasnożółtym dodać wskaźnika skrobiowego i dalej miareczkować do odbarwienia)
od odczytanej objętości odjąć objętość połowy kropli
mianowany roztwór jodu
jodan potasowy: KIO3 i bromian potasowy: KBrO3 - reagują bardzo szybko i dają bezbarwne produktybezbarwne roztwory można miareczkować bez wskaźnika, ponieważ jod zabarwia roztwory wodne
jod + skrobia związek addycyjny o intensywnie niebieskim zabarwieniu (silniejszym w obecności jodków)
czułość reakcji mniejsza w obecności związków organicznych i przy zwiększonej temperaturze
konieczna odpowiednia ilość wskaźnika
jeżeli barwa jest fioletowa lub czerwonawa (z powodu dużej ilości dekstryn) to roztwór nie nadaje się do użytku słabe i powolne odbarwienie pod wpływem tiosiarczanu
mało trwały - rozkład przez drobnoustroje na dekstrynę i dekstrozę (która jest reduktorem i powoduje poważne błędy w oznaczeniach)
większa trwałość po dodaniu środka sterylizującego - ZnCl2 lub HgI2
wskaźnik dodaje się dopiero przed zakończeniem miareczkowania, ponieważ mocne kwasy obecne w oznaczanym roztworze mogą spowodować hydrolizę skrobii
As2O3 występuje w postaci kwasu, ponieważ sam arszenik jest związkiem nierozpuszczalnym w wodzie
kierunek reakcji zależy od stężenia H+, ponieważ oba układy mają ten sam potencjał oksydacyjny
pH w granicach 4-9,2
zbyt duże pH - reakcja przebiega w lewo;
zbyt małe pH = nadmiar jonów OH-, które reagują z jodem (zbyt wysokie wyniki oznaczania):utrzymanie pH przez dodanie roztworu NaHCO3 lub KHCO3 - reaguje on z jodowodorem tworząc kwas węglowy, który razem z wodorowęglanem tworzy bufor utrzymujący pH w żądanym zakresie
roztwór As2O3 dodać do kolbki
dodać NaHCO3 i wskaźnik skrobiowy
miareczkować roztworem jodu do niebieskiego zabarwienia
potrzebny duży nadmiar KI
przyspieszenie reakcji przez zakwaszenie H2SO4 (pH niższe od 4,5)
zbyt niskie pH = ryzyko utlenienia I- tlenem z powietrza (Cu2+ katalizują reakcję) trzeba szybko miareczkować
zbyt duże rozcieńczenie - mała szybkość reakcji
nie trzeba czekać na wydzielenie się jodu
Roztwór CuSO4 rozcieńczyć wodą do 100 ml w kolbie miarowej
Objętość pipety przenieść do kolby stożkowej
Dodać 4-8 ml H2SO4 i 1,5-2 g KI
Zamieszać i od razu miareczkować roztworem Na2S2O3
Pod koniec miareczkowania dodać wskaźnika skrobiowego
Punkt końcowy = zmiana barwy z niebieskiej na bladoróżową
roztwory mianowane Ce(SO4)2 o intensywnie żółtym zabarwieniu
bez wskaźnika (niezbyt rozcieńczone roztwory)
zawsze w środowisku kwaśnym (inne: hydroliza i wytrącenie soli cerowych)
roztwory trwalsze niż KMnO4
oznaczanie żelaza: nawet w obecności chlorków
oznaczanie żelazocyjanków (wskaźnik: ferroina lub FeCl3, który z cyjanożelazianem tworzy błękit pruski)mianowany roztwór K2Cr2O7 łatwo uzyskać w czystym stanie brak konieczności nastawiania miana
miareczkowanie w środowisku kwaśnym
na zimno nie reaguje z HCl
konieczne stosowanie wskaźnika, bo jony Cr3+ są zielone
oznaczanie żelaza:miareczkowanie mianowanym roztworem bromianu potasu w obecności KBr (pierwsza kropla nadmiaru reaguje z bromkiem i tworzy się wolny brom)
wskaźniki: brom (barwa żółta) lub nieodwracalne (oranż metylowy, czerwień metylowa, kwas indygosulfonowy) lub odwracalne (żółcień chinolinowa, α-naftoflawon)
oznaczanie substancji organicznych (zwłaszcza fenoli i innych aromatycznych) bromowanie, np. 8-hydroksychinoliny:
oznaczanie As3+:
oznaczanie Cu+:oznaczanie hydrazyny:
sole Ti3+ - jedne z najsilniejszych reduktorów
roztwory mianowane chlorku/siarczanu tytanowego
im wyższe pH tym większe właściwości redukcyjne
konieczny odczyn mocno kwaśny zapobieganie hydrolizie soli
wskaźniki: rodanek potasu (reaguje z Fe3+) a także wskaźniki redoks (błękit metylenowy, difenyloamina)oznaczanie żelaza:
OZNACZANIE ŻELAZA:
Możliwe jest również oznaczanie żelaza w soli Mohra (Fe(NH4)2(SO4)2 ∙ 6 H2O):
OZNACZANIE NADTLENKU WODORU
OZNACZANIE Mn obok Fe METODĄ VOHLARDA I WOLFFA
ZASADA OZNACZANIA:
OZNACZANIE Ca2+
OZNACZANIE NO2-
OZNACZANIE NO32-
JODOMETRIA
Właściwości roztworów jodu:
Przygotowanie roztworu jodu:
Substancje wzorcowe do nastawiania miana roztworu jodu:
Właściwości roztworu tiosiarczanu sodu:
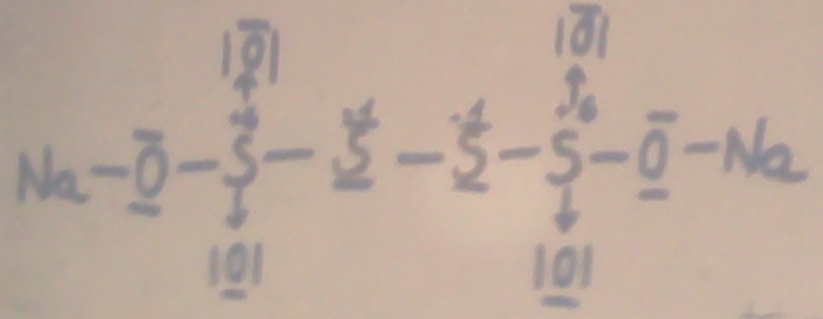
Przyczyna |
Skutek |
Uwagi |
rozkład tiosiarczanu przez tiobakterie |
zmniejszenie miana |
zapobieganie: dodanie HgI2 (właśc. odkażające) |
|
zmniejszenie miana |
reakcja przyspieszana katalitycznie przez Cu2+ |
|
zwiększenie miana |
chronić roztwór przed dostępem CO2 z powietrza; można dodać węglanu sodowego (cofa reakcję) |
lokalne nadmiary tiosiarczanu wystarczą do redukcji jodu (ta reakcja jest szybsza więc zachodzi jako pierwsza), a następnie do reakcji z kwasami |
otrzymujemy za duże wyniki |
miareczkowanie przeprowadzać powoli, stale mieszając |
Substancje wzorcowe do nastawiania miana roztworu Na2S2O3:
WYKONANIE:
WYKONANIE:
e) miedź metaliczna - jeżeli roztwór tiosiarczanu ma służyć do oznaczania miedzi
WSKAŹNIK SKROBIOWY
OZNACZANIE ARSZENIKU
OZNACZANIE MIEDZI
INNE OZNACZENIA
Oznaczenie |
Reakcja |
Uwagi |
H2S |
|
w środowisku kwaśnym bo w zasadowym S2- utlenia się do siarczanów |
H2SO3 i jego sole |
|
oznaczaną substancję wprowadzamy do nadmiaru mianowanego roztworu jodu (inaczej wyniki są za małe bo H2SO3 utlenia się tlenem z powietrza) |
Fe3+ |
|
roztwór rozcieńczony z dużą ilością kwasu i dużym nadmiarem KI |
H2O2 |
|
w środ. kwasowym - katalizator np. molibdenian amonowy w środ. zasadowym - tworzy się podjodyn, który reaguje z H2O2, a po zakwaszeniu wydziela się jod, który odmiareczkowuje się tiosiarczanem |
Podchloryny |
|
|
Wyższe tlenki |
|
wolny chlor który powstaje podczas utlenienia HCl przez wyższe tlenki absorbuje się w KI (z wydzieleniem jodu, który później miareczkuje się Na2S2O3) |
Jodki |
|
Utlenienie dwuchromianem w środowisku kwasowym zobojętnienie BaCO3 i usunięcie nadmiaru utleniacza miareczkowanie roztworem Na2S2O3 |
Mocne kwasy |
|
Wykorzystywana do ustalania miana roztworów kwasów |
CEROMETRIA
CHROMIANOMETRIA
BROMIANOMETRIA
TYTANOMETRIA
1. Wyjaśnij pojęcie amfoteru redoks i podaj przykład (z reakcjami cząsteczkowymi i bilansem) - to jeszcze spoko
2. Podaj w jaki sposób nastawisz na pracowni miano roztworu tiosiarczanu + reakcja z bilansem
3. Z jakich właściwości Ce4+ i Ti3+ korzysta się w redoksymetrii (+ reakcje)
4. Podaj w jaki sposób oznaczysz redoksymetrycznie Ca2+
5. Z jakich właściwości układu I2/2I- korzysta się przy oznaczaniu arsenu i Cu2+
6. Na czym polega oznaczania bromianometryczne (dwa rodzaje).
Wyszukiwarka
Podobne podstrony:
aniony, farmacja I i II, chemia nieorganiczna, ćwiczenia
cwiczenie11, Płyta farmacja Poznań, II rok, chemia analityczna, ćwiczenia
cwiczenie3, Płyta farmacja Poznań, II rok, chemia analityczna, ćwiczenia
semquiz 12-5a, farmacja I i II, chemia organiczna, seminaria
Redoksymetria, farmacja, II sem, chemia ilościowa
semquiz 12-5, farmacja I i II, chemia organiczna, seminaria
Podział mieszanin chemicznych, Science ^^, Farmacja, 1 rok, Chemia, ćwiczenia, Semestr II
rozpiska analityczna wykłady, farmacja, II sem, chemia ilościowa
chemia analityczna, Farmacja UMB, Farmacja UMB, II Rok, Chemia analityczna II - instrumentalna
Techniki laboratoryjne, Farmacja ŚUM, II ROK, Chemia organiczna, Chemia organiczna, Ćwiczenia, I sem
spektrofluorymetria, Farmacja UMB, Farmacja UMB, II Rok, Chemia analityczna II - instrumentalna
Tok jakościowej analizy organicznej, Farmacja ŚUM, II ROK, Chemia organiczna, Chemia organiczna, Ćwi
skroty anal 2, Farmacja UMB, Farmacja UMB, II Rok, Chemia analityczna II - instrumentalna
Analityka med (kołoII), Płyta farmacja Poznań, II rok, chemia analityczna, kolokwia, 2
refraktometria, Farmacja UMB, Farmacja UMB, II Rok, Chemia analityczna II - instrumentalna
Pytania z wejściówek, analityka medyczna UMP 2014, chemia fizyczna, ćwiczenia
więcej podobnych podstron