Technologia Chemiczna |
|
17.10.2007 |
Grupa 5, zespół 3 |
Ćw. nr 3 |
Dr inż. Izabela Stępniak |
Temat i cel ćwiczenia:
Wyznaczenie momentu dipolowego nitrobenzenu.
Pomiary i obliczenia:
a) współczynnika załamania światła n
Substancja: |
Próba 1 |
Próba 2 |
Próba 3 |
Średnia arytmetyczna |
n2 |
Benzen |
1,5005 |
1,5010 |
1,5005 |
1,5009 |
2,2527 |
Nitrobenzen 0,005 |
1,5005 |
1,5005 |
1,5005 |
1,5005 |
2,2542 |
Nitrobenzen 0,01 |
1,5015 |
1,5015 |
1,5015 |
1,5015 |
2,2596 |
Nitrobenzen 0,02 |
1,5025 |
1,5020 |
1,5025 |
1,5023 |
2,2653 |
Nitrobenzen 0,05 |
1,5060 |
1,5055 |
1,5055 |
1,5064 |
2,2692 |
Nitrobenzen 0,08 |
1,5075 |
1,5070 |
1,5070 |
1,5072 |
2,2717 |
b) pojemności kondensatora:
Substancja: |
Pojemność kondensatora w pF |
Oznaczenia |
|
Pusty kondensator c1 |
21 |
C1 |
|
Benzen c3 |
35 |
C3 |
|
Nitrobenzen 0,005 |
37 |
C12 |
|
Nitrobenzen 0,01 |
37 |
C12 |
|
Nitrobenzen 0,02 |
40 |
C12 |
|
Nitrobenzen 0,05 |
50,5 |
C12 |
|
Nitrobenzen 0,08 |
59 |
C12 |
|
c) gęstości:
Waga pustego piknometru: 12,7055g
Pojemność piknometru: V=10ml
Substancja : |
Masa piknometru z roztworem |
Waga roztworu |
Gęstość d=m/v |
Benzen |
20,84225g |
8,13675g |
0,8137g/cm3 |
Nitrobenzen 0,005 |
20,86465g |
8,15915g |
0,8159 g/cm3 |
Nitrobenzen 0,01 |
20,84645g |
8,14095g |
0,8141 g/cm3 |
Nitrobenzen 0,02 |
20,86650g |
8,16100g |
0,8161 g/cm3 |
Nitrobenzen 0,05 |
21,04070g |
8,33520g |
0,8335 g/cm3 |
Nitrobenzen 0,08 |
21,15695g |
8,45145g |
0,8451 g/cm3 |
d) obliczenia masy cząsteczkowej
M C6H6 = 78g/mol
M C6H5NO2 = 123g/mol
M= X1M1 + X2M2
Substancja: |
Obliczenia masy wg wzoru: M= X1M1 + X2M2 |
Benzen |
78g/mol |
Nitrobenzen 0,005 |
0,995 ∙ 78g + 0,005 ∙ 123g = 78,225g/mol |
Nitrobenzen 0,01 |
0,99 ∙ 78g + 0,01 ∙ 123g = 78,45g/mol |
Nitrobenzen 0,02 |
0,98 ∙ 78g + 0,02 ∙ 123g = 78,9g/mol |
Nitrobenzen 0,05 |
0,95 ∙ 78g + 0,05 ∙ 123g = 80,25g/mol |
Nitrobenzen 0,08 |
0,92 ∙ 78g + 0,08 ∙ 123g = 81,6g/mol |
e) wyznaczanie stałej dielektrycznej
![]()
![]()
przykładowe wyliczenie dla nitrobenzenu 0,005 ![]()
Substancja: |
Stała dielektryczna: |
Benzen |
2,282 F/m |
Nitrobenzen 0,005 |
2,4675 F/m |
Nitrobenzen 0,01 |
2,4675 F/m |
Nitrobenzen 0,02 |
2,7425 F/m |
Nitrobenzen 0,05 |
3,7055 F/m |
Nitrobenzen 0,08 |
4,4852 F/m |
F)obliczanie polaryzacji
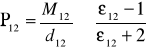
Przykładowe obliczenie dla benzenu:
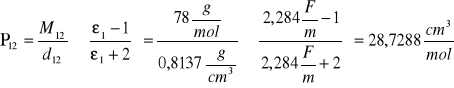
Substancja: |
Polaryzacja |
Benzen |
28,7288 cm3/mol |
Nitrobenzen 0,005 |
31,4957 cm3/mol |
Nitrobenzen 0,01 |
31,6556 cm3/mol |
Nitrobenzen 0,02 |
35,5199 cm3/mol |
Nitrobenzen 0,05 |
45,6563 cm3/mol |
Nitrobenzen 0,08 |
51,8895 cm3/mol |
G) Obliczanie refrakcji
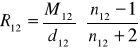
Przykładowe obliczenia dla benzenu:
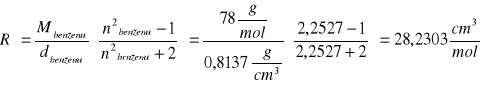
Substancja: |
Refrakcja |
Benzen |
28,2303 cm3/mol |
Nitrobenzen 0,005 |
28,2642 cm3/mol |
Nitrobenzen 0,01 |
28,4949 cm3/mol |
Nitrobenzen 0,02 |
28,6751 cm3/mol |
Nitrobenzen 0,05 |
28,6843 cm3/mol |
Nitrobenzen 0,08 |
28,7449 cm3/mol |
Wykresy:
Refrakcji od ułamka molowego
Polaryzacji o ułanka molowego:
Wyznaczenie polaryzacji i refrakcji metoda ekstrapolacji:
Polaryzacji
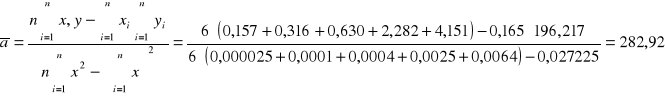
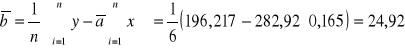
Refrakcji
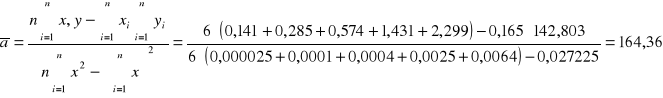
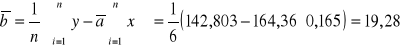
Wyliczenie momentu dipolowego nitrobenzenu:
k -stała Boltzmana 1,380658 ∙ 10-3 ![]()
![]()
- stała dielektryczna próżni 8,854188 ![]()
N- stała Avogadra 6,02 ∙ 1023
T- 200 C= 293K
P- 24,92 ![]()
= 2,492 ∙![]()
R- 19,28 ![]()
=1,928 ∙![]()

=1,737 ∙ 10-24
1 D -- 3,33564 ∙ 10-30 C ∙ m
x D -- 1,73798 ∙ 10-24 C ∙ m
x= 5,2 D
Wnioski:
- wraz ze wzrostem stężenia nitrobenzenu wzrasta pojemność kondensatora, gęstość roztworu, masa cząsteczkowa oraz współczynnik załamania światła.
- zauważyłem że wraz ze wzrostem stężenia nitrobenzenu wzrasta także refrakcja i polaryzacja.
- moment dipolowy nitrobenzenu wyliczony przeze mnie wynosi 5,2 D
- natomiast wartość tabelaryczna momentu dipolowego dla nitrobenzenu wynosi 4,3 D, różnica wyników może być spowodowana błędnymi pomiarami.
Wyszukiwarka
Podobne podstrony:
5416
5416
5416
5416
5416
5416
5416
04Ochrona praw konsumenta w UE docxid 5416 ppt
BA5415,5416
więcej podobnych podstron