Tomasz Andryszewski
Ćwiczenie 2.
Wyznaczanie stałych równania Tafela
Przepływ prądu stałego przez roztwór elektrolitu może dostarczyć ważnych informacji o samym roztworze elektrolitu a przede wszystkim o procesach elektrodowych. Zanurzając do roztworu HCl dwie obojętne, elektrody platynowe i podłączając je do zewnętrznego źródła prądu stałego można wymusić proces elektrolizy pod warunkiem przyłożenia napięcia nieco wyższego od napięcia ![]()
określonego wzorem:
![]()
![]()
(1)
W równaniu (1) A jest powinowactwem chemicznym reakcji zachodzącej podczas elektrolizy, ve jest to bezwzględna wartość stechiometrycznego współczynnika elektronów zaś F to stała Faraday'a. W wyniku elektrolizy na katodzie zachodzi proces redukcji zaś na anodzie utleniania.
Najważniejszym etapem procesu elektrodowego jest etap przeniesienia ładunku pomiędzy substratem a elektrodą metaliczną. Właśnie te przeniesienie ładunku jest najwolniejszym etapem procesu elektrodowego. Szybkość procesu elektrodowego v mierzy się za pomocą gęstości prądowej i:
![]()
(2)
W równaniu (2) n to liczba elektronów biorąca udział w reakcji elektrodowej. Wprowadzając pojęcie nadpotencjału (nadnapięcia) η, jako różnicy potencjałów elektrody spolaryzowanej i elektrody odwracalnej, co można zapisać jako równanie:
![]()
(3)
można zapisać równanie (2) opisujące szybkość procesu elektrodowego w postaci najczęściej spotykanej:
![]()
(4)
W równaniu (4) α oznacza współczynnik przejścia, ![]()
. Nadpotencjał η wchodzący anodzie skład równania (4) jest zależny jedynie od procesu przenoszenia ładunku i bywa nazywany nadpotencjałem aktywacyjnym. Przyjmuje się ponadto, że dla procesu katodowego ηk<0 oraz ik>0, procesowi anodowemu będzie odpowiadał ηa>0 oraz ia<0. Jeżeli ηk<0 to równanie (4) upraszcza się do postaci:
![]()
(5)
Logarytmując równanie (5) otrzymujemy postać:
![]()
(6)
Przyjmując, że ![]()
oraz ![]()
można równanie (6) zapisać w prostszej postaci:
![]()
(7)
Równanie (7) nazywa się równaniem Tafela dla procesu katodowego. Podobne przekształcenia stosuje się, gdy rozpatruje się proces anodowy gdzie ηa>0. Wówczas końcowa postać równania Tafela wygląda następująco:
![]()
(8)
Sporządzając wykres zależności ![]()
otrzymuje się linię prostą, dzięki której można wyznaczyć stałe ak/a i bk/a z równań (7) i (8).
Otrzymane wyniki
Badanym roztworem była azotan V niklu
Dane do wykresu:
U [V] |
I [mA] |
U [V] |
I [mA] |
-0,00 |
0 |
-1,00 |
0,00178 |
-0,05 |
0 |
-1,05 |
0,002047 |
-0,10 |
0 |
-1,10 |
0,002581 |
-0,15 |
0 |
-1,15 |
0,003471 |
-0,20 |
0 |
-1,20 |
0,004094 |
-0,25 |
0 |
-1,25 |
0,006942 |
-0,30 |
0,000142 |
-1,30 |
0,00979 |
-0,35 |
0,000142 |
-1,35 |
0,012994 |
-0,40 |
0,000178 |
-1,40 |
0,01691 |
-0,45 |
0,000178 |
-1,45 |
0,02047 |
-0,50 |
0,000267 |
-1,50 |
0,023496 |
-0,55 |
0,000267 |
-1,55 |
0,025988 |
-0,60 |
0,000356 |
-1,60 |
0,02759 |
-0,65 |
0,000409 |
-1,65 |
0,029014 |
-0,70 |
0,000445 |
-1,70 |
0,030616 |
-0,75 |
0,000641 |
-1,75 |
0,032218 |
-0,80 |
0,000712 |
-1,80 |
0,033998 |
-0,85 |
0,000801 |
-1,85 |
0,035956 |
-0,90 |
0,000979 |
-1,90 |
0,038626 |
-0,95 |
0,001424 |
|
|
Na podstawie powyższych danych stworzono wykres zależności I=f(U)
Równanie linii trendy ma postać y = -0,0478x - 0,0509.
Chcąc wyznaczyć potencjał rozkładowy azotany niklu, należy wstawić do tego równania w miejsce y wartość 0 i rozwiązać otrzymane równanie względem x.
Stąd x = -1,06V
Obliczone gęstości prądu (J) są następujące (zakładamy, że powierzchnia elektrody wynosi 10-4 m2)
η [V] |
J [A/m2] |
lnJ |
η [V] |
J [A/m2] |
lnJ |
0,00 |
0 |
-------- |
-1,00 |
0,0178 |
-4,02856 |
-0,05 |
0 |
-------- |
-1,05 |
0,02047 |
-3,88879 |
-0,10 |
0 |
-------- |
-1,10 |
0,02581 |
-3,65699 |
-0,15 |
0 |
-------- |
-1,15 |
0,03471 |
-3,36073 |
-0,20 |
0 |
-------- |
-1,20 |
0,04984 |
-2,99894 |
-0,25 |
0 |
-------- |
-1,25 |
0,06942 |
-2,66758 |
-0,30 |
0,001424 |
-6,55429 |
-1,30 |
0,0979 |
-2,32381 |
-0,35 |
0,001424 |
-6,55429 |
-1,35 |
0,12994 |
-2,04068 |
-0,40 |
0,00178 |
-6,33114 |
-1,40 |
0,1691 |
-1,77727 |
-0,45 |
0,00178 |
-6,33114 |
-1,45 |
0,2047 |
-1,58621 |
-0,50 |
0,00267 |
-5,92568 |
-1,50 |
0,23496 |
-1,44834 |
-0,55 |
0,00267 |
-5,92568 |
-1,55 |
0,25988 |
-1,34754 |
-0,60 |
0,00356 |
-5,63799 |
-1,60 |
0,2759 |
-1,28772 |
-0,65 |
0,004094 |
-5,49823 |
-1,65 |
0,29014 |
-1,23739 |
-0,70 |
0,00445 |
-5,41485 |
-1,70 |
0,30616 |
-1,18365 |
-0,75 |
0,006408 |
-5,05021 |
-1,75 |
0,32218 |
-1,13264 |
-0,80 |
0,00712 |
-4,94485 |
-1,80 |
0,33998 |
-1,07887 |
-0,85 |
0,00801 |
-4,82706 |
-1,85 |
0,35956 |
-1,02287 |
-0,90 |
0,00979 |
-4,62639 |
-1,90 |
0,38626 |
-0,95124 |
-0,95 |
0,01424 |
-4,2517 |
|
|
|
Kolejnym krokiem było stworzenie wykresu zależności
Na podstawie równania linii trendu jestem w stanie wyznaczyć stałe równania Tafela
ηk = -0,2241 ln(J) - 1,8694, stąd stałe mają wartości:
a = -1,8694 V
b = -0,2241 V
Znając wzór opisujący nadpotencjał dla znacznej polaryzacji
![]()
wyznaczyć mogę:
współczynnik przeniesienia ładunku dla procesu katodowego
![]()
, gdzie
![]()
- współczynnik przeniesienia ładunku dla procesu katodowego
R - stała gazowa (8,31433 J/mol*K)
Z - ilość wymienianych elektronów przez kation (z = 2)
b - stała równania Tafela
F - stała Faradaya 96500C/mol
T - temperatura (273,15K)
Stąd 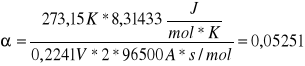
gęstość prądu wymiany
![]()
![]()
![]()
Zestawienie otrzymanych wyników:
] Roztwór |
Potencjał rozkładowy [V] |
Ładunek kationu z |
Gęstość prądu wymiany J0 [Am-2] |
Współczynnik przeniesienia ładunku α |
Ni(NO3)2 |
-1,06 |
2 |
2,3828*10-4 |
0,05251 |
Wyszukiwarka
Podobne podstrony:
698 699
699 735
699
699
699
699
M1949050000001 699
699
698 699
699 0003
699 0014
699 0010
699 0012
699 0005
699 actual
Nuestro Circulo 699 SERGIO GIARDELLI 1955 2015 16 de enero de 2016
699 0001
699 0007
699 0004
więcej podobnych podstron