PRELEKCJA 11
Bakterie beztlenowe
Beztlenowce znane przed1900 r.:
- Clostridium tetani (1884 r. - opisana przez Nicolaiera, 1889 r. - wyizolowana)
- C. perfringens - 1882 r.
- C. botulinum - 1896 r. przez Ermengera (z szynki)
Elektrony które są potrzebne do procesów metabolicznych są wykorzystywane do redukowania tlenu. Skutkuje to obniżeniem energii, która jest potrzebna do wzrostu i namnażania się komórek bakterii beztlenowych.
Reaktywne formy tlenu:
1. O2 + e- = -O2 - superoxide anion (anionorodnik ponadtlenkowy)
2. O2 + 2e- = H2O2 - hydrogen peroxide (nadtlenek wodoru)
3. O2 + 3e- = H2O2 + OH- - hydroxyl radical (rodnik hydroksylowy)
Beztlenowce:
- aerotolerancyjne - tolerują warunki tlenowe, ale się w nich nie rozmnażają
- fakultatywne - mogą przetrwać w warunkach niskiego stężenia tlenu
Faza I - bakteriostatyczna
Faza II - bakteriobójcza
Potencjał redox:
Eh[V1,mV] (można go zbadać przy pomocy wskaźników: resazuryny, resorufiny)
definicja: jest to wyrażona w woltach różnica potencjału między nie reagującą chemicznie metaliczną elektrodą a elektrodą wodorową w układzie o określonym stosunku stężeń utleniacza i reduktora, podana dla temperatury wyrażonej w stopniach Kelvina
beztlenowce wymagają potencjału w zakresie -150 do -250 mV (w warunkach tlenowych wynosi on +170 do +250 mV)
W celu stworzenia warunków sprzyjających wzrostowi bakterii beztlenowych obniża się potencjał redox podłoży hodowlanych poprzez dodanie do nich tioglikolanu lub cysteiny (substancje te obniżają potencjał redox w swoim otoczeniu zmniejszając zawartość tlenu)
anaerobioza - brak O2 cząsteczkowego
- do stworzenia warunków do hodowli stosowane są Clarbox'y, anaerostaty
Beztlenowce wykorzystują energię z reakcji redox z fermentacji.
Podłoża do hodowli beztlenowców:
PRAS - preredukowane, wyjałowione w warunkach beztlenowych podłoża
Brucella
Columbia
Schaedler
(0,6% lub 2% agar)
Podłoża wzbogacane krwią, heminą, witaminą K, żółtkiem.
Podłoża wybiórcze: antybiotyki, żółć itd.
- mogą być płynne, półpłynne lub stałe
- antybiotykiem różnicującym jest aminoglikozyd (nieaktywne wobec beztlenowców) lub gentamycyna
Materiał do badań w kierunku obecności bakterii beztlenowych:
- krew
- PMR
- ropa (pobrana drogą aspiracji bezpośredniej)
- fragmenty tkanek
- próbka z punkcji płucnej
- mocz (z punkcji nadłonowej)
- kał (tylko w kierunku Clostridium difficile lub ETBF - enterotoksynotwórczy B. subtilis)
- w kale znajduje się 1012 beztlenowców; w jelicie znajduje się 1000 razy więcej bakterii beztlenowych niż tlenowych
Materiał nie nadający się do badań w kierunku beztlenowców:
- plwocina odkrztuszana
- próbki po bronchoskopii, (BAL - popłuczyny oskrelikowo-pęcherzykowe)
- próbki pobrane przez sklepienie pochwy
- mocz oddany
Bakterie rosnące beztlenowo są częścią flory fizjologicznej błon śluzowych ludzi i zwierząt. Najważniejszym źródłem tych bakterii jest:
- jama ustna
- przewód pokarmowy
- skóra
- układ płciowy żeński
Zakażenia bakteriami rosnącymi beztlenowo mają miejsce, kiedy następuje przerwanie bariery śluzówkowej lub skóry na skutek urazów, zabiegów chirurgicznych, miejscowego niedokrwienia, nekrozy, co znacznie obniża potencjał oksydo-redukcyjny.
Zawartość bakterii beztlenowych:
- ślina: 109/ml
- kieszonka dziąsłowa: 1012/ml
- narządy płciowe kobiet: 109/ml
- kał: 1011 - 1012/g
Postacie zakażeń beztlenowcami:
a) zakażenia głowy i szyi:
- przewlekłe zapalenie zatok,
- przewlekłe zapalenie ucha środkowego,
- angina Ludwiga,
- ropień przyzębia
b) ropnie mózgu i ropniaki podtwardówkowe - beztlenowe infekcje OUN
c) zakażenia płuc i opłucnej:
- aspiracyjne zapalenie płuc,
- martwicze zapalenia płuc,
- ropnie płuc,
- ropniaki płuc
d) śródbrzuszne zakażenia:
- zapalenie otrzewnej,
- ropnie otrzewnej,
- ropnie wątroby
e) zakażenia żeńskiego układu płciowego:
- zapalenie jajowodu, zapalenie błony śluzowej macicy,
- ropnie jajowodów, sromu, pochwy, poronienie septyczne
f) zakażenia skóry i tkanek miękkich oraz kości
g) bakteriemia
BAKTERIE BEZTLENOWE - PODZIAŁ:
1.Gram(+):
a) zarodnikujące - laski:
-> Clostridium powodujące zgorzel gazową:
- C. perfringens
- C. oedematiens
- C. histolyticum
- C. septicum
- C. sordellii
-> pozostałe gatunki Clostridium:
- C. tetani
- C. botulinum
- C. difficile
- inne
b) niezarodnikujące
-> pałeczki:
- Bifidobacterium
- Propionibacterium
- Eubacterium
- Lactobacillus
- Actinomyces
-> ziarenkowce:
- Peptostreptococcus
- Peptococcus
2. Gram(-):
a) pałeczki:
-> Bacteroides:
- B. fragilis
- B. distasonis
- B. vulgaris
- B. cacceae
- B. ovatus
- B. urealyticus
-> Fusobacterium:
- F. nucleatum
- F. necrophorum
-> Porphiromonas gingivialis
-> Prevotella
- P. bivia
- P. melaninogenica
b) ziarenkowce:
-> Veilonella
Bakterie z rodzaju Clostridium:
- G(+), sporujące, bezwzględne beztlenowce
- wszechobecne w środowisku
- produkują toksyny
- zatruwacze i inwazyjne (np. C. perfringens)
- ponad 60 gatunków, większość to saprofity
- niektóre są patogenne dla człowieka i zwierząt, szczególnie przy obniżonym potencjale redox
Główne schorzenia które wywołują:
- zakażenia/zaburzenia układu pokarmowego
- ropiejące, głębokie infekcje tkanek
- infekcje skóry i tkanek miękkich
- bakteriemie
Flora jelitowa Clostridium sp.: 109 - 1010 /g
W glebie: 104/g
Chorobotwórczość gat. z rodzaju Clostridium:
1. Zgorzel gazowa:
-> C. perfringens, C. oedematiens, C. septicum, C. histolyticum, C. sordellii
2. C. perfringens, C. novyi, C. septicum:
-> najczęściej izolowane z zakażeń tkanek miękkich i w bakteriemiach
3. C. difficile, C. perfringens:
-> zakażenia układu pokarmowego
Clostridium perfringens:
wyróżniamy 5 typów w zależności od wytwarzanych toksyn (A-E)
rezerwuarem jest przewód pokarmowy koniowatych
Toksyny:
1. alfa - fosfolipaza C = lecytynaza, hemolityczna:
produkowana przez wszystkie szczepy, ale najwięcej przez szczep A
toksynę wykrywa się na podłożu z żółtkiem jaja kurzego
2. beta:
produkowana głównie przez szczepy B i C
3. delta:
produkowana głównie przez szczepy B i C
powoduje czerwonkę owiec i prosiąt
4. epsilon:
prototoksyna, aktywowana przez enzymy proteolityczne (trypsyna)
produkowana w logarytmicznej fazie wzrostu
działa na OUN zwiększając przepuszczalność naczyń mózgu, powoduje nekrozę
5. theta:
produkowana przez wszystkie szczepy, powoduje beta-hemolizę
6. zeta:
produkowana tylko przez szczep E, wytwarzana jako prototoksyna aktywowana przez enzymy
C. perfringens - chorobotwórczość c.d.:
- enterotoksyna - powoduje zatrucia pokarmowe, jest termolabilna
- polisacharydowa otoczka - 3/4 szczepów posiada otoczkę (galaktoza, galaktozamina, kwas uronowy, ramnoza)
- spory - na podłożu Ellnera: polipepton, ekstrakt drożdżowy, pH = 7,8
Postaci kliniczne:
1. zakażenie skóry i tkanki podskórnej:
zakażenie ropne i ropienie - pęcherzyk żółciowy, macica, jajowody, jama brzuszna
miejscowe zapalenie tkanki podskórnej
martwicze zapalenie jelit (beta-toksyna typu C!) - owrzodzenie, odsłonięcie ściany jelita
zgorzel gazowa - w głębokich ranach
typy zakażeń:
→ egzogenne skażenie rany (glebą, wodą)
→ endogenne skażenie: C. perfringens jest składnikiem flory fizjologicznej przewodu pokatmowego i żeńskich dróg rodnych - zakażenia związane są z zabiegami chirurgicznymi
2. zatrucia pokarmowe:
- spowodowane zwykle spożyciem pokarmów zawierających spory C. perfringens typu A
- spory wytrzymują nawet długie gotowanie, zaczynają się rozwijać gdy trafią do temperatury poniżej 75 0C
- za objawy odpowiedzialna jest enterotoksyna uwalniana przede wszystkim w jelicie grubym i krętym
- biegunka pojawia się zwykle 18 godzin po spożyciu zanieczyszczonego pokarmu
- objawy zwykle ustępują same
Odwrócony test CAMP do wykrywania Clostridium perfringens:
służy do identyfikacji C. perfringens przy użyciu S. agalactiae!
toksyny produkowane przez C. perfringens (głównie toksyna alfa) wspólnie z czynnikiem CAMP produkowanym przez GBS powoduję intensywną hemolizę widoczną jako sporej wielkości przejaśnienia w agarze z krwinkami (na poniższym zdjęciu przejaśnienia te mają formę półksiężyców)
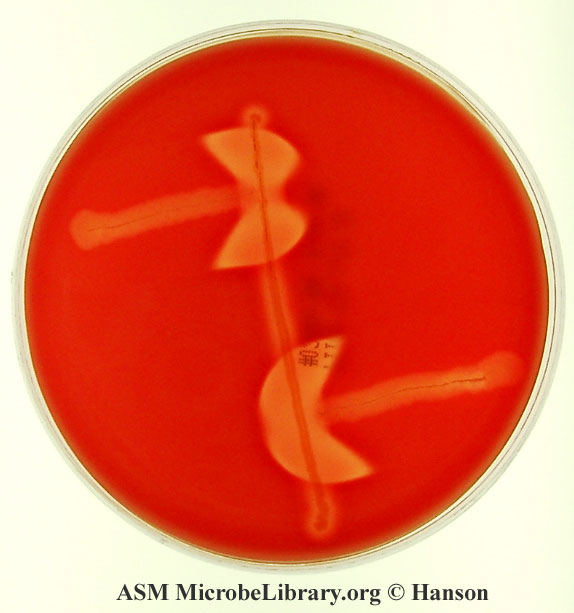
test nazywamy odwróconym, ponieważ badany drobnoustrój znajduje się tu w najdłuższej linii (na przebiegu średnicy krążka) w przeciwieństwie do testu CAMP wykrywającego S. agalactiae
Objaśnienia do powyższego krążka:
w najdłuższej linii (leżącej w średnicy krążka) znajduje się C. perfringens
w krótszych liniach, prostopadłych do średnicy znajduje się S. agalactiae
rozległe przejaśnienia w formie półksiężyców świadczą o rozległej hemolizie zachodzącej dzięki synergii między działaniem toksyn hemolitycznych C. perfringens a czynnikiem CAMP produkowanym przez GBS → wynik testu dodatni (z uwagi na przejaśnienia), więc badanym ustrojem jest C. perfringens
Clostridium difficile:
- opisane przypadki zakażeń epidemicznych
- powoduje biegunki u osób stosujących antybiotyki; odstawienie antybiotyku zwykle powoduje ustanie dolegliwości
- wytwarza spory subterminalne
- gdy zostanie zniszczona fizjologiczna flora przewodu pokarmowego Clostridium może się namnażać w ścianie jelita
Toksyny Clostridium difficile:
toksyna A (TcdA, masa 308 kDa) określana jako enterotoksyna, ponieważ odpowiada za objawy zatrucia pokarmowego i zapalenia jelita grubego
toksyna B (TcdB, masa 270 kDa) określana jako cytotoksyna
geny kodujące obydwie toksyny znajdują się w rejonie PaLoc (ang. pathogenicity locus) chromosomu bakteryjnego C. difficile
Szczep C. difficile - NAP1:
stosowane wymiennie nazwy szczepu: NAP1 (od North American pulse field type 1 - gdy badano szczep metodą elektroforezy pulsacyjnej), BI (gdy badano szczep metodą analizy miejsc restrykcyjnych), CD027 (gdy badano szczep metodą PCR), toksynowy typ III (toxinotype III - gdy analizowano wyłącznie wytwarzanie toksyn)
szczep wytwarza 16 x więcej toksyny A i 10 x więcej toksyny B
najwięcej toksyn produkowane jest w fazie wzrostu logarytmicznego
ten olbrzymi wzrost wytwarzania toksyn jest spowodowany obejmującą 18 par zasad delecją w genie regulatorowym tcdC, odpowiedzialnym za hamowanie ekspresji genów toksyny A i toksyny B
gen regulatorowy tcdC również znajduje się w regionie PaLoc bakteryjnego chromosomu Clostridium difficile
wszystkie szczepy NAP1 mają ponadto zdolność do wytwarzania toksyny binarnej o nieznanej patogenności oraz wykazują skłonność do hipersporulacji
oprócz szpitalnej postaci występują też pozaszpitalne zakażenia tym szczepem
CDAD - Clostridium difficile associated diseases:
choroby spowodowane przez Clostridium difficile
szpitalne oraz:
CA-CDAD - pozaszpitalne (community acquired)
Leczenie C. difficile:
lekami z wyboru: metronidazol i wankomycyna - podawane pulsacyjnie (co 2-3 dni);
w przypadku oporności skuteczność wykazują sinercid i linezolid
nigdy nie dochodzi do pełnego wyleczenia, ponieważ zawsze przetrwają spory, dlatego może dochodzić do nawrotów zakażenia tym samym szczepem (jeśli lekiem zastosowanym najpierw był metronidazol w leczeniu nawrotu prawdopodobnie skuteczniejsza będzie wankomycyna)
Barwienie w kierunku spor:
- spory wykrywane są barwieniem zielenią malachitową
RODZINA ACTINOMYCETACEAE:
- rodzina obejmuje 3 potencjalnie patogenne rodzaje: Actinomyces, Nocardia, Streptomyces
Actinomyces:
są składnikami fizjologicznej flory śluzówek
najważniejszy gatunek: Actinomyces israeli
Morfologia i charakterystyka:
pałeczki G(+)
barwią się z różną intensywnością
kształtu maczugowatego
tworzą też filamenty (postacie nitkowate) z rozgałęzieniami
rosną w warunkach beztlenowych
na podłożach płynnych rosną w postaci ziaren lub ziaren z wypustkami na dnie probówki
na podłożach stałych rosną w postaci kolonii gładkich, mikrokolonii "spider-like" lub kształtu zęba trzonowego (molar tooth)
Obraz kliniczny:
a) postać twarzowo-szyjna:
twardy, deskowaty naciek, w którym w następstwie martwicy tkanek powstają przetoki; z przetok wydobywa się ropna wydzielina z żółtymi, "siarkowymi" ziarnami (kolonie Actinomyces)
b) postać płucno-opłucnowa
c) postać brzuszna
d) postać dotycząca miednicy mniejszej po zastosowaniu spirali wewnątrzmacicznej
Rozpoznanie:
materiałem do badania jest ropa, wydzielin z przetok, wycinki z tkanek
materiał dokładnie oglądamy w poszukiwaniu żółtych ziaren (kolonii promieniowca)
w poszukiwaniu żółtych kolonii należy również dokładnie obejrzeć zużyte opatrunki
Leczenie:
drenaż ropni
penicylina G
Bacteroides spp.:
beztlenowe pałeczki Gram(-), nie tworzą spor
jest odpowiedzialny za 34% zakażeń beztlenowcami u ludzi - najczęstszy patogenny rodzaj z grupy beztlenowców!!
rodzaj Bacteroides jest dominującym beztlenowcem jelitowym u 2/3 ludzi
najliczniejszymi gatunkami Bacteroides w jelitach są B. thetaiotaomicron i B. vulgaris (B. fragilis jest najbardziej patogenny, ale ma najniższą liczebność)
Bacteroides fragilis jest głównym beztlenowcem izolowanym przy zakażeniach śródbrzusznych (zapalenie otrzewnej, ropnie)!! choć stanowi zaledwie 0,5-1% fizjologicznej flory jelita
poza zakażeniami jamy brzusznej rodzaj Bacteroides może też spowodować posocznicę
Czynniki determinujące chorobotwórczość:
enzymy: kolagenazy, neuraminidazy, DNA-azy, heparynazy, proteazy - inwazyjność i powstanie ropnia
85% szczepów B. fragilis wytwarza beta-laktamazę (koniugacyjna wymiana transpozonów z genami beta-laktamaz)
endotoksyna Bacteroides jest mniej toksyczna od klasycznego LPS, gdyż nie zawiera lipidu A
otoczki polisacharydowe - zapobiegają fagocytozie, jednocześnie działają chemotaktycznie na leukocyty prowadząc do powstania obfitego ropnia
Leczenie zakażeń Bacteroides:
metronidazol
karbapenemy
beta-laktamy w połączeniu z inhibitorami beta-laktamaz
niektóre cefamycyny (cefoksytyna)
Bacteroides jest z reguły oporny na:
aminoglikozydy
penicyliny
ostatnio liczne szczepy nabywają oporność na tetracykliny i erytromycynę oraz klindamycynę
Fusobacterium:
Gram(-) pałeczka beztlenowa
izolowane z jamy ustnej 50% zdrowych dorosłych
odpowiedzialne za 5% zakażeń beztlenowcami
Czynniki determinujące chorobotwórczość:
enzymy umożliwiające inwazję i prowadzące do powstania ropnia
w przeciwieństwie do Bacteroides Fusobacterium posiada silnie działającą endotoksynę - LPS!
Transformacja sferoplastyczna:
polega na przekształceniu się pałeczek Fusobacterium w sferoplasty - postacie nie mające ściany komórkowej
w procesie tym uwalniane są duże ilości endotoksyny mogące wywołać wstrząs septyczny
postać sferoplastyczna jest niewrażliwa na antybiotyki beta-laktamowe!!
Kliniczne postacie zakażenia Fusobacterium:
a) F. nucleatum:
zakażenia głowy, szyi, zębów
zakażenia płuc
zakażenia ran kąsanych przez człowieka
zakażenie tkanek okołowierzchołkowych zęba - peridontitis
b) F. necrophorum:
zapalenie gardła
ropnie okołomigdałkowe
zespół Lemierre'a
zakażenia głowy i szyi, zakażenia okołozębowe
zakażenia płuc
zakażenia ran kąsanych przez człowieka
Leczenie:
- penicylina lub metronidazol
BBE agar:
podłoże agarowe z dodatkiem żółci i eskuliny oraz gentamycyny
pozwala wykryć zhydrolizowaną eskulinę.
uwolniony składnik reaguje z solami żelaza, w wyniku czego pojawia się łatwo wykrywalne czarne zabarwienie kolonii B. fragilis
Agar Schaedlera +5% krwinki barana:
podłoże szczególnie przydatne do hodowli beztlenowców
dodatek czynników wzrostowych, jak ekstrakt drożdżowy, hemina, witamina K3 oraz dodatek krwinek barana pozwala na wzrost drobnoustrojów o wysokich wymaganiach pokarmowych
CCCA - Clostridium difficile agar:
podłoże do hodowli C. difficile
Columbia agar wzbogacony 5% krwią barana
właściwości selekcyjne uzyskuje się przez wprowadzenie cykloseryny, cefoksytyny i amfoterycyny B
wymienione zastosowane antybiotyki uniemożliwiają wzrost większości drobnoustrojów obecnych w kale (pałeczek jelitowych, paciorkowców, gronkowców, beztlenowców oraz drożdżaków)
Stopa cukrzycowa:
a) udział beztlenowców:
- Peptostreptococcus (P. magnus, P.anaerobius, P. asaccharolyticus)
- Bacteroides fragilis
- Prevotella
- inne
Beztlenowce produkujące beta-laktamazę:
- B. fragilis (aż 85% szczepów!!)
- Prevotella melaninogenica (15% szczepów)
- Prevotella oralis
- P. bivia
- Porphiromonas spp.
- Bilophila wadsworthia
Fizjologiczna flora pochwy:
stosunek beztlenowców do tlenowców: 2-5 : 1
liczebność bakterii spada podczas menstruacji
flora pełni funkcję ochronną wydzielając kwas i nadtlenek wodoru zapobiegając w ten sposób infekcjom drożdżakowym i bakteryjnym
Najczęściej występujące gatunki:
Lactobacillus acidophilus
L. iners
L. crispatus
L. delbruekii
L. jensenii
L. buchneri
L. gasseri
Bifidobacterium sp.
Bakteryjna waginoza:
BV - bacterial vaginosis
określana również jako niespecyficzne zapalenie pochwy
najczęstsza przyczyna zapalenia pochwy
spowodowana zachwianiem równowagi bakteryjnej flory zamieszkującej pochwę (szczególnie zmniejszeniem liczebności pełniących ochronną funkcję gatunków Lactobacillus) często wskutek stosowania antybiotyków
BV może być związana z aktywnością seksualną jednak nie jest chorobą przenoszoną drogą płciową senso stricte!
Czynniki etiologiczne:
Gardnerella vaginalis (zwana poprzednio Haemophilus vaginalis i Corynebacterium vaginale)
Bacteroides
Mobiluncus
Mycoplasma
G. vaginalis jest małą pałeczką, Gram(-) lub Gram-zmienną pod mikroskopem, mającą jednak ścianę komórkową o cechach bakterii Bram(+)
Kryteria kliniczne do diagnostyki BV (kryteria Amsel):
- homogenna, rzadka wydzielina barwy białej lub żółtej
- pH pochwy większe niż 4,5
- pozytywny test aminowy - cuchnący (rybi) zapach po dodaniu 10% KOH
- obecność "clue cells" - komórki nabłonka oblepione bakteriami
Obecność co najmniej 3 spośród wymienionych cech stanowi podstawę do rozpoznania vaginozy.(BV)
Kryteria Nugenta do diagnozowania BV:
oznacza się liczebność morfotypów: 1. Lactobacillus spp., 2. Mobiluncus spp. oraz 3. Gardenrella vaginalis i Bacteroides spp. w polu widzenia pod powiększeniem 1000x i pod immersją (wylicza się średnią z kilku pomiarów) - preparat barwiony metodą Grama
dla każdego przedziału liczebności przypisana jest określona liczba punktów, które są następnie sumowane
Wyniki punktowe:
7-10 pkt. - bakteryjna waginoza
4-6 pkt. - stadium pośrednie
0-3 pkt. - stan prawidłowy
Leczenie BV:
- metronidazol lub klindamycyna
Izolowanie Gardnerella:
Gardnerella agar: agar Columbia + krew + Tween + kolistyna + kolistyna + kwas nalidyksowy + amfoterycyna B
pojawia się hemoliza beta, wynik testu na katalazę i oksydazę jest ujemny
kolonie G. vaginalis są małe, okrągłe, przezroczyste, z wyraźną krawędzią
Krążki GV:
krążki bibułowe z bacytracyną, służą do identyfikacji G. vaginalis
jeśli wokół krążka nałożonego na płytkę z posianą bakterią po 18-24 godz. pojawi się strefa zahamowania wzrostu o średnicy 16 mm i więcej należy badany szczep zidentyfikować jako G. vaginalis
MRS agar (de Man, Rogosa, Sharpe):
podłoże agarozowe w nieznacznym stopniu selektywne, umożliwia rozwój bakterii rodzaju Lactobacillus
zawiera enzym peroksydazę chrzanową i substrat dla tego enzymu - TMB (tetrametylobenzydynę) - z którego powstaje barwny produkt
układ enzym substrat służy do oznaczania H2O2 wytwarzanego przez Lactobacillus
kolonie barwy błękitnej - wytwarzają H2O2, przy udziale którego peroksydaza przekształca TMB
kolonie nie wytwarzające nadtlenku wodoru pozostają bezbarwne
Zarodniki - wytwarzane w warunkach niesprzyjających - ich postać różni się u poszczególnych przedstawicieli:
- C. tetani - spory w kształcie pałeczek dobosza
- C. botulinum - spora wygląda jak rakieta tenisowa
- C. perfringens - spora w kształcie agrafki
- C. difficile - spory subterminalne
Zgorzel gazowa:
- preparat bezpośredni, bakterie wytwarzają otoczkę
C. perfringens - wywołuje podwójną hemoliza, posiada zdolność do wydzielania lecytynazy (toksyna alfa) - podłoże z jajami,
Test CAMP odwrotny (CAMR) - przeprowadza się przy podejrzeniu o przynależność do C. perfringens
Wykazanie obecności otoczki - w barwieniu pozytywno-negatywnym w sprzyjających warunkach
Badanie lekowrażliwości beztlenowców:
Lekowrażliwość beztlenowców należy badać, gdy:
pacjent jest krytycznie chory
terapia jest długotrwała
wystapiło niepowodzenie terapeutyczne lub utrzymująca się infekcja
wykryto szczep związany z opornością
rola antybiotyku jest kluczowa a leczenie empiryczne nie wystarcza do wyleczenia
wystąpiła nieznana oporność
również w celu dorocznej kontroli terapii empirycznej
Wskazania kliniczne:
ropień mózgu
zapalenie wsierdzia
osteomyelitis
zapalenie stawów
infekcje zębów
infekcje protez
oporna lub nawracająca bakteriemia
Ograniczenia metod badania wrażliwości:
metoda krążkowo-dyfuzyjna - nie do przyjęcia (strefy zahamowania wzrostu pod wpływem zmiennego tempa wzrostu beztlenowców)
metoda krążkowa w bulionie jest niewiarygodna i niezalecana
metoda mikrorozcieńczeń w bulionie może być nieoptymalna, bo:
15-40% hodowli nie daje wzrostu
stosowane niskie inokulum może niedoszacować oporność
badanie metronidazolem jest problematyczne
rozwlekłe punkty odczytu mogą być trudne do interpretacji
referencyjna metoda rozcieńczeniowa na agarze jest niewygodna i kosztowna przy zastosowaniu dla kilku szczepów
system podwójnych rozcieńczeń może dać mało wiarygodną kategoryzację w przypadku leków, gdzie MIC leży blisko interpretacyjnych punktów odczytu
Odwrócony test CAMP do wykrywania Clostridium perfringens:
służy do identyfikacji C. perfringens przy użyciu S. agalactiae!
toksyny produkowane przez C. perfringens (głównie toksyna alfa) wspólnie z czynnikiem CAMP produkowanym przez GBS powoduję intensywną hemolizę widoczną jako sporej wielkości przejaśnienia w agarze z krwinkami (na poniższym zdjęciu przejaśnienia te mają formę półksiężyców)
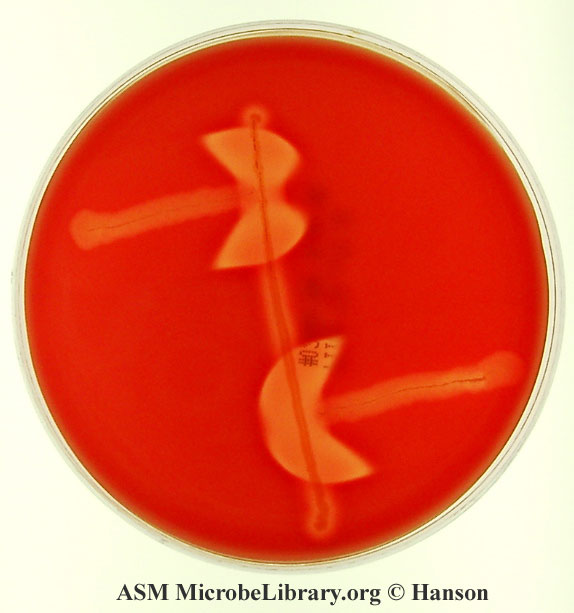
test nazywamy odwróconym, ponieważ badany drobnoustrój znajduje się tu w najdłuższej linii (na przebiegu średnicy krążka) w przeciwieństwie do testu CAMP wykrywającego S. agalactiae
Objaśnienia do powyższego krążka:
w najdłuższej linii (leżącej w średnicy krążka) znajduje się C. perfringens
w krótszych liniach, prostopadłych do średnicy znajduje się S. agalactiae
rozległe przejaśnienia w formie półksiężyców świadczą o rozległej hemolizie zachodzącej dzięki synergii między działaniem toksyn hemolitycznych C. perfringens a czynnikiem CAMP produkowanym przez GBS → wynik testu dodatni (z uwagi na przejaśnienia), więc badanym ustrojem jest C. perfringens
12
Wyszukiwarka
Podobne podstrony:
Oporność makrolidy i linkozamidy, materiały ŚUM, III rok, Mikrobiologia
CAMPtest, materiały ŚUM, III rok, Mikrobiologia
12 - ZUO, materiały ŚUM, III rok, Mikrobiologia
4 - gronkowce, materiały ŚUM, III rok, Mikrobiologia
7 - Pałeczki Gram(-), materiały ŚUM, III rok, Mikrobiologia
8 - mikroaerofilne, materiały ŚUM, III rok, Mikrobiologia
13 - zakazenia układu płciowego, materiały ŚUM, III rok, Mikrobiologia
9 - pokarmowy, materiały ŚUM, III rok, Mikrobiologia
10 - chlamydie i mykoplazmy, materiały ŚUM, III rok, Mikrobiologia
Zaliczenie z receptury-10, materiały ŚUM, III rok, Farmakologia, III rok, 7 - Receptura (TheMordor),
Zaliczenie z receptury-1, materiały ŚUM, III rok, Farmakologia, III rok, 7 - Receptura (TheMordor),
Zaliczenie z receptury-16, materiały ŚUM, III rok, Farmakologia, III rok, 7 - Receptura (TheMordor),
Zaliczenie z receptury-12, materiały ŚUM, III rok, Farmakologia, III rok, 7 - Receptura (TheMordor),
STRESZCZENIE KOSTOWSKIEGO - Parkinson, materiały ŚUM, III rok, Farmakologia, IV rok, 2 - OUN (TheMor
więcej podobnych podstron