Zagadnienia - IV zaliczenie (układ oddechowy)
Budowa płuc z uwzględnieniem pęcherzyka płucnego.
Płuca dorosłego człowieka mogą pomieścić do ok. 5 litrów powietrza. W płucach zachodzi wymiana gazowa. Zbudowane są z oskrzeli (częściowo wnikających do płuc) rozwidlających się potem na oskrzeliki, a bezpośrednio za wymianę gazową odpowiadają pęcherzyki płucne - wymieniają tlen i dwutlenek węgla z krwią. Całe płuca pokryte są opłucną - delikatną tkanką okrywającą. W organizmie człowieka występuje płuco prawe (trzypłatowe) i lewe (dwupłatowe). Związane jest to ze zdecydowaną różnicą miejsca po lewej i prawej stronie klatki piersiowej - w lewej stronie znajduje się serce, co uniemożliwia usytuowanie trzeciego płatu. Płuca są jednymi z ważniejszych organów w ciele człowieka. Dostarczają tlen hemoglobinie, która transportuje go do każdej komórki w organizmie człowieka, umożliwiając oddychanie komórkowe. Powierzchnia obu płuc człowieka, dzięki ich pęcherzykowatej budowie wynosi około 100 m².
Pęcherzyk płucny jest to struktura anatomiczna ludzkiego płuca posiadająca kształt wydrążonej jamy, której ścianę tworzy cienki nabłonek jednowarstwowy płaski. Z zewnątrz pęcherzyki są pokryte przez naczynia włosowate. Liczbę pęcherzyków w płucach człowieka szacuje się na 300-500 milionów, a ich łączna powierzchnia wynosi od 50 do 90 m². Są pokryte surfaktantem, co zabezpiecza płuca przed zapadnięciem. Dodatkowo są oplecione sprężystymi włóknami białkowymi, przede wszystkim kolagenowymi, co nadaje sprężystość tkance płucnej.
Pęcherzyki płucne przylegają do siebie w taki sposób, że sąsiadujące pęcherzyki posiadają wspólną ścianę, która nazwana jest przegrodą między pęcherzykową. Przegroda ta jest bardzo podatna na uszkodzenia i zawiera pory Kohna, które są niedużymi otworkami i łączą światła dwóch sąsiadujących pęcherzyków.
Poza komórkami tworzącymi nabłonek jednowarstwowy płaski, w pęcherzykach płucnych znajdują się dwa inne typy komórek: makrofagi (komórki żerne), a także komórki które wytwarzają surfaktant.
Wchodzące do pęcherzyka włośniczki przynoszą krew bogatą w dwutlenek węgla i wodę. W pęcherzyku tlen z powietrza zostaje wychwycony przez krwinki czerwone we włośniczkach, które jednocześnie pozbywają się dwutlenku węgla. Krew opuszczająca włośniczki pęcherzykowe jest bogata w tlen, który przenosi do wszystkich komórek ustroju. W pęcherzykach panuje ciśnienie śródpęcherzykowe.
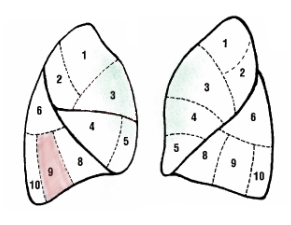
S V - segment przyśrodkowy
S VII - segment podstawny przyśrodkowy
S VIII - segment podstawny przedni
S IX - segment podstawny boczny
S X - segment podstawny tylny
S IV - segment języczkowy górny
S V - segment języczkowy dolny
S VII - segment podstawny przyśrodkowy
S VIII - segment podstawny przedni
S IX - segment podstawny boczny
S X - segment podstawny tylny
Funkcjonalny podział układu oddechowego.
jama nosowa - ogrzewanie powietrza, oczyszczanie (obecność w nosie włosów i komórek z rzęskami wychwytującymi nieczystości), nawilżanie (obecność śluzu)
gardło, krtań, tchawica, oskrzela - stanowią drogę, którą powietrze dociera do płuc. Tchawica i oskrzela mają dodatkowo chrząstkowe pierścienie, by się nie zapadać.
pęcherzyki płucne - tu zachodzi wymiana gazowa (za pomocą dyfuzji). Ich cienkie ścianki pozwalają na sprawną wymianę gazową. Są również oplecione licznymi naczyniami włosowatymi. W płucach jest bardzo dużo pęcherzyków, aby zwiększyć wydajność oddechową.
pośrednio ukł. krwionośny transportujący krew do tkanek. Ważne jest także to, że ukł oddechowy wyścielony jest przez nabłonek migawkowy.
Funkcje układu oddechowego.
stanowi dużą powierzchnię dyfuzyjną (około 100 m2), przez którą tlen może być wprowadzany do ustroju, a dwutlenek węgla - eliminowany z ustroju,
utrzymuje adekwatny gradient pomiędzy ciśnieniem parcjalnym tlenu i dwutlenku węgla w powietrzu pęcherzykowym, a prężnością tych gazów we krwi dopływającej do pęcherzyków płucnych; gradient ten jest siłą napędową dyfuzji, w wyniku której O2 jest wprowadzany do ustroju, a CO2 eliminowany z ustroju,
nawilża i ogrzewa powietrze wprowadzane do pęcherzyków płucnych, a także oczyszcza je z czynników potencjalnie szkodliwych dla organizmu,
uczestniczy w utrzymaniu równowagi kwasowo-zasadowej,
uczestniczy w reakcjach obronnych organizmu ze względu na obecność komórek fagocytujących w obrębie pęcherzyków płucnych.
Mechanizm wdechu i wydechu.
Wdech jest fazą czynną cyklu oddechowego, ponieważ pojawia się w konsekwencji skurczu mięśni wdechowych. Skurcz mięśni wdechowych doprowadza do zwiększenia trzech wymiarów klatki piersiowej (wymiaru górno-dolnego, przednio-tylnego i poprzecznego). Obniżenie przepony (zazwyczaj o ok. 1,5 cm) w wyniku jej skurczu zwiększa wymiar górno-dolny klatki piersiowej. Skurcz mięśni międzyżebrowych zewnętrznych (I-V), w wyniku odsunięcia mostka od kręgosłupa zwiększa wymiar przednio-tylny klatki piersiowej, natomiast skurcz mięśni międzyżebrowych (VI-X), zwiększa wymiar poprzeczny klatki piersiowej.
Zwiększenie wymiarów klatki piersiowej doprowadza do zwiększenia jej objętości. Z kolei zwiększenie objętości klatki piersiowej pociąga za sobą zmniejszenie ciśnienia śródopłucnowego (Ppl). Zmniejszenie ciśnienia śródopłucnowego powoduje zwiększenie objętości pęcherzyków płucnych i zmniejszenie ciśnienia w pęcherzykach płucnych (PA). Zmniejszenie ciśnienia w pęcherzykach płucnych wytwarza gradient ciśnień pomiędzy pęcherzykiem a atmosferą i w momencie, kiedy gradient ten osiąga wartość wystarczającą do pokonania oporu dróg oddechowych pojawia się ruch powietrza do pęcherzyka, tj. wdech. Napływ powietrza do pęcherzyków wywołuje zwiększenie ciśnienia w pęcherzykach. Z chwilą wyrównania ciśnienia panującego w pęcherzykach płucnych z ciśnieniem atmosferycznym napływ powietrza do pęcherzyków ustaje.
Wydech jest fazą bierną cyklu oddechowego, ponieważ pojawia się w następstwie rozkurczu mięśni wdechowych. W czasie rozkurczu mięśni wdechowych, wymiary klatki piersiowej ulegają zmniejszeniu i powracają do wartości spoczynkowych. Tym samym objętość klatki piersiowej zmniejsza się, zwiększa się ciśnienie śródopłucnowe i zwiększa się ciśnienie w pęcherzykach płucnych. Z chwilą kiedy ciśnienie w pęcherzykach płucnych przyjmie wartość wyższą niż ciśnienie atmosferyczne i gradient ciśnień stanie się wystarczający do pokonania oporu dla przepływu powietrza, pojawia się ruch powietrza z pęcherzyka do atmosfery, tj. wydech. Wypływ powietrza z pęcherzyka trwa, dopóki ciśnienie panujące w pęcherzykach płucnych zrównoważy ciśnienie atmosferyczne.
Mięśnie oddechowe - właściwe i pomocnicze.
Do mięśni wdechowych uczestniczących w spokojnym wdechu należy przepona i mięśnie międzyżebrowe zewnętrzne.
Podczas oddychania wysiłkowego we wdechu uczestniczą również mięśnie wdechowe dodatkowe, do których należą mięśnie: pochyłe szyi, mostkowo-obojczykowo-sutkowy, piersiowy mniejszy, dźwigacze łopatki, prostowniki kręgosłupa, czworoboczne i zębaty przedni.
Podczas oddychania wysiłkowego w wydechu uczestniczą oprócz mięśni międzyżebrowych wewnętrznych dodatkowe mięśnie wydechowe: ściany brzusznej, czworoboczny lędźwi, biodrowo-żebrowy i zębaty dolny.
Wymiana gazowa na poziomie płuc i tkanek.
W pęcherzykach płucnych zachodzi wymiana gazów pomiędzy powietrzem i krwią przepływającą. Dyfuzja gazów przez ścianę pęcherzyków odbywa się zgodnie z gradientem prężności cząsteczek gazów. Cząsteczki tlenu dyfundują ze światła pęcherzyków do krwi, ponieważ w powietrzu pęcherzykowym ciśnienie cząstkowe tlenu jest większe: PO2 = 100 mmHg, a we krwi dopływającej do naczyń włosowatych pęcherzyków jest mniejsze: PO2 = 40 mmHg. W przeciwnym kierunku dyfundują cząsteczki dwutlenku węgla. We krwi dopływającej do naczyń włosowatych pęcherzyków PCO2 = 46 mmHg, a w powietrzu pęcherzykowym zaś PCO2 = 40 mmHg. Cząsteczki O2 dyfundując do krwi muszą pokonać ścianę pęcherzyka płucnego i ścianę naczynia włosowatego. Ściana tej przegrody jest utworzona przez: warstwę płynu pokrywającą powierzchnię pęcherzyków, nabłonek pęcherzyków, błonę podstawną i śródbłonek naczyń włosowatych. Cząsteczki O2 po przejściu przez tę przegrodę rozpuszczają się w osoczu wypełniającym naczynia włosowate. Z osocza O2 natychmiast dyfunduje do erytrocytów.
Krew tętnicza dopływająca do wszystkich tkanek ma wyższą prężność tlenu i niższą prężność dwutlenku węgla w porównaniu z odpływającą krwią żylną. Zgodnie z gradientem prężności uwolniony z hemoglobiny tlen dyfunduje do komórek, dwutlenek węgla dyfunduje z komórek do osocza.
Cząsteczki O2 uwolnione z hemoglobiny przechodzą przez otoczkę erytrocytów do osocza, następnie przez komórki śródbłonka naczyń włosowatych do płynu międzykomórkowego i dopiero z tego płynu dyfundują przez błonę komórkową do poszczególnych komórek.
W zależności od intensywności metabolizmu wewnątrzkomórkowego występują dość znaczne różnice w prężności tlenu w poszczególnych tkankach. W tkankach o intensywnym metabolizmie prężność tlenu w komórkach jest niska i tkanki te zużywają więcej tlenu. Krew żylna odpływająca z tkanek o intensywnym metabolizmie zawiera mniej tlenu i więcej dwutlenku węgla.
Krew tętnicza dopływająca do wszystkich tkanek ma jednakową zawartość tlenu, natomiast krew żylna może zawierać więcej lub mniej O2.
Wymiana gazowa jest to proces, w czasie którego dochodzi do dyfuzji gazów i ich wymiany pomiędzy całym organizmem, a jego otoczeniem (wymiana gazowa zewnętrzna) oraz pomiędzy płynami ustrojowymi, a tkankami (wymiana gazowa wewnętrzna). W wyniku wymiany gazowej z organizmu usuwany jest dwutlenek węgla, a wprowadzany tlen.
Wymiana CO2 i O2 w pęcherzykach płucnych i tkankach odbywa się niezależnie od siebie. CO2 powstający z metabolizmu tkankowego dyfunduje do wnętrza erytrocytu w kapilarach tkanek. Tam przy udziale anhydrazy węglanowej dochodzi do syntezy H2CO3, który dysocjuje uwalniając jon H+ i HCO3-.
W środowisku o większym stężeniu jonów H+, hemoglobina utlenowana HbO2- oddaje tlen i przechodzi w hemoglobinę odtlenowaną. Uwolniony tlen wędruje do tkanek, natomiast jon HCO3- dyfunduje do osocza. Równocześnie do wnętrza erytrocytu na miejsce HCO3- przechodzą jony Cl-. Miarą buforowania CO2 jest więc zwiększenie stężenia jonów HCO3- w przestrzeni pozakomórkowej. Dzięki temu większa część CO2 jest transportowana w osoczu do płuc jako HCO3-. Część CO2 reaguje w krwinkach z grupami aminowymi tworząc karbaminiany hemoglobiny (HbNHCOO- + H+).
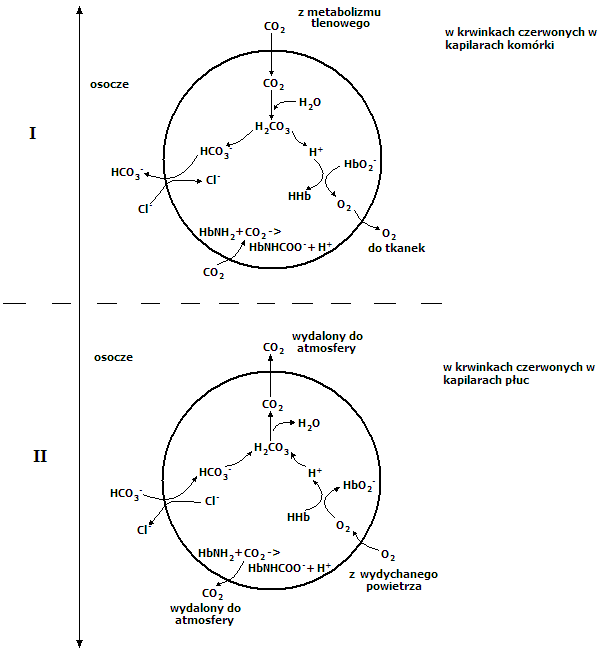
Krew odpływająca z tkanek pozbywa się nadmiaru CO2 przez krążenie płucne. Hemoglobina odtlenowana (HHb) niesiona z prądem krwi, dociera do naczyń włosowatych płuc i tam zostaje utlenowana (HBO2-). Na miejsce dyfundujących do osocza jonów Cl- przechodzą jony HCO3-. Jony H+ łączą się z HCO3- dając H2CO3, który pod wpływem anhydrazy węglanowej ulega rozpadowi na H2O i CO2. Odtwarzane w ten sposób cząsteczki CO2 zostają wydalone do atmosfery. Ponadto w płucach rozpadają się związki karbaminowe z odszczepieniem CO2 (HbNH2).
Pojemność dyfuzyjna płuc dla tlenu i dwutlenku węgla i jej zmiany w wysiłku.
Pojemność dyfuzyjna płuc (DT.) - jest miarą dyfuzyjnego przenikania gazu między pęcherzykami płucnymi, a krwią przepływającą przez naczynia włosowate płuc. Pojemność ta informuje o wielkości czynnego łożyska włośniczkowego w płucach, powierzchni wymiany gazowej i oporze stawianym przez barierę pęcherzykowo-włośniczkową dla ich dyfuzji.
Ciśnienie parcjalne O2 w powietrzu atmosferycznym wynosi 158 mmHg. W pęcherzykach płucnych wynosi około 100 mmHg. Ciśnienie tlenu w mierzonej krwi żylnej dopływającej do płuc wynosi 40 mmHg. Stąd różnica ciśnień parcjalnych poprzez błonę pęcherzykowo-kapilarną wynosi 60 mmHg, stanowiąc główną siłę napędową dyfuzji O2 przez błonę.
Pojemność dyfuzyjna dla O2 w spoczynku wynosi 21 ml/min/mmHg. Całkowita ilość tlenu w spoczynku jaka w ciągu minuty powinna przechodzić z pęcherzyków do krwi, wynosi około 250 ml. Pojemność dyfuzyjna płuc dla tlenu zmienia się z wiekiem; osiąga najwyższą wartość w 20-30 roku życia. Wysiłek fizyczny powoduje wybitny wzrost pojemności dyfuzyjnej u ludzi młodych, ale znacznie mniejszy u ludzi starszych.
Prędkość dyfuzji CO2 przez tkanki jest około 21 razy większa niż dla O2 z powodu wysokiego współczynnika rozpuszczalności tego gazu. Różnica ciśnień parcjalnych CO2 między krwią żylną dopływającą do kapilar płucnych wynosi 45 mmHg, a gazem pęcherzykowym równa się 40 mmHg i wynosi zaledwie 5 mmHg. Przyjmuje się, że w spoczynku pojemność dyfuzyjna dla CO2 jest około 21 razy większa niż O2. CO2 dyfunduje 21 razy szybciej z krwi kapilar do gazu pęcherzykowego niż tlen w przeciwnym kierunku.
Podczas wysiłku fizycznego pojemność dyfuzyjna zwiększa się ze wzrostem obciążenia aż do obciążeń bliskich maksymalnym. U niektórych ludzi może występować stabilizacja pojemności dyfuzyjnej podczas wysiłków powodujących przyspieszenie częstości skurczów serca do 120-150/min, po czym pojemność dyfuzyjna wzrasta nadal w miarę dalszego zwiększania obciążenia. Przyczyną wzrostu pojemności dyfuzyjnej podczas wysiłków fizycznych jest zwiększenie powierzchni wymiany gazów między atmosferą pęcherzyków płucnych, a krwią przepływającą przez płuca.
Proces wymiany gazów pomiędzy organizmem a otaczającym środowiskiem nazywa się oddychaniem. Istnieją trzy etapy oddychania: oddychanie zewnętrzne, transport gazów oraz oddychanie wewnętrzne.
Oddychanie zewnętrzne stanowi wymiana gazów pomiędzy:
a) powietrzem atmosferycznym a pęcherzykiem płucnym,
b) pęcherzykiem płucnym a osoczem krwi,
c) osoczem krwi a krwinkami czerwonymi.
Etap powyższy zachodzi na poziomie płuc.
Transport gazów, odbywa się na przestrzeni pomiędzy płucami a tkankami organizmu. Transporterem tlenu są krwinki czerwone (hemoglobina - barwnik). Niewielka ilość tlenu jest rozpuszczona fizycznie w osoczu. Głównym transporterem dwutlenku węgla jest osocze, część dwutlenku węgla przenoszona jest przez krwinki czerwone w powiązaniu z grupą aminową hemoglobiny.
Oddychanie wewnętrzne stanowi wymiana gazów pomiędzy środowiskiem zewnątrzkomórkowym a wnętrzem komórek oraz wykorzystanie tlenu i wytworzenie dwutlenku węgla. Etap powyższy zachodzi na poziomie tkanek.
Wentylacja minutowa płuc (VE) i jej składowe.
Wentylacja minutowa płuc (VE) - jest to objętość powietrza swobodnie pobierana i oddawana w ciągu minuty. U dorosłego człowieka w spoczynku wdychane i wydychane jest około 6 l/min powietrza . Może ona się znacznie zwiększyć w czasie wykonywania szybkich i głębokich oddechów. Na wentylacje składa się częstość oddechów (f) i objętość oddechowa (TV).
VE = MV - wentylacja minutowa
VT = TV - objętość oddechowa
f - liczba oddechów w ciągu jednej minuty
MV = 0,5 l x 12 odd/min = 6 l/min
Częstość oddechów (f) i objętość oddechowa (TV) w spoczynku i wysiłku.
Częstość oddechów (f) jest to ilość wykonywanych oddechów w ciągu jednej minuty, a objętość oddechowa (TV) jest to ilość powietrza pobierana podczas jednego wdechu. W spoczynku częstość oddechów wynosi 8-16 odd/min (średnio 12 odd/min), a objętość oddechowa wynosi około 0,5 l. Przy wzmożonym wysiłku fizycznym objętość oddechowa może wzrosnąć nawet do 3 l. Zwiększa się wówczas częstość oddechów nawet do 40-60 odd/min, ale również ilość powietrza, które przepływa przez płuca podczas każdego z oddechów.
Maksymalna wentylacja minutowa płuc (VEmax) i maksymalna wentylacja dowolna - opis i sposoby pomiaru.
Maksymalna VE osiągana podczas wysiłków waha się w zależności od rozmiarów ciała od 80-220 l/min i jest ona zawsze większa od maksymalnej dowolnej wentylacji w spoczynku.
MBC - Maksymalna wentylacja płuc -> jest to największa ilość powietrza, jaka może być wprowadzona do układu oddechowego lub z niego usunięta w ciągu minuty. Towarzyszy ona wysiłkom fizycznym bądź oddychaniu powietrzem o wzrastającym ciśnieniu cząsteczkowym dwutlenku węgla. MBC jest około 20-krotnie większa niż wentylacja minutowa w spoczynku.
MVV - maksymalna wentylacja dowolna -> jest to największa ilość powietrza, jaka może być wprowadzona do układu oddechowego lub usunięta z niego w jednostce czasu, podczas oddychania z największą częstotliwością i głębokością.
Pomiarami zajmuje się spirometria i spirografia, które oprócz badania pojemności i objętości płuc badają także przepływ (wentylację) powietrza w drogach oddechowych.
Anatomiczna i fizjologiczna przestrzeń martwa - definicje i funkcje.
Przestrzeń martwą dzielimy na anatomiczną oraz na fizjologiczną.
Przestrzeń martwa anatomiczna, to obszar, w którym nie następuje wymiana gazowa. Należą do niej jama nosowa, gardło, krtań, tchawica, oskrzela, oskrzeliki. Ich funkcją jest doprowadzanie powietrza do płuc, jego nawilżanie, ogrzanie i oczyszczenie.
Przestrzeń martwą fizjologiczną stanowi objętość powietrza pęcherzykowatego nie biorącego udziału w wymianie gazowej z krwią (niewykorzystana wentylacja).
Wentylacja przestrzeni martwej (VD).
Wentylacja przestrzeni martwej jest to ilość powietrza przepływająca przez drogi oddechowe (przestrzeń martwą) i tym samym nie ulegająca wymianie gazowej.
Wielkość wentylacji zależy od objętości oddechowej i napięcia oddechowego, które ujawnia się przez pobudzenie ośrodka oddechowego, znajdującego się w rdzeniu przedłużonym, przez wzrost PCO2 albo zmniejszenie pH krwi, lub też pobudzenie chemoreceptorów zatoki tętnicy szyjnej przez obniżenie PO2. Zadaniem wentylacji jest doprowadzenie do wymiany gazowej w obrębie pęcherzyków płucnych (wentylacja pęcherzykowa). Oprócz tego wentylacja dokonuje się też w drogach oddechowych, w których nie dochodzi do takiej wymiany (wentylacja przestrzeni martwej).
Przy spłyceniu oddechu wentylacja przestrzeni martwej nie zmieni się, zmniejszy się wentylacja pęcherzykowa, chyba że kompensacyjnie zwiększy się częstość oddechów. Ten rodzaj oddychania jest bardzo nieekonomiczny i pociąga za sobą wzrost pracy oddechowej, co wiedzie do zmęczenia mięśni i w sumie może doprowadzić do nagłego załamania wentylacji. Zarówno zaburzenie wentylacji przestrzeni martwej jak i wentylacji pęcherzykowej może doprowadzić do występowania objawów niewydolności oddechowej.
Wentylacja pęcherzykowa (VA) i stosunek wentylacji pęcherzykowej do perfuzji (VA/Q) jako warunek sprawnej wymiany gazowej.
Więcej krwi gromadzi się w naczyniach krwionośnych dolnych partii płuc niż w szczytach płuc, dlatego przepływ krwi (Q) w naczyniach dolnych partii płuc jest większy. Wentylacja pęcherzykowa (VA) to ilość powietrza docierająca do pęcherzyków płucnych w czasie 1 minuty (wynosi ok. 4 l/min). Utrzymywanie prawidłowej prężności O2 i CO2 we krwi tętniczej jest możliwe wtedy, gdy stosunek VA/Q = 0,85 (u człowieka w spoczynku VA ~ 4600 ml, Q ~ 5400 ml). W szczytowych partiach płuc stosunek VA/Q jest duży i wynosi 3,3, ponieważ tutaj wentylacja przeważa nad przepływem krwi. Nadmiar wentylacji sprawia, że część powietrza doprowadzanego do pęcherzyków w szczytach płuc w fazie wdechu nie uczestniczy w wymianie gazowej (szczytowe partie płuc stanowią pęcherzykową przestrzeń bezużyteczną). W dolnych partiach płuc stosunek VA/Q jest niewielki i wynosi 0,55.Tutaj przepływ krwi przeważa nad wentylacją. Nadmiar przepływu krwi sprawia, że część krwi przepływającej przez naczynia włosowate oplatające pęcherzyki płucne w dolnych partiach płuc nie uczestniczy w wymianie gazowej. Ta odtlenowana krew, wraz z krwią utlenowaną powraca do lewego przedsionka serca. Stanowi ona domieszkę krwi żylnej (odtlenowanej) do krwi tętniczej (utlenowanej) zawartej w lewej połowie serca - czyli fizjologiczny przeciek płucny.
Wentylacja pęcherzykowa, to ilość powietrza docierającego do pęcherzyków płucnych w czasie jednej minuty. ~ 4 l/min.
Fizjologiczny przeciek płucny.
Zarówno przepływ krwi jak i napełnienie pęcherzyków płucnych powietrzem jest znacznie większe w dolnych partiach płuc, niż w ich szczytach. W dolnych partiach płuc, płynie tak dużo krwi w stosunku do dużego napełnienia powietrzem, że część krwi nie zdąża się utlenić i jako żylna dopływa do tętniczej krwi opuszczającej płuca. Fizjologiczny przeciek płucny to minutowa pojemność serca, która pomimo przepływu przez płuca nie zdążyła się utlenić.
Spirometria - objętości i pojemności płuc.
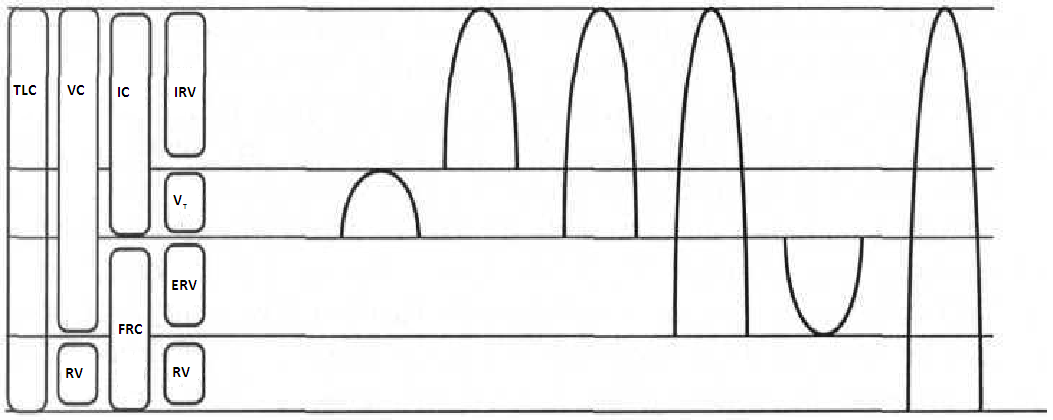
Zapis objętości i pojemności płuc nazywa się spirogramem. Objętością oddechową (V) nazywamy ilość powietrza niepodzielną, natomiast pojemność oddechową (C) stanowią co najmniej dwie objętości oddechowe.
TV /tidal volume/ - objętość oddechowa - jest to ilość powietrza wprowadzana do układu oddechowego w czasie spokojnego wdechu lub usuwana z układu oddechowego w czasie spokojnego wydechu; TV = 500 ml,
IRV /inhale residual volume/ - zapasowa objętość wdechowa - jest to ilość powietrza wprowadzana do układu oddechowego podczas maksymalnego wdechu wykonywanego z poziomu spokojnego wdechu; IRV = 3300 ml,
ERV /exhale residual volume/ - zapasowa objętość wydechowa - jest to ilość powietrza usuwana z układu oddechowego podczas maksymalnego wydechu wykonywanego z poziomu spokojnego wydechu; ERV = 1000 ml,
RV /residual volume/ - objętość zalegająca - jest to ilość powietrza pozostająca w płucach na szczycie maksymalnego wydechu; RV = 1200 ml.
IC /inspiratory capacity/ - pojemność wdechowa - jest to ilość powietrza wprowadzana do układu oddechowego podczas maksymalnego wdechu wykonywanego z poziomu spokojnego wydechu; IC = 3800 ml; IC = TV + IRV,
FRC /functional residual capacity/ - czynnościowa pojemność zalegająca - jest to ilość powietrza pozostająca w płucach na szczycie spokojnego wydechu; FRC = 2200 ml; FRC = ERV + RV,
VC /vital capacity/ - pojemność życiowa - jest to ilość powietrza wprowadzana do układu oddechowego podczas maksymalnego wdechu wykonywanego z poziomu maksymalnego wydechu bądź ilość powietrza usuwana z układu oddechowego podczas maksymalnego wydechu wykonywanego z poziomu maksymalnego wdechu; VC = 4800 ml; VC = IRV + VT + ERV bądź VC = IC + ERV,
TLC /total lungs capacity/ - całkowita pojemność płuc - jest to ilość powietrza w układzie oddechowym na szczycie maksymalnego wdechu; TLC = 6000 ml; TLC = IRV + VT + ERV + RV; TLC = IC + ERV + RV; TLC = IRV + VT + FRC; TLC = IC + FRC.
Natężona pojemność życiowa płuc (FVC) i natężona objętość wydechowa pierwszosekundowa (FEV1.0).
Natężona pojemność życiowa płuc - FVC - jest to ilość powietrza usuwana z układu oddechowego podczas maksymalnego SZYBKIEGO wydechu wykonywanego z poziomu maksymalnego wdechu.
Natężona objętość wydechowa sekundowa - FEV1.0 - jest to ilość powietrza, jaką można usunąć z układu oddechowego w ciągu pierwszej sekundy maksymalnie szybkiego, głębokiego wydechu wykonywanego z poziomu maksymalnego wdechu.
Próba Tiffeneau - Pomiar FEV1.0 i służy do oceny oporu dróg oddechowych. Natężona objętość wydechowa sekundowa jest wyrażana jako procent natężonej pojemności życiowej płuc. Prawidłowa wartość FEV1.0 stanowi 75-80% natężonej pojemności życiowej płuc.
Test Tiffeneau jest to iloraz FEV1.0 i FVC. Pozwala ocenić, czy zaburzenia obserwowane w spirometrii są wynikiem zwężenia oskrzeli (obturacji) - wówczas wynik jest niski, albo czy zaburzenia są wynikiem zmniejszenia objętości płuc - wówczas jest prawidłowy lub zwiększony. Dla potwierdzenia wyniku testu trzeba wykonać tzw. pletyzmografię.
Wskaźnik Tiffeneau (FEV1.0/Ve)*100% -> wskaźnik określający stosunek FEV1.0 do pojemności życiowej (VC) wyrażony w procentach. Obniżenie tego wskaźnika świadczy o obturacji dróg oddechowych i jest określone w trakcie spirometrii. Spadek poniżej 70% pozwala na rozpoznanie przewlekłej obturacyjnej choroby płuc. Jest też jednym ze składników pozwalających na określenie ciężkości przebiegu astmy oskrzelowej.
Zmiany spirometryczne w chorobach z ograniczeniem przepływu przez drogi oddechowe (wzrostem oporów dróg oddechowych).
Zmiany w badaniu spirometrycznym w zależności od typu zaburzeń wentylacji:
W przypadku chorób restrykcyjnych badanie spirometryczne wykazuje zmniejszenie pojemności życiowej, przy prawidłowych bądź w niewielkim stopniu obniżonych wartościach przepływów powietrza w drogach oddechowych. Wskaźnik Tiffeneau mieści się w granicach normy bądź jest podwyższony. Krzywa przepływ-objętość przybiera wąski kształt.
W przypadku chorób przebiegających z obturacją dominuje upośledzenie przepływu powietrza w drogach oddechowych wynikające ze zmniejszenia ich drożności. Wtórnie może występować zmniejszenie pojemności życiowej spowodowane hipowentylacją niektórych obszarów płuc w wyniku zwężenia światła oskrzeli związanego z procesem zapalnym lub nadreaktywnością, bądź wiotkością ścian drobnych oskrzeli zapadających się w czasie wydechu.
U chorych na astmę oskrzelową i na przewlekłe zapalenie oskrzeli dominuje oskrzelopochodny mechanizm obturacji. W badaniu spirometrycznym typowo stwierdza się ograniczenie przepływu powietrza. Pojemność życiowa zwykle mieści się w granicach normy, jednak w przypadku zwężenia dróg oddechowych dużego stopnia może dojść do jej zmniejszenia. Charakterystyczna jest poprawa drożności dróg oddechowych po inhalacji leku rozszerzającego oskrzela. W tym wypadku krzywa przepływ-objętość przybiera charakterystyczny „wklęsły” kształt.
Obturacja płucnopochodna, typowa dla „czystej” rozedmy, charakteryzuje się współwystępowaniem zmniejszenia się pojemności życiowej i ograniczenia przepływu powietrza w drogach oddechowych. Zmiany te spowodowane są zapadaniem się drobnych oskrzeli w czasie wydechu wskutek utraty właściwości sprężystych przez płuca. Krzywa przepływ-objętość wykazuje charakterystyczne załamanie.
W diagnostyce przyczyn duszności związanych z obecnością zmian zlokalizowanych w obrębie górnych dróg oddechowych przydatna jest ocena przepływu wdechowego. Dla zmian tego typu charakterystyczne jest ograniczenie przepływu wdechowego.
U chorych na przewlekłe obturacyjne choroby płuc następuje spadek poniżej 80% wartości należnej FVC oraz zmniejszenie wskaźnika Tiffeneau poniżej 70%.
- pojawia się w wyniku tarcia cząsteczek powietrza w czasie jego przepływu z atmosfery do pęcherzyków płucnych (wdech) i w przeciwnym kierunku (wydech).
- wielkość oporu determinowana jest promieniem dróg oddechowych - opór jest tym większy, im mniejszy jest promień.
- promień regulowany jest czynnie za pomocą obu gałęzi ukł. autonomicznego:
wzrost aktywności nerwu X - wzrost napięcia komórek mięśniowych w ścianie dróg oddechowych -> spadek promienia dróg oddechowych -> wzrost oporu niesprężystego.
faza wdechu -> aktywność nerwu X mała -> spadek napięcia komórek mięśniowych -> wzrost promienia -> spadek oporu
faza wydechu -> aktywność nerwu X duża -> wzrost napięcia komórek mięśniowych -> spadek promienia -> wzrost oporu.
aktywność włókien sympatycznych i ich wpływ na promień dróg oddechowych są odwrotne niż nerwu X.
- Opór sprężysty stwarzają:
siły refrakcji płuc (Pref) wywołujące tendencję ścian pęcherzyków płucnych do zapadania się
sprężystość ścian klatki piersiowej
- miarą oporu sprężystego jest podatność płuc i podatność klatki piersiowej
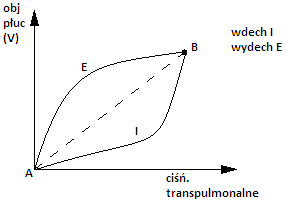
podatność płuc (C) - determinuje rozciągliwość objętościową płuc:
- jest to zmiana objętości płuc (ΔV) w następstwie zmiany ciśnienia transpulmonalnego (ΔP) o jednostkę (ciśnienie transpulmonalne to różnica między ciśnieniem pęcherzykowym płuc, a ciśnieniem w jamie opłucnej).
- podatność płuc mierzona podczas oddychania to podatność dynamiczna płuc.
- podatność płuc w fazie wdechu ma przebieg nierównomierny
~> na początku wzrost P wykorzystywany jest na pokonanie oporu niesprężystego w drogach wdechowych i przesunięcie powietrza z atmosfery w kierunku pęcherzyków.
~> następnie wzrost P wykorzystywany jest na rozciągnięcie ścian pęcherzyków płucnych.
~> w końcowej fazie zmiana objętości pęcherzyków płucnych zależy od właściwości elastycznych tkanki płucnej - im bardziej rozciągnięte ściany pęcherzyków, tym oporniej przebiega wzrost objętości pęcherzyków w miarę wzrostu P.
Z punktu widzenia wentylacji płuc lepszy jest rytm oddychania głęboki i wolny niż płytki i szybki.
- podatność płuc w fazie wydechu jest większa niż w fazie wdechu (w fazie wdechu kierunek zmian objętości pęcherzyków jest przeciwny niż kierunek sił retrakcji płuc - wdech wywołuje wzrost objętości pęcherzyków a siły retrakcji przeciwstawiają się temu).
W fazie wydechu kierunek zmian objętości pęcherzyków i kierunek sił retrakcji są zgodne spadku objętość płuc w następstwie spadku P, a więc podatność płuc … niż podczas fazy wdechu
- podatność płuc wynosi 0,23 l/cmH2O, a podatność całego układu oddechowego 0,12 l/cmH2O
FRC - czynnościowa pojemność zalegająca płuc
Wpływ różnego rytmu oddechowego na zmiany pCO2.
Ciśnienie cząstkowe dwutlenku węgla w spoczynku wynosi w pęcherzykach płucnych około 40 mmHg, a prężność dwutlenku węgla we krwi dopływającej do płuc - około 45 mmHg. Ta niewielka różnica wystarcza, aby utrzymywać wymianę CO2, ponieważ przepuszczalność błony pęcherzykowej i włośniczkowej dla tego gazu jest bardzo duża. Pojemność dyfuzyjna płuc dla CO2 jest podobna jak dla tlenu (pomimo łatwości, z jaką CO2 przechodzi z krwi do pęcherzyków), ponieważ tempo wiązania tlenu z hemoglobiną jest szybsze niż tempo uwalniania CO2 z wodorowęglanów osocza.
W czasie intensywnych wysiłków wydalane jest więcej CO2 niż go powstaje podczas utleniania substratów energetycznych w tkankach. Część CO2 wydalanego przez płuca pochodzi z wodorowęglanów osocza, z których jest on „wypierany” przez mleczan przechodzący z mięśni do krwi. Powstający w wyniku tej reakcji kwas węglowy transportowany przez krew do płuc jest następnie rozkładany przez enzym - anhydrazę węglanową na CO2 i H2O. System ten przyczynia się do zachowania równowagi kwasowo-zasadowej. Wyrazem zwiększonego wydalania CO2 (VCO2) w stosunku do pobierania tlenu (VO2) jest wzrost współczynnika oddechowego (RQ). W czasie wysiłków, podczas których zachodzą procesy beztlenowe w komórkach mięśniowych, osiąga on często wartość przewyższającą 1,0. Wysiłkowe zmiany prężności dwutlenku węgla we krwi zarówno żylnej, jak i tętniczej są niewielkie. W czasie ciężkich wysiłków (po przekroczeniu tzw. progu wentylacyjnego) prężność dwutlenku węgla we krwi tętniczej obniża się o kilka mm Hg.
Miary sprawności układu oddechowego.
To taki stan czynnościowy układu oddechowego, kiedy dostarcza on tyle O2 do krwi, ile wynosi zapotrzebowanie tkanek (w spoczynku mniej, w wysiłku więcej) oraz jest w stanie wydalić odpowiednią ilość CO2. Składa się z:
nieświadoma - kompleks oddychania, pień mózgu,
świadoma - aktywność korowa.
Perfuzja - przepływ krwi przez płuca.
Mięśnie oddechowe są zależne od naszej woli. Na motoneuronach mięśni oddechowych działają włókna dróg korowo-rdzeniowych. Zapewniają świadomą regulację, funkcji mięśni oddechowych oraz rytmu oddechowego - częstość, głębokość oddychania oraz czasu bezdechu.
Rytmiczne ruchy oddechowe zależą od struktur nerwowych w obrębie pnia mózgu - rdzenia przedłużonego i mostu. Generują one cykliczną aktywność motoneuronów zaopatrujących mięśnie wdechowe i wydechowe
wdech - aktywność motoneuronów zaopatrujących mięśnie wdechowe narasta,
wydech - ich aktywność zanika (faza bierna wydechu), następnie pojawia się i narasta aktywność motoneuronów zaopatrujących mięśnie wydechowe (faza aktywna wydechu).
Istnieją dwa typy regulacji oddychania - nerwowa i chemiczna. Każda z nich zapoczątkowywana jest pobudzeniem odmiennych typów receptorów (mechanoreceptorów bądź chemoreceptorów) i dostarcza do ośrodkowego układu nerwowego odmiennych informacji (o stanie układu oddechowego - mechanoreceptory, bądź o prężności gazów we krwi - chemoreceptory). Bez względu na sytuację (np. spoczynek bądź wysiłek fizyczny), utrzymywana jest prężność dwutlenku węgla we krwi tętniczej oraz ciśnienie parcjalne dwutlenku węgla w powietrzu pęcherzykowym. Regulacja nerwowa jest regulacją odruchową. Regulacja chemiczna jest zarówno regulacją odruchową (odruch z chemoreceptorów tętniczych), jak i regulacją wynikającą z bezpośredniego pobudzenia neuronów chemowrażliwych konwergujących na neuronach kompleksu oddechowego pnia mózgu.
Kompleks oddechowy pnia mózgu.
Neurony odpowiedzialne za generowanie rytmu oddechowego zlokalizowane w obrębie pnia mózgu, noszą nazwę kompleksu oddechowego pnia mózgu (KOPM). Neurony te są ze sobą wzajemnie powiązane połączeniami synaptycznymi. Toniczne informacje docierające do neuronów kompleksu oddechowego pnia mózgu są zamieniane na informacje rytmiczne. Z kolei te rytmiczne informacje przekazywane są przez neurony KOPM do motoneuronów zaopatrujących mięśnie zarówno wdechowe jak i wydechowe.
W obrębie kompleksu oddechowego pnia mózgu wyróżnić można dwie zasadnicze pule neuronów zlokalizowanych w różnych miejscach tego kompleksu, a mianowicie: pulę neuronów wdechowych (I), którą tworzą neurony aktywne podczas fazy wdechu, oraz pulę neuronów wydechowych (E), którą tworzą neurony aktywne podczas fazy wydechu. Neurony w obrębie każdej z pul są ze sobą wzajemnie powiązane połączeniami synaptycznymi pobudzającymi, natomiast pule neuronów są pomiędzy sobą powiązane połączeniami synaptycznymi hamującymi.
Nerwowa i chemiczna regulacja oddychania.
W obrębie układu oddechowego można wyróżnić trzy zasadnicze typy receptorów: mechanoreceptory wolno adaptujące się (SAR), mechanoreceptory szybko adaptujące się (RAR) oraz receptory okołokapilarne (J).
Mechanoreceptory SAR i RAR są to zakończenia aferentnych (dośrodkowych), zmielinizowanych włókien nerwów błędnych, receptory J - są to zakończenia aferentnych, bezmielinowych włókien nerwów błędnych. Pierwszą stacją przekaźnikową informacji zarówno z mechanoreceptorów, jak i receptorów J jest jądro pasma samotnego zlokalizowane w rdzeniu przedłużonym.
Wyróżniamy regulację nerwową i chemiczną oddychania:
Regulacja nerwowa - zapoczątkowana jest w drogach oddechowych (pobudzenie receptorów SAR i RAR), płucach (pobudzenie receptorów J) i dostarcza do ośrodkowego układu nerwowego informacje o stanie układu oddechowego. Informacje przekazywane są do kompleksu oddechowego pnia mózgu (KOPM). KOPM uruchamia mechanizmy w układzie oddechowym odpowiedzialne za regulację wentylacji płuc. Służą one utrzymaniu VA/CO = 0,85, żeby PaCO2 = PACO2 = 40 mmHg. Regulacja ta jest regulacją odruchową.
Regulacja chemiczna - zapoczątkowana jest w tętnicach (pobudzenie receptorów tętniczych), ośrodkowym układzie nerwowym (pobudzenie obszarów chemowrażliwych) i dostarcza do ośrodkowego układu nerwowego informacje o prężności tlenu (PaO2), prężności dwutlenku węgla (PaCO2) i stężeniu jonów wodorowych (pH). Informacje przekazywane są do kompleksu oddechowego pnia mózgu (KOPM). KOPM uruchamia mechanizmy w układzie krążenia, które regulują przepływ krwi przez płuca i podaż tlenu do tkanek. Służą one trzymaniu VA/CO = 0,85, żeby PaCO2 = PACO2 = 40 mmHg. Regulacja chemiczna jest regulacją odruchową i regulacją wynikającą z bezpośredniego pobudzenia neuronów chemowrażliwych.
Odruchy z mechanoreceptorów tkanki płucnej i chemoreceptorów tętniczych.
Odruch z mechanoreceptorów wolno adaptujących się (SAR)
Mechanoreceptory wolno adaptujące się zlokalizowane są w warstwie mięśniowej dróg oddechowych. Za pośrednictwem odruchu Heringa-Breuera wdech toruje wdech. Podczas wdechu, wraz ze zwiększaniem się objętości płuc, zwiększa się pobudzenie receptorów SAR, a tym samym zwiększa się hamowanie neuronów wdechowych. Zahamowanie neuronów wdechowych skutkuje pojawieniem się wydechu. Odruch Heringa-Breuera funkcjonuje na zasadzie sprzężenia zwrotnego ujemnego. Rola tego odruchu polega na ograniczaniu czasu wdechu i zapobieganiu nadmiernemu rozciągnięciu płuc i klatki piersiowej podczas wdechu. Wraz ze zmniejszaniem się objętości płuc zmniejsza się pobudzenie receptorów SAR, zmniejsza się tym samym hamowanie neuronów wdechowych. Odhamowanie neuronów wdechowych skutkuje pojawieniem się wdechu.
Odruch z mechanoreceptorów szybko adaptujących się (RAR)
Mechanoreceptory szybko adaptujące się zlokalizowane są pod błoną śluzową dróg oddechowych. Odruch z receptorów RAR działa na zasadzie sprzężenia zwrotnego dodatniego, pobudzającego wdech podczas jego trwania. Rola odruchu z receptorów RAR polega na pogłębieniu wdechu, gdy powierzchnia wymiany gazowej ulega zmniejszeniu. Pobudzenie receptorów RAR zlokalizowanych w dolnej części gardła, w krtani, tchawicy i dużych oskrzelach wywołuje odruch kaszlu (głęboki wdech i silny wydech przy zamkniętej głośni).
Odruch z receptorów okołokapilarnych (J)
Receptory okołokapilarne (J) zlokalizowane są w tkance płucnej pomiędzy pneumocytami a naczyniami włosowatymi. Bodźcem pobudzającym receptory J jest zwiększenie objętości płynu w przestrzeni zewnątrzkomórkowej pojawiające się w następstwie zwiększenia ciśnienia w tętnicy płucnej.
Odruch z receptorów J odgrywa istotną rolę podczas ciężkich wysiłków fizycznych - przekrwienie płuc towarzyszące ciężkim wysiłkom fizycznym, wywołując pobudzenie receptorów J doprowadza do osłabienia siły skurczów mięśni szkieletowych i tym samym zmniejszenia intensywności wysiłku fizycznego.
Chemoreceptory tętnicze zlokalizowane są w ścianie zatoki szyjnej (w kłębkach szyjnych) i w ścianie łuku aorty (w kłębkach aortalnych). W kłębkach szyjnych chemoreceptory są zakończeniami aferentnych włókien nerwu językowo-gardłowego (IX), w kłębkach aortalnych - zakończeniami aferentnych włókien nerwu błędnego (X).
Chemoreceptory tętnicze są pobudzane wdechowo-wydechowymi wahaniami prężności dwutlenku węgla we krwi tętniczej.
Chemoreceptory kłębków aortalnych różnią się właściwościami od chemoreceptorów kłębków szyjnych. Chemoreceptory kłębków aortalnych są znacznie bardziej wrażliwe na niedokrwienie. Pobudzane są zmniejszeniem całkowitej zawartości tlenu we krwi towarzyszącym niedokrwistości. Chemoreceptory zatokowe są wrażliwe na obniżenie prężności tlenu rozpuszczonego fizycznie we krwi tętniczej. Chemoreceptory kłębków aortalnych uczestniczą więc przede wszystkim w odruchowej regulacji krążenia i tętniczego ciśnienia krwi, chemoreceptory kłębków szyjnych - w regulacji oddychania i zaopatrzenia mózgu w tlen.
Odruch z chemoreceptorów tętniczych
Odruch z chemoreceptorów tętniczych stanowi główną drogę obrony organizmu przed niedotlenieniem. Reakcja odruchowa występująca w odpowiedzi na pobudzenie chemoreceptorów tętniczych obejmuje dwie składowe: składową oddechową i składową krążeniową.
Odruch z chemoreceptorów tętniczych w sytuacji, kiedy możliwa jest wentylacja płuc.
Przebywanie człowieka w środowisku o obniżonym ciśnieniu atmosferycznym skutkuje niedotlenieniem i pobudzeniem chemoreceptorów tętniczych. W tej sytuacji możliwa jest wentylacja płuc, pojawia się składowa oddechowa i składowa krążeniowa. Składowa oddechowa polega na pogłębieniu i przyspieszeniu oddychania. Składowa krążeniowa polega na zwiększeniu częstości rytmów serca, objętości wyrzutowej i minutowej serca oraz tętniczego ciśnienia krwi. Odruch ten służy do zwiększenia wentylacji płuc i dostosowania zwiększonego przepływu krwi w płucach. Mniejsza zawartość tlenu we krwi kompensowana jest więc zwiększonym przepływem krwi przez narządy organizmu.
Odruch z chemoreceptorów tętniczych w sytuacji, kiedy niemożliwa jest wentylacja płuc
Przebywanie człowieka pod wodą lub zamknięcie dróg oddechowych skutkuje niedotlenieniem organizmu i pobudzeniem chemoreceptorów tętniczych. W tej sytuacji niemożliwa jest wentylacja płuc. Pojawia się tylko składowa krążeniowa. Jest ona następstwem zwiększenia aktywności sympatycznej i parasympatycznej gałęzi autonomicznego układu nerwowego. Konsekwencją zwiększenia aktywności sympatycznej jest zwiększenie tętniczego ciśnienia krwi. Konsekwencją zwiększenia aktywności parasympatycznej jest zwolnienie rytmu serca. Odruch z chemoreceptorów tętniczych w sytuacji, kiedy nie jest możliwa wentylacja płuc, stwarza podstawy dla oszczędnej gospodarki tlenem zawartym we krwi.
Obszary chemowrażliwe mózgu
Działanie dwutlenku węgla na komórki pobudliwe, jest działaniem hamującym (wywołującym hiperpolaryzację). W mózgu istnieją struktury neuronalne, które reagują na dwutlenek węgla w sposób odmienny niż pozostałe komórki pobudliwe. Pod wpływem dwutlenku węgla ulegają one pobudzeniu, a nie hamowaniu. Struktury te tworzą obszary chemowrażliwe mózgu (chemoreceptory ośrodkowe). Obszary chemowrażliwe mózgu zlokalizowane są w rdzeniu przedłużonym, na jego brzusznej powierzchni. Pobudzenie tych obszarów dwutlenkiem węgla powoduje zwiększenie wentylacji płuc.
Minutowy pobór tlenu (VO2) i minutowe wydalanie dwutlenku węgla (VCO2).
VO2/min - objętość tlenu jaką organizm pochłania podczas jednej minuty. Podczas pracy nasz organizm konsumuje dużo więcej tlenu niż ma to miejsce w czasie spoczynku.
VCO2/min - objętość dwutlenku węgla, jaką organizm wydala podczas jednej minuty. Podczas pracy nasz organizm wydala więcej CO2 niż ma to miejsce w czasie spoczynku.
Dla prawidłowego przebiegu przemian komórkowych dostarczających energii konieczne jest aby:
ilość tlenu dostarczanego do organizmu pokrywała ilość tlenu zużywanego w procesach utleniania biologicznego.
dwutlenek węgla produkowany przez organizm był stale usuwany.
są wskaźnikiem funkcji układu oddechowego,
odzwierciedlają nasilenie przemian metabolicznych w ustroju,
umożliwiają oznaczenie podstawowej przemiany materii oraz kosztu energetycznego pracy,
maksymalne wielkości VO2 (VO2 max) świadczą o wydolności organizmu.
Sposób oznaczania VO2 i VCO2.
Oznaczanie VO2 oraz VCO2:
z wykorzystaniem worków Douglasa.
Do oznaczania VO2 oraz VCO2 z wykorzystaniem worków Douglasa należy oznaczyć:
wielkość wentylacji minutowej płuc (VE)
skład powietrza wdechowego - atmosferycznego (FIO2, FICO2)
skład powietrza wydechowego (FEO2, FECO2)
z wykorzystaniem ergospirometrów
Współczynnik oddechowy (RQ) - jest to stosunek objętości dwutlenku węgla do objętości pobranego tlenu (VCO2/VO2). Jego norma w organizmie wynosi RQ = 0,71 - 1,0.
Hipoksemia jest to obniżenie ciśnienia cząstkowego tlenu we krwi tętniczej, które może być spowodowane przez:
niskie ciśnienie parcjalne tlenu atmosferycznego (na przykład na dużych wysokościach);
zmniejszoną wentylację pęcherzykową w płucach;
zatruciem tlenkiem węgla;
zmniejszoną zawartość hemoglobiny w erytrocytach;
Hipoksja jest to niedobór tlenu na poziomie tkankowym powstający w wyniku dyfuzji tlenu w płucach lub zaburzenia transportu tlenu przez krew do tkanek:
hipoksyjna - spowodowana jest zmniejszoną prężnością tlenu w powietrzu oddechowym.
anemiczna - zbyt mała liczba erytrocytów do rozprowadzania tlenu w organizmie.
histotoksyczna - ilość tlenu w tkankach jest wystarczająca, ale działają czynniki toksyczne na komórki i tkanki, które zaburzają gospodarkę tlenem.
zastoinowa - spowodowana przez spowolniony przepływ krwi przez narządy.
wysokościowa - niedotlenienie tkanek podczas pobytu na znacznych wysokościach nad poziomem morza, gdzie obniżone ciśnienie atmosferyczne, a co za tym idzie obniżenie ciśnienia parcjalnego tlenu w jednostce objętości, jest znacznie niższa.
Hipokapnia i hiperkapnia.
Hipokapnia - stan obniżonego ciśnienia CO2 we krwi poniżej normy. Wywołana jest podczas hiperwentylacji przy zwiększonym wydalaniu dwutlenku węgla przez płuca. Stan taki powoduje tzw. „mroczki” przed oczami, występują zawroty głowy, szum w uszach, osłabienie mięśniowe. Hipokapnia może prowadzić do okresowego bezdechu, odruchowego niedokrwienia mózgu oraz do alkalozy.
Hiperkapnia - wzrost poziomu CO2 we krwi powyżej 45 mmHg, prowadzi do kwasicy oddechowej, początkowo pobudza oddychanie, ale nadmierne gromadzenie się CO2 prowadzi do dezorientacji, obniżenia wrażliwości sensorycznej, śpiączki, niewydolności oddechowej, a w rezultacie nawet do śmierci.
Transport gazów oddechowych.
Transport gazów oddechowych:
- ok. 3 % tlenu, który dostaje się do krwi fizycznie rozpuszcza się w osoczu,
- ok. 97 % tlenu transportowane jest w erytrocytach w połączeniu z hemoglobiną powstaje tzw. oksyhemoglobina.
transport dwutlenku węgla:
- ok. 10 % dwutlenku węgla rozpuszcza się w osoczu,
- ok. 20% dwutlenku węgla transportowane jest w połączeniu z białkami osocza i z białkową częścią hemoglobiny,
- ok.70 % dwutlenku węgla transportowane jest w osoczu w formie jonów wodorowęglanowych HCO3-, które powstają w erytrocytach z H2O i CO2.
Cząsteczka hemoglobiny składa się z czterech połączonych ze sobą łańcuchów białkowych dwa alfa i dwa beta. Każdy z łańcuchów białkowych jest cząsteczką związku organicznego zwanego hemem. W środku cząsteczki hemu znajduje się atom żelaza dwuwartościowego Fe2+, który przyłącza nietrwale jedną cząsteczkę tlenu, nie zmieniając przy tym swojej wartościowości.
Efekt Bohra, efekt Haldane'a, krzywa dysocjacji hemoglobiny i wpływ na nią H+, CO2, Temp i 2,3-DPG.
Przez efekt Bohra określa się zmniejszenie powinowactwa tlenu do Hb wraz ze spadkiem pH - dzięki temu w tkankach następuje bardziej efektywne oddawanie O2, a krzywa dysocjacji tlenowej Hb przesuwa się przez to w prawo.
Zjawisko polegające na zmniejszaniu powinowactwa hemoglobiny do tlenu w warunkach obniżonego pH (wzrost stężenia jonów wodorowych, H+). Powoduje to, że tlen jest łatwiej oddawany przez hemoglobinę (dysocjacja tlenu). Ułatwia to oddawanie tlenu w tkankach.
Efekt Haldena jest to zjawisko odwrotne do zjawiska efektu Bohra, tzn. że pod wpływem wiązania O2 zostaje zwiększone oddawanie CO2.
Podwyższenie pH zwiększa powinowactwo wiązania tlenu przez hemoglobinę i utrudnia oddawanie go w tkankach. W procesie tym bierze udział H2CO3, który pod wpływem anhydrazy węglanowej rozkłada się do jonu wodorowęglanowego oraz kationu wodoru.
Krzywa określająca zależność stopnia wysycenia hemoglobiny tlenem od ciśnienia cząstkowego tego gazu w osoczu.
Ze względu na różnicę szybkości z jaką poszczególne układy hemowe hemoglobiny reagują z tlenem, krzywa zależności stopnia dysocjacji wysycenia hemoglobiny tlenem od jego ciśnienia parcjalnego ma kształt sigmoidalny. Przebieg krzywej dysocjacji oksyhemoglobiny w kształcie litery „S” oznacza, że obniżenie prężności tlenu z 13,3 do 8,0 kPa powoduje tylko znikome zmniejszenie wysycenia krwi tlenem, natomiast środkowy, stromy odcinek krzywej dysocjacji, wskazuje na łatwe uwalnianie dużej objętości tlenu na poziomie tkanek przy niewielkich różnicach prężności tlenu we krwi i tkankach.
Powinowactwo hemoglobiny do tlenu zależne jest między innymi od kwasowości środowiska (pH), stężenia 2,3-DPG i temperatury. W granicach pH 6,0-6,5 powinowactwo hemoglobiny do tlenu jest najmniejsze. Niewielkie zakwaszenie krwi spowodowane przemieszczeniem CO2 z tkanek, zmniejsza powinowactwo Hb do O2. Zwiększenie stężenia 2,3-DPG powoduje zmianę powinowactwa hemoglobiny do tlenu, czego wyrazem jest przesunięcie krzywej dysocjacji oksyhemoglobiny w prawo. Wraz ze spadkiem temperatury krwi, przy zachowanej tej samej prężności tlenu, wzrasta wiązanie Hb z tlenem.
p50 - miara powinowactwa Hb do O2 - jest to ciśnienie parcjalne, przy którym 50% potencjalnych miejsc wiążących tlen jest nim wysycone. Norma wynosi: 26,6 mmHg.
Jest to ilość tlenu wiązana przez hemoglobinę, u człowieka wynosi przy pełnym wysyceniu hemoglobiny tlenem 20ml O2/ 100ml.