|
|
|
|
|
|
|
|
||
Opracowanie Wyników
Otrzymane wyniki przedstawiam w poniższej tabeli.
Przed przystąpieniem do miareczkowania należy sprawdzić przewodnictwo roztworu .
CH3COOH |
HCL |
CH3COOH + HCL |
Cu(NO3)2 |
||||
VNaOH [cm3] |
L [mS] |
VNaOH [cm3] |
L [mS] |
VNaOH [cm3] |
L [mS] |
VNaOH [cm3] |
L [mS] |
0 |
0,15982 |
0 |
1,7564 |
0 |
0,8658 |
0 |
0,9 |
0,2 |
0,1366 |
0,2 |
1,4527 |
0,2 |
0,7012 |
0,2 |
0,885 |
0,4 |
0,2127 |
0,4 |
1,303 |
0,4 |
0,4012 |
0,4 |
0,876 |
0,6 |
0,2741 |
0,6 |
1,0803 |
0,6 |
0,3422 |
0,6 |
0,8671 |
0,8 |
0,3517 |
0,8 |
0,885 |
0,8 |
0,4105 |
0,8 |
0,8587 |
1 |
0,4357 |
1 |
0,6439 |
1 |
0,4779 |
1 |
0,8526 |
1,2 |
0,5146 |
1,2 |
0,6894 |
1,2 |
0,5652 |
1,2 |
0,8481 |
1,4 |
0,5345 |
1,4 |
0,9528 |
1,4 |
0,6352 |
1,4 |
0,8419 |
1,6 |
0,657 |
1,6 |
1,2155 |
1,6 |
0,8657 |
1,6 |
0,906 |
1,8 |
0,7367 |
1,8 |
1,4717 |
1,8 |
1,0607 |
1,8 |
1,0861 |
2 |
0,8487 |
2 |
1,663 |
2 |
1,311 |
2 |
1,264 |
2,2 |
1,0983 |
2,2 |
1,9722 |
2,2 |
1,557 |
2,2 |
1,4411 |
2,4 |
1,3332 |
2,4 |
2,149 |
2,4 |
1,807 |
2,4 |
1,7202 |
2,6 |
1,5623 |
2,6 |
2,386 |
2,6 |
2,002 |
2,6 |
1,8971 |
2,8 |
1,7332 |
2,8 |
2,62 |
2,8 |
2,245 |
2,8 |
2,124 |
3 |
1,9475 |
3 |
2,795 |
3 |
2,426 |
3 |
2,289 |
3,2 |
2,169 |
3,2 |
2,958 |
3,2 |
2,666 |
3,2 |
2,455 |
3,4 |
2,385 |
3,4 |
3,184 |
3,4 |
2,896 |
3,4 |
2,727 |
3,6 |
2,552 |
3,6 |
3,468 |
3,6 |
3,131 |
3,6 |
2,947 |
3,8 |
2,722 |
3,8 |
3,64 |
3,8 |
3,296 |
3,8 |
3,043 |
4 |
2,932 |
4 |
3,807 |
4 |
3,471 |
4 |
3,246 |
Dane miareczkowania konduktometrycznego otrzymane dla Kwasu Octowego
y = 0,3573x + 0,0847
y = 1,0106x - 1,0895
x=1,797
PK=1,797 cm3
Dane miareczkowania konduktometrycznego otrzymane dla Kwasu solnego
y = -1,0698x + 1,7218
y = 1,1082x - 0,5499
x=1,043
PK=1,043 cm3
Dane miareczkowania konduktometrycznego otrzymane dla mieszaniny HCl i CH3COOH
y = -0,9354x + 0,8582
y = 0,3807x + 0,1034
x=0,57
PK1=0,57cm3
y = 0,3807x + 0,1034
y = 1,1057x - 0,8856
x=1,4
PK2=1,4cm3
Dane miareczkowania konduktometrycznego otrzymane Cu(NO3)2
y = -0,0146x + 0,8823
y = 0,9997x - 0,7126
x=1,572
PK=1,572 cm3
Kwas octowy CH3COOH
CH3COOH + NaOH =CH3COONa + H2O
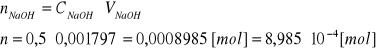
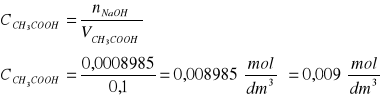
Kwas solny HCl
Reakcja przebiega następująco:
HCl + NaOH = NaCl + H2O
![]()
CH3COOH + HCl + NaOH = CH3COONa + 2 NaCl + H2O
![]()
- stężenie HCl
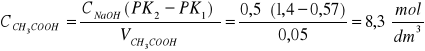
stężenie CH3COOH
Azotan (V) miedzi Cu(NO3)2
Cu(NO3)2 + 2NaOH = Cu(OH)2 + 2NaNO3
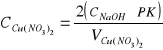
Ponieważ na miareczkowanie Cu(NO3)2 przypada 2 mole zasady sodowej.
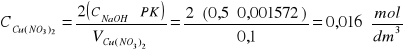
Dyskusja Wyników
Poszczególne reakcje miareczkowań.
CH3COOH + NaOH =CH3COONa + H2O
HCl + NaOH = NaCl + H2O
CH3COOH + HCl + 2 NaOH = CH3COONa + NaCl + 2H2O
Cu(NO3)2 + 2NaOH = Cu(OH)2 + 2NaNO3
Interpretacja przebiegu krzywych.
Przy miareczkowaniu słabych kwasów (pierwszy pomiar) nie zauważa się wyraźnego (można zauważyć przy odpowiedniej ilości punktów pomiarowych) początkowego spadku przewodnictwa gdyż powstaje mocny elektrolit. Słabo zdysocjowany kwas jest zastępowany przez powstającą w reakcji, całkowicie zdysocjowaną sól w wyniku czego przewodnictwo wzrasta (nieznaczny początkowy spadek przewodnictwa spowodowany jest cofaniem się dysocjacji słabego elektrolitu pod wpływem jonów pochodzących z dysocjacji soli). Pomimo tego po osiągnięciu punktu równoważnikowego, stężenie jonów OH— i ciągłe zwiększanie się sumy wszystkich jonów, powoduje powstanie załamania w punkcie zobojętnienia na krzywej miareczkowania, co można zauważyć obserwując wykres miareczkowania konduktometrycznego dla kwasu octowego.
Bardzo ruchliwe jony wodorowe są zastępowane przez mniej ruchliwe kationy sodowe Powoduje to spadek przewodnictwa. Po osiągnięciu punktu zobojętnienia, rośnie stężenie jonów hydroksylowych, które także są bardzo ruchliwe. Przewodnictwo zwiększa też jednocześnie coraz większa ilość jonów w roztworze.
Podczas miareczkowania mieszaniny mocny kwas - słaby kwas, w pierwszej kolejności zobojętniany jest kwas solny. Równowagę dla reakcji zobojętniania HCl przedstawia punkt PK1. Spadek przewodnictwa jest charakterystyczny dla miareczkowania mocnego kwasu mocna zasada. Otóż jak wspomniano wcześniej powodem spadku przewodnictwa jest zastępowanie ruchliwych jonów przez mniej ruchliwe kationy Na+. Następnie po osiągnięciu równowagi wzrasta stężenie przez utworzenie mocnego elektrolitu (zasada wraz z kwasem octowym). Trzeba zauważyć, iż po zobojętnieniu kwasu roztwór będzie się wzbogacał w mało ruchliwe Kationy Na+ oraz OH- . Jony te będą reagować z kwasem octowym.
Podczas miareczkowania azotanu (V) miedzi nie obserwuje się znaczących spadków przewodnictwa, jednak można zauważyć analizując wykres oraz otrzymane przewodnictwa, iż minimalnie spada on liniowo
Podobieństwa i różnice miareczkowania potencjometrycznego, oraz ich zalety i wady
Konduktometryczne |
Potencjometryczne |
Zastosowanie: miareczkowanie alkacymetryczne i strąceniowe |
|