EGZAMIN Z CHEMII FIZYCZNEJ 29.06.2011.
Uzupełnij wzory. (2 pkt)
ΔH![]()
![]()
+dw
![]()
Cv![]()
![]()
V![]()
Uzupełnij poniższą tabelkę w oparciu o wykres dla sprężania gazu od punktu 1.
jak zmienia się temperatura w każdym procesie? (rośnie

, maleje
, czy const)przypisz stany końcowe (A, B, C) dla poszczególnych procesów
napisz wzór na pracę w każdym z procesów korzystając z oznaczeń z wykresu
Jaka jest zależność ΔH od temperatury? ΔH ze wzrostem temperatury: (1,5 pkt)
zawsze rośnie
zawsze maleje
może maleć i rosnąć
zależy od znaku
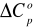
zależy w niewielkim stopniu od temperatury
zależy silnie od temperatury
Entalpia tworzenia HNO3 (c) wynosi -170 kJ. Napisz reakcję opisanego procesu.
Podaj zależność ΔU i ΔH dla reakcji z zad. 4. Napisz, jaka wielkość je łączy i podaj jej wartość.
Określ brakującą wielkość, którą można wyznaczyć z równania:
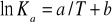
, nazwij ją oraz podaj wzór na współczynnik kierunkowy prostej.Zadanie z przemianą fazową.
Dana reakcja przebiega zgodnie z równaniem:
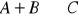
, zaś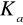
wynosi 0,5. Przypisz znak poniższych funkcji (<, >, =0) uzasadniając odpowiedzi podając odpowiednie wzory obok odpowiednich funkcji.Zaznacz prawidłową odpowiedź.
rośnie
maleje
pozostaje bez zmian
rośnie
maleje
nie zmienia się
Wykres przedstawia diagram fazowy ciecz-para dla P=const. Mieszanina składa się z 2 moli składnika A i 3 moli substancji B. (5 pkt)
Uzupełnij zdanie:
Roztwór zawiera dwie substancje, z czego jedna jest nielotna. Napisz, od czego zależy obniżenie prężności pary:
ułamka molowego składnika B (nielotnego) w cieczy
prężność pary nasyconej nad czystym składnikiem A (lotnym)
Uzupełnij zdanie:
W badaniu zjawiska osmozy wykorzystuje się zależność potencjału chemicznego od: (1 pkt)
stężenia roztworu
ciśnienia
temperatury
Podaj wartości poniższych funkcji charakteryzujących termodynamikę adsorpcji (<, >, =0)
Napisz zależność siły tarcia
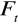
od szybkości poruszania się cząstki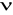
wraz z objaśnieniem symboli we wzorach dla: (2,5 pkt)cząstki kulistej: Ft = 6 π r η ν
dowolnej cząstki: F=foy
Napisz, jak się zmieni stała sedymentacji wraz ze wzrostem:
Oddziaływania dyspersyjne (Londona) zależą od:
polaryzowalności
coś tam
coś tam
coś tam
Przedstaw proces solwatacji soli M+X-.
Napisz wzór na średni jonowy współczynnik aktywności K2SO4, a także jego zależność z molalnością m.
Miareczkowanie:
Dla podanych jonów podaj wszystkie możliwe jony, które można użyć do miareczkowania:
Ogniwo bez ciekłych połączeń składa się z dwóch elektrod: miedzianej (
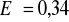
V) i chlorosrebrowej (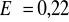
V). Napisz wzór ogniwa wiedząc, że musi on zawierać elektrolit. Podaj wartość siły elektromotorycznej tego ogniwa.Napisz schemat dla reakcji równoległej, w której substratem jest A, produktami C i D, a reakcje są pierwszorzędowe.
dla pierwszego etapu reakcji [C]/[D] = k / k'
po nieskończenie długim czasie [Crówn]/[Drówn] = K / K'
Napisz wzór na szybkość reakcji
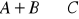
, a także równanie kinetyczne tej reakcji.Kompleks jest bardziej polarny niż substraty… (NIE PAMIĘTAM)
wzrost temperatury ………
wzrost lepkości ………
Od jakich trzech wielkości zależy szybkość reakcji według teorii kompleksu aktywnego?
stężenia kompleksu aktywnego
stężenia substratów reakcji
stała kompleksu aktywnego
Określ rząd reakcji na podstawie poniższych opisów:
szybkość reakcji rośnie proporcjonalnie do stężenia substancji 1
czas połowicznego rozpadu rośnie wraz ze wzrostem stężenia substancji 0
stężenie substancji maleje liniowo wraz z upływem czasu 0
czas połowicznego rozpadu maleje coraz szybciej ze wzrostem stężenia A 2
odwrotność stężenia substancji wrasta z przebiegiem reakcji 2
temperaturę wrzenia
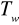
powstałej cieczyzawartość pary pozostającej w równowadze z cieczą i podaj przybliżoną wartość składu pary,
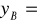
0,3temperaturę
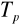
, w której występuje tylko paracieczy wrzącej - bogata w składnik B (wyżej wrzący)
destylatu - bogaty w składnik A (mniej lotny)
|
|
Stan końcowy |
T |
PRACA |
|
Izoterma |
C |
const |
|
|
Izobara |
A |
maleje |
w = -P(V2-V1) |
|
Adiabata |
B |
maleje |
w = ΔU |
![]()
![]()
Praca?
![]()
- entalpia reakcji ![]()
![]()
< 0 ![]()
![]()
> 0 ![]()
![]()
…………………………………
![]()
…………………………………
Prężność pary wraz ze wzrostem temperatury:
a temperatura wrzenia wody wraz ze wzrostem temperatury:
Ile stopni swobody ma układ w K, L, M? Napisz obliczenia.
Zredukowana liczba swobody (skrypt z laborek: str. 121 i 133): f = c - p + 1
K f = 2 - 1 + 1 = 2
L (powinno być 2)
M f = 1 - 1 + 1 = 1 (jest tylko jeden składnik B, więc c = 1)
W roztworze występują dwie substancje. Składnik, którego jest dużo spełnia prawo Raoulta wyrażone wzorem: PA=PA°xA (napisz oznaczenia symboli w podanym wzorze).
PA° - prężność pary nasyconej nad czystym składnikiem A
xA - ułamek molowy składnika A w cieczy
Ciecz w kapilarze może się podnosić lub opadać przez kąt zwilżania (podaj nazwę czynnika). Dla cieczy wznoszących czynnik ten przyjmuje wartość 0 < Θ < 90°, zaś dla cieczy obniżającym poziom wartość 90° < Θ < 180°.
![]()
< 0 ![]()
< 0 ![]()
< 0
masy rośnie temperatury rośnie
promienia cząstki rośnie lepkości maleje
![]()
![]()
![]()
![]()
Sn (II) Fe(II)/Fe(III) Ti(II)/Ti(III) -0,37V
Sn (IV) nie można utleniać Sn(II)/Sn(IV) 0,15V
Fe (II) żaden Fe(II)/Fe(III) 0,771V
Ce(III)/Ce(IV) 1,72V
SEM = 0,34 - 0,22 = 0,12 V

Podaj względną szybkość reakcji [C]/[D] opisując użyte symbole:
k, k' - szybkości reakcji AC i AD
K, K' - stałe równowagi reakcji AC i AD
![]()
![]()
1
C
B
A
V1
V2
P
V
A
B
T
Zaznacz na diagramie fazowym:
Badaną mieszaninę poddano destylacji. Podaj skład:
xB
K
L
M
Tw
Tp
0,6
Wyszukiwarka
Podobne podstrony:
Pojęcia na egzamin z metali, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
chemia fizyczna wykłady, sprawozdania, opracowane zagadnienia do egzaminu Sprawozdanie 9 chemia f
Wymagania egzaminacyjne, UMK, Chemia fizyczna
Pojęcia na egzamin z metali, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
Egzamin z fizycznej pierwszy termin 1
pytania egzamin fizyczna 11
Egzamin przykładowy chemia
Egzamin 4, Studia chemia UJ, II rok, Chemia nieorganiczna, Egzamin
Zagadnienia egzaminacyjne TUK Chemia kosmetyczna, Kosmetologia
Egzamin 5, Studia chemia UJ, II rok, Chemia nieorganiczna, Egzamin
egzamin z biologii, Chemia środków bioaktywnych (umcs), BIOLOGIA KOMÓRKI
chemia egzamin, Budownictwo, Chemia budowlana
egzamin d rozwiazania, chemia organiczna
Egzamin 2009, Chemia ogólna i nieorganiczna, giełdy
Podstawowe wiadomości i umiejętności z chemii na próbny egzamin gimnazjalny, Chemia
więcej podobnych podstron