WSTĘP TEORETYCZNY
1. PODSTAWOWE ZAŁOŻENIA TEORII KINETYCZNO-MOLEKULARNEJ DLA GAZÓW.
Podstawy teorii molekularno-kinetycznej zostały sformułowane już w Grecji. Demokryt i Leukippos (VI - V w p.n.e.) twierdzili, że wszystkie ciała składają się z maleńkich, niewidocznych cząstek, ziaren. Im zawdzięczamy ideę atomistycznej budowy materii. Podstawy współczesnej teorii molekularno-kinetycznej sformułowano w wieku ubiegłym. Jej twórcami są: J. Joule, R. Clausius, później C. Maxwell, L. Boltzmann oraz fizyk polski M. Smoluchowski.
Podstawowymi doświadczalnymi dowodami prawdziwości teorii molekularno-kinetycznej są zjawiska: dyfuzja w gazach, cieczach i ciałach stałych, ruchy Brown`a w cieczach i gazach.
Odpowiadając na pytanie, jakie są główne założenia teorii molekularno-kinetycznej moglibyśmy wymienić następujące:
- Ciało ma strukturę ziarnistą, jest zbudowane z cząstek, atomów. Liczba cząstek (atomów) składających się na ciało jest ogromna.
- Cząsteczki tworzące dane ciało wykonują bezładne ruchy zwane ruchami cieplnymi (termicznymi). Zależą one od oddziaływań wzajemnych cząstek i zmieniają się przy zmianie stanu skupienia danego ciała (inny jest charakter tego ruchu w gazach, a jeszcze inny w cieczach i ciałach stałych).
- Średnia prędkość cząstek zależy od temperatury ciała T, gdzie T jest tzw. temperaturą bezwzględną (czyli liczoną w skali bezwzględnej).
- Całkowitą energię ciała w teorii molekularno-kinetycznej możemy przedstawić jako sumę energii:
![]()
gdzie:
Ek - energia kinetyczna ciała jako całości w ruchu makroskopowym,
Ep - energia potencjalna całego ciała w pewnym zewnętrznym polu sił np.
elektrycznym, grawitacyjnym.
U - tzw. energia wewnętrzna ciała związana z cieplnym ruchem cząstek i ich
oddziaływaniem.
2. PRZEMIANY GAZOWE.PRAWA I PRACE W KAZDEJ Z PRZEMIAN
Przemiana izotermiczna (
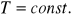
)
Prawo Boyle`a-Mariotta. Zależność między parametrami wynika z równania gazu doskonałego i nosi nazwę prawa Boyle`a-Mariotta:
![]()
czyli ![]()
Iloczyn ciśnienia i objętości gazu jest wielkością stałą.
W procesie izotermicznym gęstość gazu jest wprost proporcjonalna do ciśnienia. We współrzędnych p,V wykresem przemiany izotermicznej jest hiperbola.
![]()
![]()
gdzie ![]()
T1
T2
T3
Praca przemiany izotermicznej gazu doskonałego.
Praca![]()
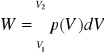
, podstawiając ![]()
mamy: ![]()
Ciepło przemiany wyznaczamy stosując I zasadę termodynamiki: ![]()
Energia wewnętrzna U gazu doskonałego podczas przemiany izotermicznej nie ulega zmianie. Gdy gaz sprężamy od ciśnienia p1 do p2, zmieniając jego objętość V1 na V2, wykonujemy pracę mechaniczną W, przekazując energię do otoczenia w postaci ciepła, za pośrednictwem sprężanego gazu (![]()
).
Przemiana izobaryczna (
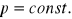
)
Prawo Gay-Lussaca. Zależność między parametrami dla stanu pierwszego i drugiego podczas przemiany izobarycznej w tym przypadku jest następująca:
![]()
lub ![]()
nosi ona nazwę prawa Gay-Lussaca.
Zależność tę można wypowiedzieć następująco: pod stałym ciśnieniem objętość określonej ilości gazu doskonałego jest wprost proporcjonalna do jego temp. bezwzględnej.
p=const. p=const. Wykresy przemiany izobarycznej
gazu doskonałego.
T1 T2 V1 V2
Praca przemiany: Zgodnie ze wzorem na pracę: 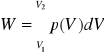
oraz uwzględniając, że ![]()
mamy
![]()
a dla gazu doskonałego: ![]()
Przemiana izochoryczna. (
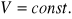
)
Prawo Charlesa: Zależność między parametrami w stanie pierwszym i drugim ma w tym przypadku postać: ![]()
lub ![]()
co oznacza, że w procesie izochorycznym ciśnienie gazu doskonałego jest wprost proporcjonalne do temperatury.
Wykres tej przemiany przedstawiono we współrzędnych V,T i T,p.
V T
izochora izochora
T p
Praca przemiany: Ponieważ ![]()
, a więc praca 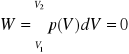
Przemiana adiabatyczna (bez przepływu energii w postaci ciepła *Q=0)
Podczas adiabatycznego rozprężania gaz wykonuje pracę przeciwko siłom zewnętrznym kosztem swej energii wewnętrznej. Przy adiabatycznym sprężaniu energia wewnętrzna gazu rośnie kosztem pracy zewnętrznej. Zatem przy adiabatycznym rozprężaniu temp. maleje, a przy adiabatycznym sprężaniu temp. rośnie.
Praca przemiany: Z I prawa termodynamiki mamy ![]()
podstawiając ![]()
otrzymujemy ![]()
, a dla gazu doskonałego ![]()
![]()
lub ![]()
![]()
p adiabata
Wykres przemiany adiabatycznej gazu doskonałego.
izoterma
V
3. CIEPŁO WŁAŚCIWE.
Podczas ogrzewania gazu mogą ulegać zmianie wszystkie jego parametry, można go również ogrzewać w stałej objętości (przemiana izochoryczna) lub pod stałym ciśnieniem (przemiana izobaryczna). W każdym z tych przypadków 1 mol gazu ogrzewając o 1K pobierze określoną ilość energii. Wiemy, że związek miedzy dQ i dT zależy od rodzaju przemiany, w szczególności w procesie adiabatycznym dQ=0 dla dT0, więc cadiab.=0 oraz w dwu typach procesów, które mają duże znaczenie w termodynamice :
izochorycznym (cv-ciepło właściwe przy stałej objętości)
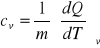
izobarycznym (cp- ciepło właściwe przy stałym ciśnieniu)
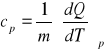
4. RÓŻNICE WARTOŚCI Cp , Cv I Cp/Cv DLA GAZÓW O RÓŻNYCH STOPNIACH SWOBODY.
Ciepło molowe w przemianie izobarycznej (cp) jest większe niż ciepło molowe w przemianie izochorycznej (cv), ponieważ przy ogrzewaniu gazu w stałej objętości całe dostarczane ciepło jest zużywane wyłącznie na podniesienie jego temperatury, natomiast w stałym ciśnieniu część dostarczanego ciepła zostaje zużyta na wykonanie pracy (przesunięcie tłoka w celu zachowania stałego ciśnienia) i tylko część na podwyższenie temp. cpcv . Dla gazu doskonałego zachodzi zależność: cp-cv=R , gdzie R- stała gazowa (R=8,31![]()
) ponieważ dla gazu doskonałego ciepła molowe wynoszą odpowiednio cp=2,5R i cv=1,5R , więc cp-cv=R
Stosunek cp/cv wykazuje ciekawe prawidłowości. Dla gazów jednoatomowych jest on równy 1,67 , dla dwuatomowych 1,4 , a dla trzyatomowych 1,4 i nosi nazwę współczynnika Poissona χ=cp/cv
Dla gazu doskonałego χ=1,67. Stosunek ten dla danego gazu decyduje o przebiegu przemiany adiabatycznej.
WYPROWADZENIE WZORU.
Przypuśćmy, że w zbiorniku zaopatrzonym w ruchomy tłok znajduje się jeden kilomol gazu. Ciepło ![]()
potrzebne do ogrzania tego gazu ![]()
przy stałym ciśnieniu wynosi: ![]()
. Korzystając z tego związku oraz ze związków ![]()
i ![]()
pierwszą zasadę termodynamiki ![]()
możemy zapisać w postaci ![]()
. Różniczkując równanie stanu gazu ![]()
dla procesu izobarycznego (![]()
), otrzymujemy ![]()
. Po podstawieniu tej zależności do poprzedniego związku mamy ![]()
stąd, po uproszczeniu przez ![]()
, dostajemy ![]()
.Według wzorów ![]()
i ![]()
molowe ciepło właściwe gazu w stałej objętości ![]()
. Zgodnie ze wzorem ![]()
molowe ciepło właściwe gazu przy stałym ciśnieniu jest zatem równe ![]()
a stosunek ![]()
wynosi ![]()
![]()
.
UKŁAD POMIAROWY.
TABELA POMIARÓW.
h1 [cm] |
h2 [cm] |
h1-h2 [cm] |
|
54,6 60,5 58,9 63 58,9 62,7 58 58,3 55 62,2 |
9,1 9,8 6,5 9,3 7,3 9,2 8,5 9,7 8,7 7,7 |
45,5 50,7 52,4 53,7 51,6 53,5 49,5 48,6 46,3 54,5 |
1,2 1,19329 1,12405 1,17318 1,14147 1,17196 1,17172 1,19959 1,18790 1,14128 |
OPRACOWANIE WYNIKÓW.
Na podstawie otrzymanych wyników obliczamy stosunek cp/cv ze wzoru: ![]()
=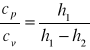
.
Np. dla pierwszego pomiaru otrzymujemy:![]()
=![]()
Wartość średnia tego stosunku dla wszystkich pomiarów wynosi: ![]()
i=![]()
Błędy pomiarowe obliczamy metodą Gaussa.
Obliczamy błędy poszczególnych pomiarów ze wzoru: ![]()
np. dla pierwszego pomiaru ![]()
![]()
Lp. |
|
|
1 2 3 4 5 6 7 8 9 10 |
1,2 1,19329 1,12405 1,17318 1,14147 1,17196 1,17172 1,19959 1,18790 1,14128 |
0,02956 0,02285 0,04639 0,00274 0,02897 0,00152 0,00128 0,02915 0,01746 0,02916 |
Obliczamy sumę kwadratów błędów poszczególnych pomiarów: ![]()
Obliczamy średni błąd kwadratowy wartości średniej: 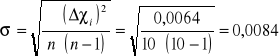
Ostateczny wynik stosunku cp/cv podajemy w postaci: ![]()
czyli ![]()
- jest to najbardziej prawdopodobny wynik serii pomiarów.
Metoda doświadczalna znajdowania .
W dużym naczyniu szklanym N o objętości kilkudziesięciu litrów zawarty jest badany gaz , znajdujący się pod ciśnieniem p niewiele wyższym od ciśnienia atmosferycznego . Gaz zamknięty jest kurkiem , który w pewnej chwili otwieramy i zamykamy ponownie z chwilą wyrównania się ciśnienia z ciśnieniem atmosferycznym . Powietrze rozpręża się , przy czym można przyjąć , że rozprężenie to zachodzi adiabatycznie .Ulega ono przy tym oziębieniu . Po pewnym czasie dzięki wymianie z otoczeniem temperatura powietrza pozostałego w naczyniu zrówna się z temp. otoczenia i wskutek ogrzania, ciśnienie gazu podniesie się . Wytworzy się więc nadwyżka ciśnienia , tym razem mniejsza od nadwyżki początkowej.
Niech początkowa nadwyżka równa się p1 . Wypuszczenie gazu na zewnątrz odpowiada rozprężeniu o V , rozprężeniu temu odpowiada spadek ciśnienia ![]()
Przypuśćmy , że po wyrównaniu się temperatur nadwyżka ciśnienia wynosi p2 . W porównaniu z ciśnieniem początkowym nastąpił spadek o ![]()
, ale ten sam spadek otrzymaliśmy rozprężając gaz izotermicznie o tę samą V zatem: ![]()
. Ze wzoru na adiabatę: ![]()
Z izotermy ![]()
. Porównując stronami otrzymujemy: 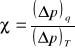
. Ponieważ w obu przypadkach mamy te same wartości p i V to: ![]()
UWAGI I SPOSTRZERZENIA.
Błąd w głównej mierze spowodowany jest mylnymi odczytami wysokości słupa wody oraz nieszczelnością układu pomiarowego ( w założeniu przemiana adiabatyczna zachodzi bez wymiany ciepła z otoczeniem ).
Niepewność odczytu wynika ze skończonej wartości grubości podziałki na przyrządzie pomiarowym (miara krawiecka) oraz z przyciągania międzycząsteczkowego , które powstaje na powierzchni cieczy(menisk) . Niemożliwe więc było jednoznaczne ( w każdym z 10 pomiarów ) określenie wysokości słupa wody, co spowodowało powstanie błędów w przeprowadzonych pomiarach.
Porównanie otrzymanego wyniku z wartością tablicową.
Cząstki jednoatomowe mają trzy stopnie swobody , odpowiadające trzem wzajemnie prostopadłym translacjom x, y, z , a więc dla gazów jednoatomowych : = 5/3 = 1,67
Cząstki dwuatomowe mogą ponadto wykonywać obroty wokół dwóch wzajemnie prostopadłych osi . Czyli mają 6 stopni swobody ( 3 translacje , 2 rotacyjne i 1 oscylacyjny ) . A zatem dla gazów dwuatomowych przy założeniu . że cząstki nie wykonują oscylacji : = 7/5 = 1,4
Założenie powyższe jest uzasadnione , ponieważ w temperaturach pokojowych ruchy oscylacyjne dla większości lekkich cząstek dwuatomowych są całkowicie "zamrożone" . Uruchomienie oscylacji w wyższych temperaturach powoduje obniżenie wartości , natomiast zamrożenie ruchów rotacyjnych cząstki występującej w niższych temperaturach prowadzi do wzrostu wartości
Ponieważ powietrze z większości składa się z tlenu i azotu można przyjąć że wartość dla powietrza wynosi 1,4 . Natomiast dla powietrza wyznaczone doświadczalnie wynosi : 1,1704440,0084.
W rzeczywistości otrzymana doświadczalnie wartość jest różna od przewidywań teoretycznych . Wynika to z wielu uproszczeń występujących w tej klasycznej teorii kinetyczno - molekularnej. Jak wiadomo teoria ta nie uwzględnia rotacyjnych stopni swobody atomów w cząsteczce . Nie uwzględnia także elektronowych i jądrowych stopni swobody w atomie . Wpływ może mieć także fakt, że powietrze oprócz azotu i tlenu składa się dodatkowo z 1% innych gazów .
p
V
V
V
T
p
Wyszukiwarka
Podobne podstrony:
Fizyka Uzupełniająca Gaz doskonały
gaz doskonaly, Akademia Morska Szczecin, SEMESTR II, Fizyka, sciaga fiza
Gaz doskonaly, Transport i Logistyka (AM) 1 (semestr I), Fizyka, fiza laborki (rozwiązania), Laborki
OGNIWA (2), Sprawozdania - Fizyka
Ćwiczenie nr 50b, sprawozdania, Fizyka - Labolatoria, Ćwiczenie nr50b
Mech- Badanie zależności współczynnika lepkości cieczy od te, Sprawozdania - Fizyka
Doświadczalne spr p. Malusa, sprawozdania, Fizyka - Labolatoria, Ćwiczenie nr70
Sprawozdanie Fizyka ćwiczenie 4(M04)
ćw13 sprawozdania fizyka 3, Sprawozdanie
3 W LEPKO CIECZY, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, labor
Pomiar promieni krzywizny soczewki płasko - wypukłej, Sprawozdania - Fizyka
Ćwiczenie nr 82, sprawozdania, Fizyka - Labolatoria, Ćwiczenie nr82
PUZON, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki, Laborki s
Moment Bezwładności, Sprawozdania - Fizyka
Wyznaczanie momentu bezwładności brył za pomocą drgań skrę(1 (2), Sprawozdania - Fizyka
Ćwiczenie nr 65c, sprawozdania, Fizyka - Labolatoria, Ćwiczenie nr65c
test metale tabela, Studia, Ogólne, Fiyzka, od romka, fizyka, sprawozdania fizyka
więcej podobnych podstron