Akademia Górniczo-Hutnicza
Im. Stanisława Staszica
Wydział Wiertnictwa, Nafty i Gazu
Laboratorium z Geofizyki poszukiwawczej i wiertniczej
Badanie potencjałów dyfuzyjno-adsorpcyjnych skał
Pupa Andrzej
Sadłos Mariusz
rok III, zespół 3
10.X.2005r.
WSTĘP TEORETYCZNY
Potencjały pola polaryzacji naturalnej powstają na skutek procesów dyfuzyjno-adsorpcyjnych np. w odwiercie wypełnionym płuczką lub wodą wokoło otworu, zachodzących na granicach warstw, nasyconych wodami o różnej mineralizacji, oraz na kontakcie płuczki i skały, której pory są wypełnione wodą o innej mineralizacji niż mineralizacja płuczki.
POTENCJAŁ DYFUZYJNY - różnica potencjałów na granicy zetknięcia 2 roztworów różniących się stężeniem lub składem, spowodowana różną ruchliwością anionów i kationów dyfundujących z roztworu o większym stężeniu (większej aktywności) jonów do roztworu o mniejszym stężeniu (mniejszej aktywności) jonów; potencjał dyfuzyjny wnosi swój udział do potencjału elektrody; w najprostszych przypadkach potencjał dyfuzyjny można obliczyć (i zmierzyć), zwykle jednak dąży się do jego wyeliminowania lub utrzymania go na poziomie stałym w pracującym ogniwie galwanicznym.
Schemat aparatury do pomiaru potencjałów dyfuzyjno-adsorpcynych.
Przy bezpośrednim kontakcie dwóch roztworów, różniących się tylko stężeniem soli, powstający potencjał dyfuzyjno-adsorpcyjny Eda określa równanie Nernsta:
![]()
gdzie:
R - uniwersalna stała gazowa (8,314 J/K);
F - stała Faraday'a (96540 C);
T - temperatura absolutna;
nk , na - ilość kationów i anionów, na które dysocjuje cząsteczka;
zk , za - wartościowości kationu i anionu;
u, υ - ruchliwość kationu i anionu;
c1, c2 - stężenie soli w roztworach.
lub w postaci uproszczonej:
![]()
gdzie:
c1, c2, ς1, ς2 - odpowiednie stężenia i oporności właściwe dwóch graniczących przez przegrodę - skałę elektrolitów,
Kda - współczynnik dyfuzyjno-adsorpcyjny, wskazujący wpływ jono-adsorpcyjnych możliwości skały skał różniących się chemicznym składem i strukturą.
Graniczna wartość potencjału dyfuzyjno-adsorpcyjnego Eda i jego współczynnika Kda, odpowiadająca przegrodzie idealnej (ruchliwość jednego znaku jest równa zero), równa się:
![]()
![]()
Dla roztworów jednowartościowych, np. roztworu NaCl, współczynnik potencjału dyfuzyjno-adsorpcyjnego przy temperaturze 20ºC wynosi:
![]()
Współczynnik potencjału dyfuzyjnego pokazuje, jak siła elektromotoryczna dyfuzji na granicy dwóch roztworów zależy od ich składu chemicznego, wartościowości jonów i temperatury. Współczynnik potencjału dyfuzyjno-adsorpcyjnego uwzględnia jeszcze wpływ adsorpcyjnych własności skały, które wyznacza jej skład chemiczno-mineralogiczny i struktura.
Gdy ogniwo zawiera jeden roztwór, to potencjał dyfuzyjny jest równy zeru, a siła elektromotoryczna jest sumą kolejnych potencjałów międzyfazowych. Potencjał dyfuzyjny wystąpi tylko wtedy, gdy liczby przenoszenia jonów stykających się elektrolitów będą różne. Istnieją elektrolity, dla których liczby przenoszenia jonów są takie same: KCl, Na4NO3, KNO3. Dla tych substancji potencjał dyfuzyjny jest równy zeru.
Jeśli po dwu stronach przegrody przepuszczalnej dla jonów wytworzyć różnicę stężeń tych jonów, to na skutek dyfuzji będą one przechodziły z przedziału o stężeniu wyższym do przedziału o stężeniu niższym. Przepływ jonów pomiędzy przedziałami można zatrzymać wytwarzając pomiędzy nimi odpowiednią różnicę potencjałów. Pole elektryczne będzie powodowało ruch jonów (migrację) w stronę przeciwną do kierunku ich ruchu związanego z dyfuzją. W ten sposób może dojść do równowagi pomiędzy strumieniem dyfuzyjnym i migracyjnym. Tym samym całkowity strumień przez przegrodę będzie równy zero i stężenia jonów w obu przedziałach przestaną się zmieniać. Wartość różnicy potencjałów przy której dochodzi do takiej równowagi nazywamy potencjałem równowagi (Nernsta).
Rozważmy sytuację, gdy w roztworze znajdują się dwa rodzaje jonów (np. Na+ i Cl-) zaś przegroda jest selektywna, to znaczy przepuszcza tylko jeden rodzaj jonów (np. Na+). Wówczas dyfuzyjne przechodzenie tych jonów z jednego przedziału do drugiego powoduje, że pomiędzy przedziałami wytwarza się różnica potencjałów elektrycznych. W układzie takim transport jonów będzie zachodził zatem do chwili, gdy rosnąca różnica potencjałów nie osiągnie wartości potencjału równowagi dla tych jonów. Wartość potencjału równowagi zależy rzecz jasna od wartości stężeń przenikających jonów w obu przedziałach (oznaczonych jako c1 i c2).
Potencjał czynnościowy komórek - przykład.
Niektóre z komórek, oprócz utrzymywania potencjału spoczynkowego są zdolne dodatkowo do szybkiej i krótkotrwałej zmiany potencjału błonowego - zwane komórkami pobudliwymi. Komórki nie posiadające tej zdolności nazywamy niepobudliwymi. Chwilową, impulsową zmianę potencjału błony komórkowej będziemy nazywali potencjałem czynnościowym. Potencjał czynnościowy powstaje w komórce pobudliwej, gdy potencjał jej błony przekroczy pewną graniczną wartość nazywaną progiem pobudzenia. Wielkość bodźca pobudzającego ma znaczenie jedynie dla powstania pojedynczego potencjału czynnościowego - nie ma ona natomiast wpływu na jego przebieg. Zmiany potencjału błonowego podczas trwania potencjału czynnościowego w przykładowej komórce nerwowej przedstawione są na rysunku poniżej. Jak widać "klasyczny" potencjał czynnościowy składa się z kilku faz:
1. gwałtownego wzrostu potencjału błonowego (depolaryzacji),
2. nieco powolniejszego spadku potencjału błony (repolaryzacji),
3. okresu, gdy potencjał błony jest niższy od potencjału spoczynkowego (hiperpolaryzacji).
Z rozważań dotyczących potencjału spoczynkowego wynika, że aby doszło do zmiany potencjału błonowego to musi przez błonę popłynąć niezrównoważony prąd jonowy. Biorąc pod uwagę przedstawiony powyżej przebieg zmian potencjału błony jest jasne, że kszałtujące go prądy jonowe muszą zmieniać się w czasie.
Aktywność dyfuzyjno-adsorpcyjna stanowi różnicę między wartościami potencjałów dyfuzyjno-adsorpcyjnych i potencjałów dyfuzyjnych:
![]()
skąd
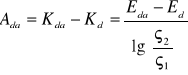
Dyfuzyjno-adsorpcyjna aktywność skał zależy od struktury i wilgotności (nasycenia) skał. Na przykład aktywność skał piaskowcowo-ilastych rośnie przy: zmniejszaniu efektywnej średnicy ziarn skały, wzroście ich elektrochemicznej adsorpcyjnej powierzchni, wzroście stosunku powierzchni właściwej skał do ich wilgotności, zmniejszeniu wilgotności skał z jednakowym składem medium nasycającego skałę.
Dla jednej i tej samej skały nasyconej różnymi kationami obserwuje się zmniejszenie aktywności dyfuzyjno-adsorpcyjnej w następującej kolejności:
Li+ - Na+ - Mg++ - Ca++ - Ba++
Warunkiem powstania potencjału dyfuzyjno-adsorpcyjnego są różnice stężenia soli znajdujących się po obu stronach przegrody. Wielkość potencjału dyfuzyjno-adsorpcyjnego (membranowego) zależy od:
różnicy koncentracji roztworów po obu stronach przegrody,
rodzaju soli,
rodzaju skały, które się wykorzystuje przy pomiarach w charakterze przegrody.
OPIS PRZEBIEGU POMIARÓW
W celu przeprowadzenia badania potencjałów dyfuzyjno-adsorpcyjnych przygotowuje się dwa 1-litrowe roztwory soli o różnych stężeniach. Roztwory równocześnie wlewamy do komór wanienki. Następnie do roztworów wstawiamy elektrody i przystępujemy do rejestrowania potencjału mierzonego przez woltomierz cyfrowy. Przez pierwsze 10 minut rejestrację prowadzi się co 15 sekund, przez następne 10 minut co 30 sekund i końcowe odczyty dokonujemy co 1 minutę.
Stężenia otrzymanych roztworów:
C1 =1 [g/l], C2=4[g/l] - roztwory NaCl
Oszacowanie potencjału międzyelektrodowego:
Po wytworzeniu dwóch roztworów o różnych stężeniach oszacowaliśmy potencjał międzyelektrodowy Ume, którego wartość jest równa wartości pierwszego odczytu po wlaniu obu roztworów i zamocowaniu elektrod wcześniej przepłukanych wodą destylowaną.
Ume= -7,52[mV]
Lp. |
Czas [min] |
Uda [mV] |
Lp. |
Czas [min] |
Uda [mV] |
Lp. |
Czas [min] |
Uda [mV] |
Lp. |
Czas [min] |
Uda [mV] |
Lp. |
Czas [min] |
Uda [mV] |
1 |
0,25 |
-7,52 |
21 |
0,25 |
-32,5 |
41 |
0,5 |
-34,34 |
61 |
1 |
-30 |
81 |
1 |
-17,56 |
2 |
0,25 |
-16,41 |
22 |
0,25 |
-32,75 |
42 |
0,5 |
-34,28 |
62 |
1 |
-29,45 |
82 |
1 |
-17,32 |
3 |
0,25 |
-19,98 |
23 |
0,25 |
-32,98 |
43 |
0,5 |
-34,18 |
63 |
1 |
-28,9 |
83 |
1 |
-16,7 |
4 |
0,25 |
-21,55 |
24 |
0,25 |
-33,32 |
44 |
0,5 |
-33,92 |
64 |
1 |
-28,34 |
84 |
1 |
-16,14 |
5 |
0,25 |
-23,28 |
25 |
0,25 |
-33,4 |
45 |
0,5 |
-33,9 |
65 |
1 |
-27,74 |
85 |
1 |
-15,58 |
6 |
0,25 |
-24,46 |
26 |
0,25 |
-33,52 |
46 |
0,5 |
-33,78 |
66 |
1 |
-27,16 |
86 |
1 |
-15,02 |
7 |
0,25 |
-25,45 |
27 |
0,25 |
-33,6 |
47 |
0,5 |
-33,6 |
67 |
1 |
-26,56 |
87 |
1 |
-14,44 |
8 |
0,25 |
-26,4 |
28 |
0,25 |
-33,64 |
48 |
0,5 |
-33,42 |
68 |
1 |
-25,96 |
88 |
1 |
-13,88 |
9 |
0,25 |
-27,31 |
29 |
0,25 |
-33,74 |
49 |
0,5 |
-33,25 |
69 |
1 |
-25,36 |
89 |
1 |
-13,32 |
10 |
0,25 |
-28,14 |
30 |
0,25 |
-33,82 |
50 |
0,5 |
-33,05 |
70 |
1 |
-24,76 |
90 |
1 |
-12,68 |
11 |
0,25 |
-28,9 |
31 |
0,25 |
-33,92 |
51 |
0,5 |
-32,86 |
71 |
1 |
-24,16 |
91 |
1 |
-12,1 |
12 |
0,25 |
-29,5 |
32 |
0,25 |
-33,98 |
52 |
0,5 |
-32,58 |
72 |
1 |
-23,56 |
92 |
1 |
-11,52 |
13 |
0,25 |
-30 |
33 |
0,25 |
-34,26 |
53 |
0,5 |
-32,36 |
73 |
1 |
-22,92 |
93 |
1 |
-11 |
14 |
0,25 |
-30,46 |
34 |
0,25 |
-34,36 |
54 |
0,5 |
-32,1 |
74 |
1 |
-22,32 |
94 |
1 |
-10,52 |
15 |
0,25 |
-30,96 |
35 |
0,25 |
-34,4 |
55 |
0,5 |
-31,82 |
75 |
1 |
-21,72 |
95 |
1 |
-10,02 |
16 |
0,25 |
-31,64 |
36 |
0,25 |
-34,42 |
56 |
0,5 |
-31,58 |
76 |
1 |
-21,12 |
96 |
1 |
-9,54 |
17 |
0,25 |
-31,75 |
37 |
0,25 |
-34,4 |
57 |
0,5 |
-31,3 |
77 |
1 |
-20,48 |
97 |
1 |
-8,64 |
18 |
0,25 |
-31,68 |
38 |
0,25 |
-34,4 |
58 |
0,5 |
-31,02 |
78 |
1 |
-19,8 |
98 |
1 |
-8,26 |
19 |
0,25 |
-31,94 |
39 |
0,25 |
-34,42 |
59 |
0,5 |
-30,77 |
79 |
1 |
-19,14 |
99 |
1 |
-7,9 |
20 |
0,25 |
-32,28 |
40 |
0,25 |
-34,42 |
60 |
0,5 |
-30,5 |
80 |
1 |
-18,52 |
100 |
1 |
-7,54 |
Tabela wyników:
OBLICZENIA
Wyliczenie eksperymentalnej wartości potencjału dyfuzyjno-adsorbcyjnego dla ostatniego odczytu po uwzględnieniu potencjałów międzyelektrodowych:
Eda = Uda - Ume = -7,54 + 7,52= -0,02 [mV]
![]()
Obliczenie teoretycznej wartości potencjału, dla przyjętego Kda = -58 [mV]
![]()
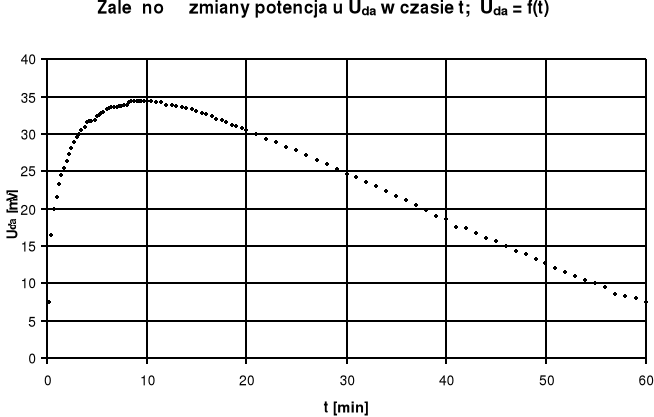
Obliczenie prędkości przyrostu potencjału dyfuzyjno-adsorpcyjnego na podstawie danych odczytanych z wykresu:
dla potencjału rosnącego:
Uda = 9 [mV]
Δt= 4 [min]
![]()
dla potencjału malejącego:
ΔUda = 11,48 [mV]
Δt = 20 [min]
![]()
wsk - wskazania przyrządu cyfrowego;
kl = 0,05 - klasa przyrządu.
WNIOSKI I UWAGI KOŃCOWE
Wykreślona przez nas krzywa ma kształt zbliżony do paraboli. Lewa część wykresu jest bardziej stroma, następnie wygina się wypukłością ku górze i następuje łagodny spadek. Na podstawie uzyskanego wykresu wnioskujemy, że przez pierwsze 8 minut uzyskana wartość Uda szybko rośnie w granicach 2,25 mV/min. Jest to spowodowane tym, że po włożeniu elektrod do obu roztworów następuje szybki przepływ jonów Cl‾ z roztworu o większym stężeniu do roztworu o niższym stężeniu. Krzywa uzyskuje wartość maksymalną 34,42 mV po czasie 9,5 min. Po tym czasie krzywa zaczyna opadać z prędkością 0,57 mV/min co świadczy o tym, że przepływ jonów trwa nadal, ale odbywa się coraz to wolniej. Wnioskujemy stąd, że stężenia zaczynają się wyrównywać. Po tym czasie powinna nastąpić całkowita stabilizacja. Jednak niedokładność sprzętu i zbyt krótki czas na przeprowadzenie ćwiczenia spowodowały, że stężenia nie zdążyły się wyrównać i nie udało się uzyskać całkowitej stabilizacji na wykresie. Uzyskane przez nas wyniki potencjału Uda zamieszczone w tabelce mają znak minus, spowodowane jest to tym, że włożyliśmy odwrotnie elektrody tzn. do roztworu soli o większym stężeniu (nadmiar anionów) umieściliśmy anodę, zaś do roztworu o mniejszym stężeniu - katodę. Pomyłka ta nie ma wpływu na przebieg ćwiczenia i uzyskane przez nas wyniki pomiarów.
Potencjały w obu naczyniach po prawie godzinie nie ustabilizowały się, nadal wartość potencjału spada - w dalszym stopniu trwa dyfuzja, lecz można zauważyć zmniejszenie prędkości opadania krzywej w ostatnich minutach pomiaru. Wyniki odczytów miernika cyfrowego (miliwoltomierza) obarczone są nieznacznym błędem systematycznym wynoszącym ±0,027mV.
BIBLIOGRAFIA:
St. Plewa „Geofizyka Wiertnicza”;
St. Rychlicki, K. Twardowski, J. Traple, J. Krochmal „Wybrane materiały do ćwiczeń laboratoryjnych z inżynierii złożowej i geofizyki wiertniczej” - skrypt uczelniany;
http://www.biofiz.am.wroc.pl/bfstr61.html
![]()
![]()
![]()
Wyszukiwarka
Podobne podstrony:
Geofiz, AGH WGGIOŚ, Semestr 3, Metody Badań Geofizycznych
Testy-przyklady, AGH WGGIOŚ, Semestr 3, Metody Badań Geofizycznych
GEOFIZYKA2, AGH WGGIOŚ, Semestr 3, Metody Badań Geofizycznych
EKWIWALENCJA, AGH WGGIOŚ, Semestr 3, Metody Badań Geofizycznych
Projekt III rok, AGH WGGIOŚ, Semestr 3, Metody Badań Geofizycznych
GEOFIZYKA1-egzamin, AGH WGGIOŚ, Semestr 3, Metody Badań Geofizycznych
OTWOROWA OPRACOWANIE 2011, AGH WGGIOŚ, Semestr 3, Metody Badań Geofizycznych
geofiza, AGH WGGIOŚ, Semestr 3, Metody Badań Geofizycznych
Pomiar stałej dielektrycznej skał 4, AGH WGGIOŚ, Semestr 3, Metody Badań Geofizycznych
geofizyka otworowa, AGH WGGIOŚ, Semestr 3, Metody Badań Geofizycznych
Geofiz, AGH WGGIOŚ, Semestr 3, Metody Badań Geofizycznych
geofizyka, AGH GiG WGGiOŚ (I stopień), Metody Badań Geofizycznych
irek sprawko od anety, AGH WIMIIP Metalurgia, semestr 2, metody badań materiałów
Geofizyka otworowa - wykłady w wordzie, AGH Wggioś górnictwo i geologia - materiały, Geofizyka
pytania z metod, Geologia, UNIWERSYTET WARSZAWSKI, SEMESTR I, METODY BADAŃ MINERAŁÓW I SKAŁ, Metody
test JJ geofizyka 2006, Metody badań geofizycznych
METODY BADAŃ SPOŁECZNYCH - ćwiczenia 2 (Chodarcewicz), Prywatne, Socjologia, Semestr 3, Metody Badań
więcej podobnych podstron