Wstęp:
Równowaga chemiczna reakcji zachodzącej w roztworze jest wrażliwa na zmianę rozpuszczalnika. Wpływ rozpuszczalnika na równowagę chemiczną pokazano na rysunku.
Jak widać wpływ rozpuszczalnika na stałą równowagi reakcji Ksolv, wynika z różnic solwatacji substratów i produktów reakcji. Dla dowolnego rozpuszczalnika stała równowagi reakcji zależy od różnicy swobodnych entalpii Gibbsa produktu GB i substratu GA:
(Go)solv=(GA)solv - (GA)solv = -RTln(K)solv
stąd stosunek stałych równowagi reakcji w dwóch rozpuszczalnikach dany jest zależnością :
RTln(K2/K1)= -Go2 + -Go1= Gotrans(B,1→2) - Gotrans(A,1→2)
W której Gotrans(B,1→2) oraz Gotrans(A,1→2) są swobodnym entalpiami Gibbsa przeniesienia produktów i substratów z rozpuszczalnika 1 do 2. Wartości Gotrans określają różnicę solwatcji reagenta w obu rozpuszczalnikach.
2. Wykonane ćwiczenia:
Przygotowałem dwa roztwory rozpuszczalników o stosunku objętościowym 1:4 i 1:8.
W kolbkach miarowych o pojemności 25 cm3 przygotowałem dwie serie roztworów kwasu octowego w obu rozpuszczalnikach. Stężenia podane są w tabeli 1.
Po termostatowaniu przez 15 min, wykonałem pomiary przewodnictwa Gc dla każdego z roztworów. Wyniki umieściłem w tabeli 1.
3. Obliczenia:
- Obliczanie przewodnictwa molowego dla każdego ze stężeń, np.:
![]()
[S]
- Obliczenie przewodnictwa granicznego kwasu octowego w rozpuszczalnikach:
= 0,88307+5,8377.Xm - 15,9185.Xm2 + 14,318.Xm3 + 4,573.Xm4
Dla rozpuszczalnika o stosunku objętościowym MeOH:H2O 1:4 ułamek molowy wynosi:
20 cm3 MeOH + 80 cm3 H2O
ρ MeOH = 0,793 g/cm3; MMeOH= 34 g/mol
nMeOH = 20.0,793 / 34 = 0,4956 mol
nH2O = 80.1/18 = 4,4444 mol
XMeOH = 0,4956 / (4,4444+0,4956) = 0,1
Dla rozpuszczalnika o stosunku objętościowym MeOH:H2O 1:8 ułamek molowy wynosi:
XMeOH = 0,0528
Lepkości dla odpowiednich roztworów wynoszą:
1:4 =1,3225 cP
1:8 =1,1490 cP
Korzystając z zależności Waldena, otrzymałem graniczne przewodnictwa dla obydwu roztworów:
1:4 = ()wody . wody / 1:4 = 263,81 [S]
1:8 = ()wody . wody / 1:8 = 303,64 [S]
- Obliczam stopień dysocjacji kwasu octowego dla każdego ze stężeń:
sol = (c)sol / ()sol = 24,303/263,81 = 0,0921
- Obliczam stałą dysocjacji Ksol dla każdego stężenia:
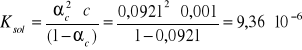
Wszystkie pozostałe wyniki obliczeń są zamieszczone w tabeli 1.
Tabela 1:
Rozpuszczalnik |
Stężenie CH3COOH [mol/dm3] |
Gc[S] |
(c)sol [Scm2/mol] |
sol |
|
1:4 |
0,0010 |
0,0000496 |
24,3040 |
0,0921 |
0,00000935 |
|
0,0025 |
0,0000769 |
15,0724 |
0,0571 |
0,00000866 |
|
0,0050 |
0,0001150 |
11,2700 |
0,0427 |
0,00000953 |
|
0,0075 |
0,0001480 |
9,6693 |
0,0367 |
0,00001046 |
|
0,0100 |
0,0001720 |
8,4280 |
0,0319 |
0,00001054 |
1:8 |
0,0010 |
0,0000637 |
31,2130 |
0,1183 |
0,00001588 |
|
0,0025 |
0,0001053 |
20,6388 |
0,0782 |
0,00001660 |
|
0,0050 |
0,0001580 |
15,4840 |
0,0587 |
0,00001830 |
|
0,0075 |
0,0001990 |
13,0013 |
0,0493 |
0,00001916 |
|
0,0100 |
0,0002310 |
11,3190 |
0,0429 |
0,00001923 |
Sumaryczne stałe dysocjacji kwasu octowego dla roztworów 1:4 i 1:8 wynoszą:
K1:4 = 0,000009708 = 9,7*10-6
K1:8 = 0,000017834 = 1,78*10-5
Dla wody natomiast:
Kwoda = 1,754 10-5
Ułamki molowe wody w roztworach MeOH:H2O wynoszą odpowiednio:
dla 1:4 XH2O = 0,9
dla 1:8 XH2O = 0,9472
Po odczytaniu z wykresu =f(XH2O) stałych dielektrycznych mam:
dla 1:4 = 79,02
dla 1:8 = 79,55
dla czystej wody 80,08
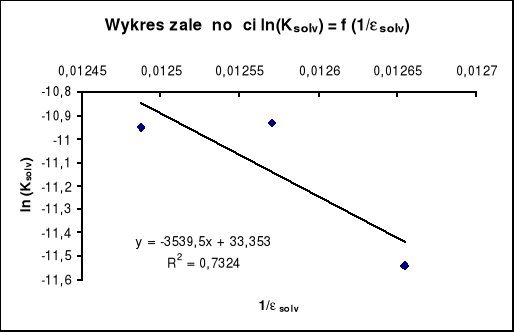
Wnioski:
Wykres zależności ln(K)solv = f(1/solv) odbiega od wartości rzeczywistych ponieważ stała dysocjacji dla roztworów MeOH wyznaczona przeze mnie ma wartość większą od stałej dysocjacji dla czystej wody.
Widać jednak iż ze wzrostem stężenia metanolu w roztworze stała dysocjacji maleje.
Wynika to z faktu hamowania dysocjacji w roztworze metanol woda.
Wyszukiwarka
Podobne podstrony:
Do druku octowy, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz
mmgg, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II sprawka
spr57, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy
Moje 50 , Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spr
monia 11, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spr
15 wyznaczanie ciepła spalania, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, Chem
KOND41vmac, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II s
rad, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II sprawka
spr15, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy
Do druku askorbinowy, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczn
Elektroda szklana, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna c
Podczas wymuszonego przep+éywu p+éynu, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wsz
27 poprawa 2, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, Chemia fizyczna
POLSKI, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spraw
spr26, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy
lab50as, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spra
więcej podobnych podstron