Inżynieria Materiałowa 2001/2002
Grupa II
Nr zespołu - 7
Nr ćwiczenia - 16/17
Tytuł ćwiczenia:
„16. Potencjały równowagowe elektrod - siła elektromotoryczna ogniw.
17. Polaryzacja”
I16. Wstęp teoretyczny.
Metal zanurzony w roztworze elektrolitu nazywa się elektrodą. Na powierzchni fazowej ustala się równowaga między znajdującymi się w roztworze jonami oraz elektronami fazy stałej. Reakcję taką można zapisać ogólnym równaniem:
Substancja zredukowana 
substancja utleniona + elektrony
Cechą takiej reakcji jest wymiana ładunku elektrycznego miedzy elektrodą a roztworem. Ustalenie się równowagi w takim układzie jest więc związane z powstaniem różnicy potencjałów między elektrodą a roztworem.
Zależność potencjału równowagowego od aktywności odpowiednich jonów, temperatury i ilości elektronów biorących udział w procesie elektrodowym, w przypadku gdy reakcją potencjałotwórczą jest równowaga między czystym metalem a jego jonami w roztworze, opisuje zależność:
![]()
II16. Cel ćwiczenia
Pomiar potencjału elektrod:
1. Zn/0,1m ZnSO4
2. Cu/0,1m CuSO4
Wyznaczenie zależności potencjału tych elektrod od stężenia ich jonów roztworze siarczanu sodowego.
IV16. Wyniki badań:
Stężenie jonów badanego metalu [mol/l] |
Log c |
Zn/ZnSO4 Elektroda kalomelowa |
Cu/CuSO4 Elektroda kalomelowa |
||
|
|
SEM ogniwa [mV] |
Potencjał Zn wzgl. El. Wodorowej [mV] |
SEM ogniwa [mV] |
Potencjał Cu wzgl. El. Normalnej [mV] |
1,000 |
0 |
-1037 |
-795,5 |
57,2 |
298,7 |
0,500 |
-0,30 |
-1046 |
-804,5 |
45,5 |
287 |
0,250 |
-0,60 |
-1058 |
-816,5 |
32,2 |
273,7 |
0,125 |
-0,90 |
-1073 |
-831,5 |
20,3 |
261,8 |
0,067 |
-1,17 |
-1089 |
-847,5 |
11 |
252,5 |
V16. Obliczenia
Dla Zn (ZnSO4) SEM = E+ - ![]()
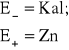
![]()
kalomelowej obliczam względem wodorowej przy temperaturze 25 C i KCl nasyconego ze wzoru:
![]()
![]()
Dla Cu (CuSO4) SEM = E+ - ![]()
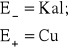
![]()
kalomelowej obliczam względem wodorowej przy temperaturze 25 C i KCl nasyconego ze wzoru:
![]()
![]()
VI17. Wnioski.
Jak widać z wykresów obydwa spełniają zależność liniową co potwierdza stosowalność wzoru na potencjał metalu ![]()
.Z wykresu można również wywnioskować, że wraz ze spadkiem stężenia roztworu spada również potencjał danego metalu, który znajduje się w tym roztworze.
I17. Wstęp teoretyczny.
Różnicę między potencjałem elektrody a równowagowym nazywamy polaryzacją lub nadnapięciem. Polaryzacja jest tym większa im większa jest gęstość prądu. Przyczyną jej powstawania jest powolny przebieg jednego ze stadiów pośrednich procesu elektrodowego. Można wyróżnić trzy stadia:
- dopływ elektronów do powierzchni fazowej;
- dopływ jonów do powierzchni fazowej;
- reakcja jonów z elektronami.
II17. Cel ćwiczenia
Wyznaczenie przebiegu krzywych polaryzacji anodowej i katodowej elektrody Cu/0,5m CuSO4 i Cu/0,05m CuSO4.
Określenie wpływu mieszania i stężenia na polaryzację katodową i anodową tych elektrod.
IV17. Wyniki badań:
![]()
Cu/0,05m CuSO4/Cu nie mieszany ![]()
Natężenie prądu polaryzującego I [mA] |
Gęstość prądu polaryzującego |
Logarytm prądu polaryzującego |
Różnica pot. el. badanej i odnieś. |
Pot. el. badanej przel. wzgl. wodor. |
||||
|
|
|
K log ik |
A log ia |
K Ek [mV] |
A Ea [mV] |
K Ek [mV] |
A Ea [mV] |
0 |
0 |
0 |
0 |
0 |
19 |
22 |
260.5 |
263.5 |
2 |
6,34 |
6,57 |
0,80 |
0,81 |
-12 |
24 |
229.5 |
265.5 |
5 |
15,87 |
16,47 |
1,20 |
1,21 |
-51 |
48 |
190.5 |
289.5 |
10 |
31,74 |
32,89 |
1,50 |
1,51 |
-92 |
58 |
149.5 |
299.5 |
15 |
47,61 |
49,34 |
1,67 |
1,69 |
-105 |
65 |
136.5 |
306.5 |
25 |
79,3 |
82,23 |
1,89 |
1,91 |
-740 |
72 |
-498.5 |
313.5 |
50 |
158,73 |
164,47 |
2,20 |
2,21 |
-780 |
88 |
-538.5 |
329.5 |
75 |
238,1 |
246,71 |
2,37 |
2,39 |
-780 |
100 |
-538.5 |
341.5 |
100 |
317,46 |
328,95 |
2,50 |
2,51 |
-780 |
110 |
-538.5 |
351.5 |
![]()
Cu/0,05m CuSO4/Cu mieszany ![]()
Natężenie prądu polaryzującego I [mA] |
Gęstość prądu polaryzującego |
Logarytm prądu polaryzującego |
Różnica pot. el. badanej i odnieś. |
Pot. el. badanej przel. wzgl. wodor. |
||||
|
|
|
K log ik |
A log ia |
K Ek [mV] |
A Ea [mV] |
K Ek [mV] |
A Ea [mV] |
0 |
0 |
0 |
0 |
0 |
26 |
23 |
267.5 |
264.5 |
2 |
6,34 |
6,57 |
0,80 |
0,81 |
24 |
24 |
265.5 |
265.5 |
10 |
31,74 |
32,85 |
1,50 |
1,51 |
18 |
38 |
259.5 |
279.5 |
15 |
63,49 |
65,78 |
1,80 |
1,81 |
6 |
55 |
247.5 |
296.5 |
25 |
95,23 |
98,68 |
1,97 |
1,99 |
-30 |
66 |
211.5 |
307.5 |
50 |
158,73 |
164,47 |
2,20 |
2,21 |
-57 |
165 |
184.5 |
406.5 |
75 |
317,46 |
328,95 |
2,50 |
2,51 |
-340 |
170 |
-98.5 |
411.5 |
100 |
476,19 |
493,42 |
2,67 |
2,69 |
-380 |
240 |
-138.5 |
481.5 |
![]()
Cu/0, 5m CuSO4/Cu nie mieszany ![]()
Natężenie prądu polaryzującego I [mA] |
Gęstość prądu polaryzującego |
Logarytm prądu polaryzującego |
Różnica pot. el. badanej i odnieś. |
Pot. el. badanej przel. wzgl. wodor. |
||||
|
|
|
K log ik |
A log ia |
K Ek [mV] |
A Ea [mV] |
K Ek [mV] |
A Ea [mV] |
0 |
0 |
0 |
0 |
0 |
58 |
58 |
299.5 |
299.5 |
2 |
6,34 |
6,57 |
0,80 |
0,81 |
34 |
78 |
275.5 |
319.5 |
10 |
31,74 |
32,89 |
1,50 |
1,51 |
22 |
87 |
263.5 |
328.5 |
15 |
47,61 |
49,34 |
1,67 |
1,69 |
14 |
88 |
255.5 |
329.5 |
25 |
79,3 |
82,23 |
1,89 |
1,91 |
-6 |
94 |
235.5 |
335.5 |
50 |
158,73 |
164,47 |
2,20 |
2,21 |
-10 |
105 |
225.5 |
346.5 |
75 |
238,1 |
246,71 |
2,37 |
2,39 |
-50 |
110 |
191.5 |
351.5 |
100 |
317,46 |
328,95 |
2,50 |
2,51 |
-70 |
115 |
171.5 |
356.5 |
![]()
Cu/0, 5m CuSO4/Cu mieszany ![]()
Natężenie prądu polaryzującego I [mA] |
Gęstość prądu polaryzującego |
Logarytm prądu polaryzującego |
Różnica pot. el. badanej i odnieś. |
Pot. el. badanej przel. wzgl. wodor. |
||||
|
|
|
K log ik |
A log ia |
K Ek [mV] |
A Ea [mV] |
K Ek [mV] |
A Ea [mV] |
0 |
0 |
0 |
0 |
0 |
57 |
58 |
298.5 |
299.5 |
2 |
6,34 |
6,57 |
0,80 |
0,81 |
50 |
64 |
291.5 |
305.5 |
10 |
31,74 |
32,89 |
1,50 |
1,51 |
37 |
71 |
278.5 |
312.5 |
15 |
47,61 |
49,34 |
1,67 |
1,69 |
31 |
74 |
272.5 |
315.5 |
25 |
79,3 |
82,23 |
1,89 |
1,91 |
21 |
80 |
262.5 |
321.5 |
50 |
158,73 |
164,47 |
2,20 |
2,21 |
-8 |
90 |
233.5 |
331.5 |
75 |
238,1 |
246,71 |
2,37 |
2,39 |
-32 |
98 |
209.5 |
339.5 |
100 |
317,46 |
328,95 |
2,50 |
2,51 |
-48 |
103 |
193.5 |
344.5 |
V17. Obliczenia
Przykładowe obliczenia:
Dla I= 2A
![]()
![]()
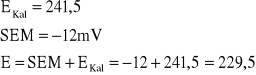
Pozostałe obliczenia zarówno dla katody jak i dla anody są analogiczne.
VI17. Wnioski.
Jak widać z wykresów krzywych polaryzacji stężenie oraz mieszanie roztworu ma wpływ na polaryzację.
2
Wyszukiwarka
Podobne podstrony:
Potencjały równowagowe elektrod - siła elektromotoryczna ogniw polaryzacja, Chemia fizyczna AGH lab
CHEMIA 12, Chemia fizyczna AGH laborki, lab 12
SPRAWOZ4, Chemia fizyczna AGH laborki, lab 12
napiecie pow nr 2, Chemia fizyczna AGH laborki, lab 2
LABORKA UKASZ 3, Chemia fizyczna AGH laborki, lab 3,4
CHEMIA 12, Chemia fizyczna AGH laborki, lab 12
korozja dla justyny, Chemia fizyczna AGH laborki, lab 21
Wyniki pomiarów ciepła rozpuszczania, Chemia fizyczna AGH laborki, lab 3,4
SPRAWOZ6, Chemia fizyczna AGH laborki, lab 18
Chemia fizyczna (3, Chemia fizyczna AGH laborki, lab 3,4
lab. 05 - baron, Chemia fizyczna AGH laborki, lab 5
Wykresy do 3, Chemia fizyczna AGH laborki, lab 3,4
tekst 7, Chemia fizyczna AGH laborki, lab 6
Chem 1, Chemia fizyczna AGH laborki, lab 1
skoootaaa, Chemia fizyczna AGH laborki, lab 20
lepkość, Chemia fizyczna AGH laborki, lab 1
więcej podobnych podstron