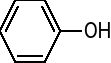
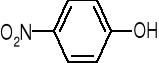
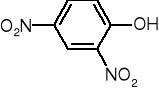
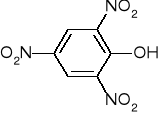
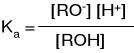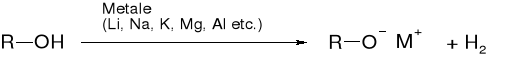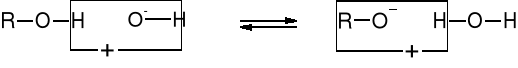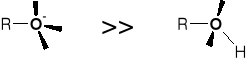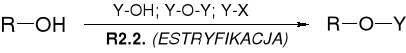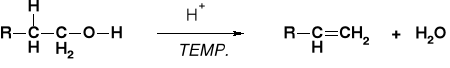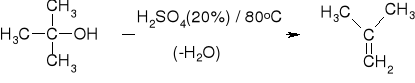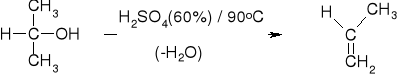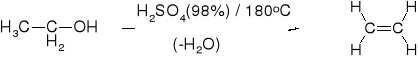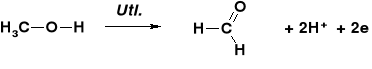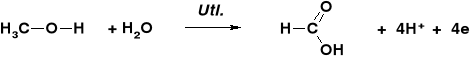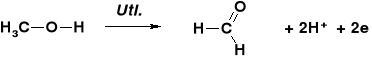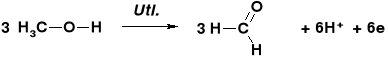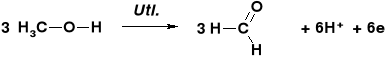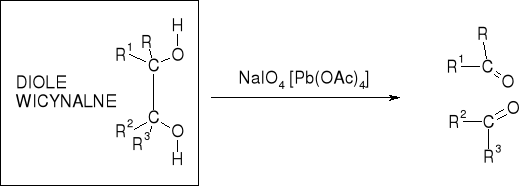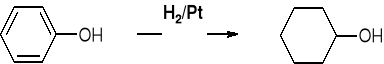ALKOHOLE BUDOWA I WŁAŚCIWOŚCI FIZYKO-CHEMICZNE |
|||||
|
|
||||
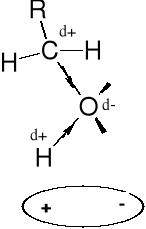
MOMENT DIPOLOWY |
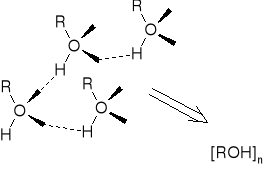
ASOCJACJA |
||||
|
|||||
WPŁYW ASOCJACJI NA TEMPERATURĘ WRZENIA ALKOHOLI |
|||||
ZWIĄZEK |
Mol [g] |
T. WRZ. [oC] |
ZWIĄZEK |
Mol [g] |
T. WRZ. [oC] |
H-O-H |
18 |
100 |
CH4 |
16 |
-162 |
CH3-O-H |
32 |
63 |
CH3-O-CH3 |
46 |
-24 |
CH3(CH2)3-OH |
78 |
118 |
CH3(CH2)3-CH3 |
72 |
36 |
|
|
|
C2H5-O-C2H5 |
76 |
36 |
HO-CH2CH2-OH |
62 |
197 |
|
|
|
|
94
|
182 |
|
92 |
111 |
|
|||||
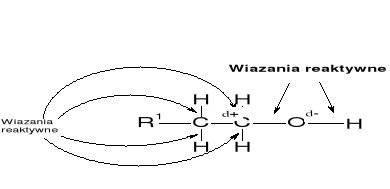
ALKOHOLE |
|
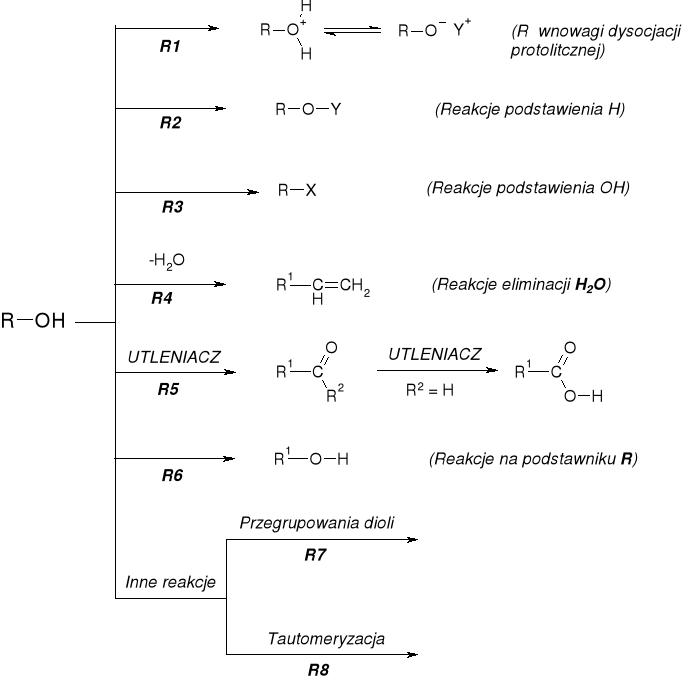
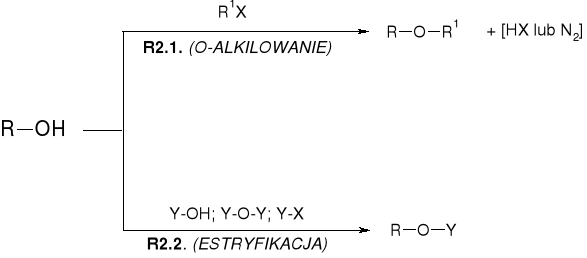
REAKCJE ALKOHOLI |
|
|
REAKCJE ALKOHOLI |
||||
|
||||
R1. RÓWNOWAGI PROTOLITYCZNE ALKOHOLI (WŁAŚCIWOŚCI KWASOWO-ZASADOWE) |
||||
|
||||
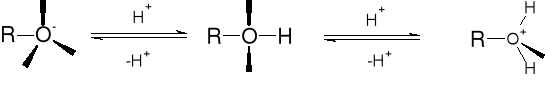
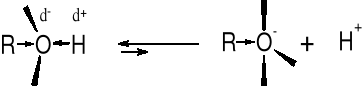
R1.1. DYSOCJACJA PROTOLITYCZNA ALKOHOLI (WŁAŚCIWOŚCI KWASOWE) |
||||
|
||||
|
|
|||
|
||||
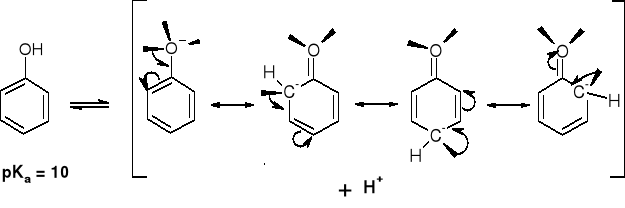
R-O-H |
pKa |
R-O-H |
pKa |
|
H-O-H |
15.7 (pKw=14) |
|
|
|
CH3-O-H |
16 |
CH3CH2-O-H |
17 |
|
(CH3)2CH-O-H |
18 |
(CH3)3C-O-H |
19 |
|
|
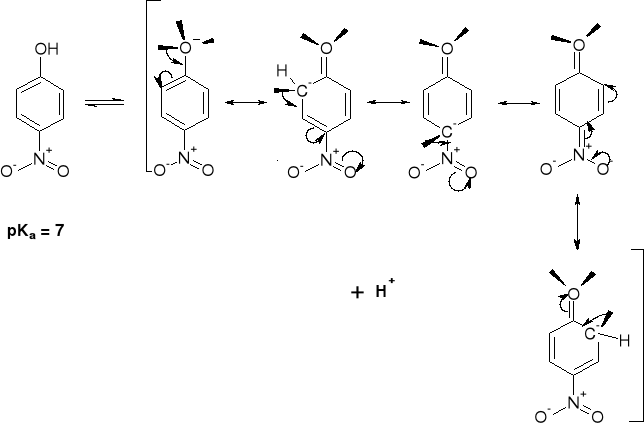
10 |
|
7 |
|
|
4 |
|
0.4 |
|
|
|
|
|
|
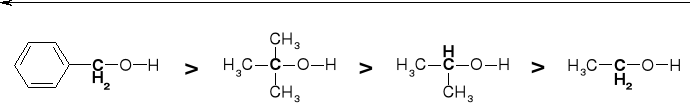
WPŁYW STRUKTURY ALKOHOLI NA pKa |
|||
|
|
|
|
|
pKa |
|
|
19 |
18 |
17 |
10 |
|
|||
|
|||
|
|||
|
|||
|
|||
R1.2. WŁAŚCIWOŚCI KWASOWE ALKOHOLI |
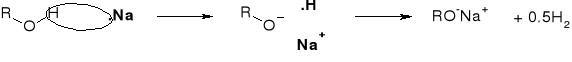
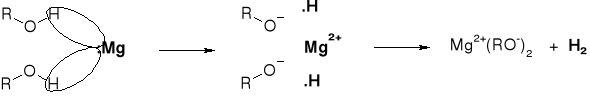
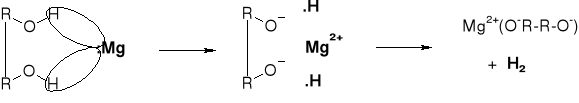
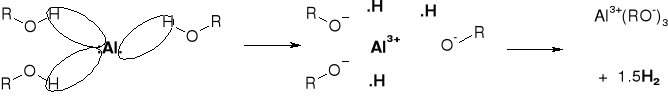
R1.2.1. REAKCJE ALKOHOLI Z METALAMI |
|
|
|
|
|
|
|
|
|
R1.2.2. REAKCJE ALKOHOLI Z WODOROTLENKAMI |
|
|
R1./R2. WŁAŚCIWOŚCI ZASADOWE I NUKLEOFILOWE ALKOHOLI |
R1. WŁAŚCIWOŚCI ZASADOWE ALKOHOLI |
|
|
R2. WŁAŚCIWOŚCI NUKLEOFILOWE ALKOHOLI |
|
|
|
|
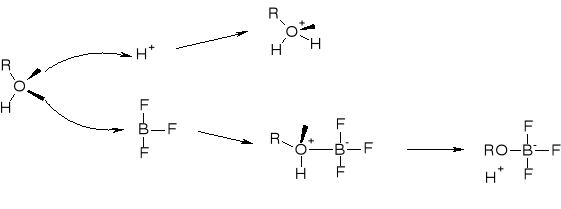
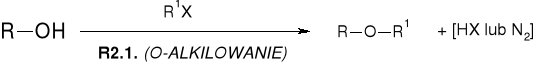
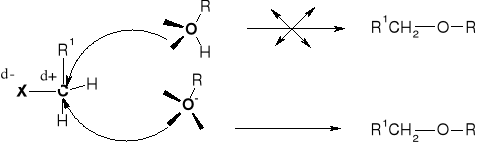
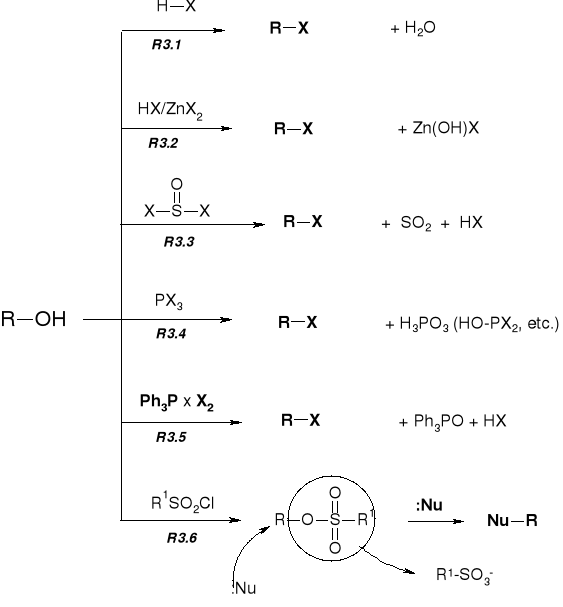
R2.1.1. REAKCJE ALKOHOLI Z HALOGENKAMI ALKILU |
|
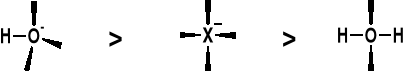
NUKLEOFILOWOŚĆ:
|
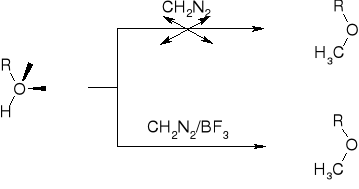
R2.1.2. REAKCJE ALKOHOLI Z DIAZOMETNAEM (DIAZOLKANAMI) |
|
|
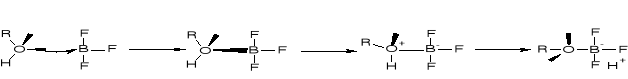
WZROST NUKLEOFILOWOŚCI GRUPY R-O PO UTWORZENIU KOMPLEKSU ROH×BF3 |
|
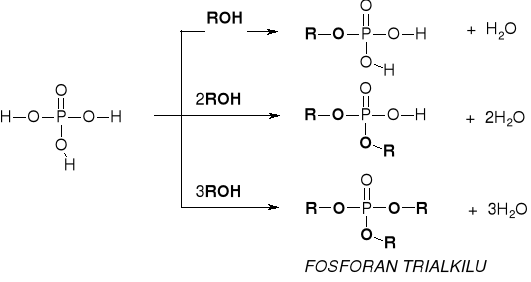
R2.2.1. REAKCJE ALKOHOLI Z OKSY-KWASAMI NIEORGANICZNYMI |
|
|
|
|
REAKCJA ESTRYFIKACJA ALKOHOLI |
|
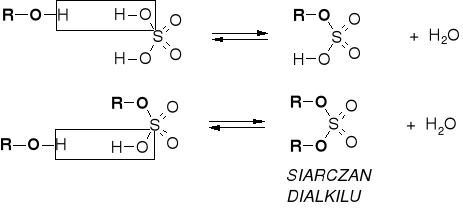
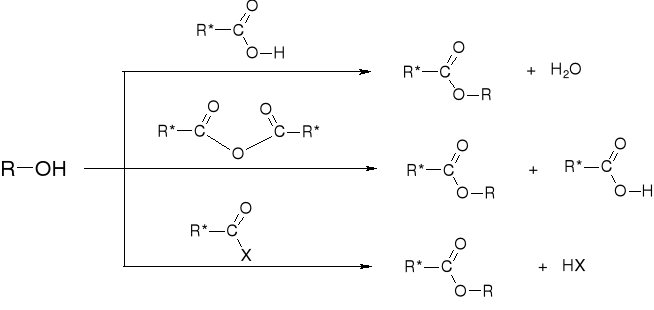
R2.2.2. REAKCJE ALKOHOLI Z KWASAMI ORGANICZNYMI |
|
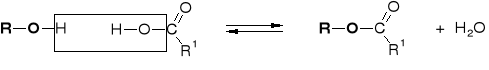
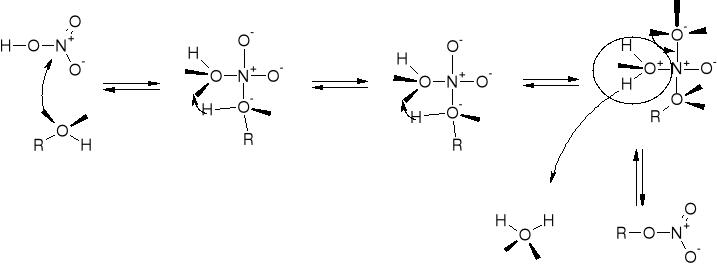
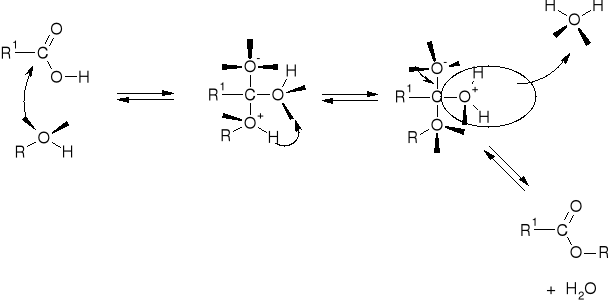
R2.2.3. MECHANIZMY ESTRYFIKACJI |
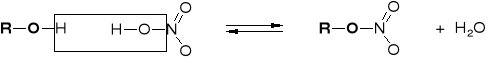
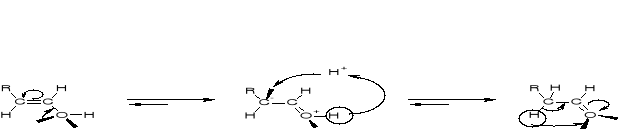
R2.2.3.1. MECHANIZM ESTRYFIKACJI KWASU NIEORGANICZNEGO |
|
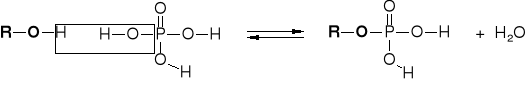
R2.2.3.2. MECHANIZM ESTRYFIKACJI KWASU ORGANICZNEGO |
|
|
|
|
|
|
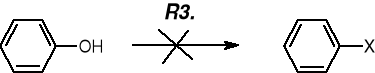
FENOLE NIE ULEGAJĄ REAKCJOM PODSTAWIENIA GRUPY OH NA HALOGENEK
|
|
|
NUKLEOFILOWOŚĆ: |
|
|
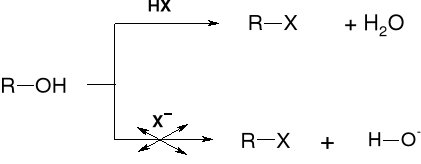
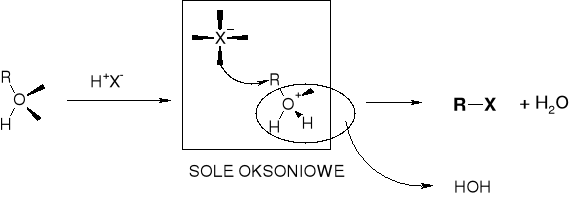
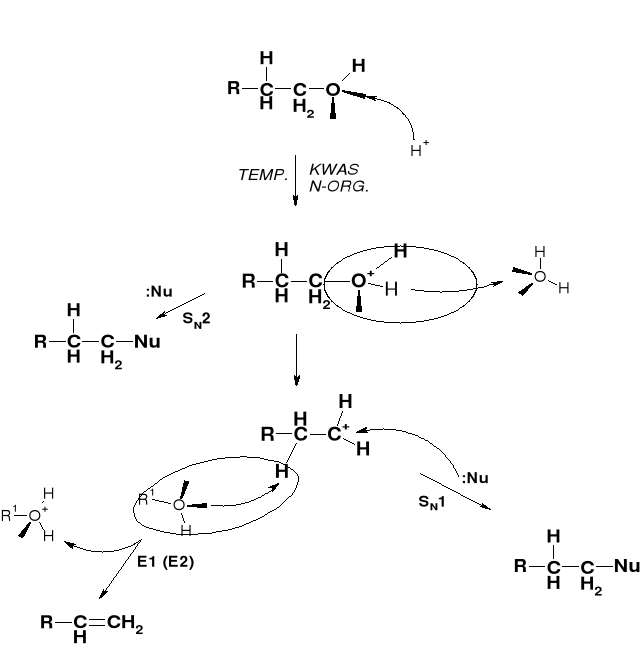
W REAKCJI ALKOHOLU I KWASU HX PODSTAWIENIU ULEGA NIE JON HO- A CZĄSTECZKA H2O |
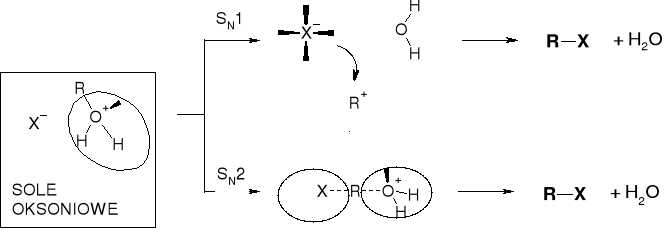
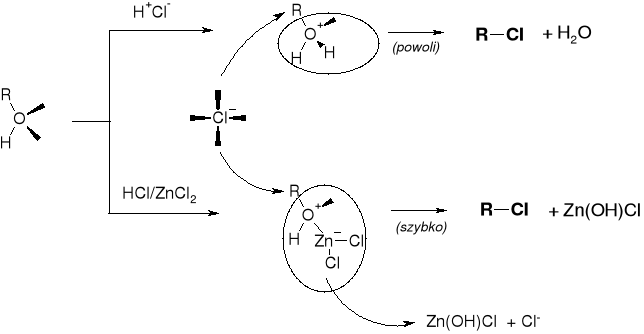
MECHANIZMY PODSTAWIENIA |
|
|
|
PRZEBIEG REAKCJI KONWERSJI ALKOHOLU DO HALOGENKU |
|
WPŁYW HALOGENOWODORU: |
SZYBKOŚĆ REAKCJI |
HF <<< HCl < HBr < HI |
|
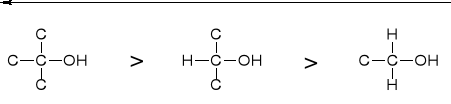
WPŁYW STRUKTURY ALKOHOLU
|
WZROST REAKTYWNOŚCI |
|
|
WPŁYW RZĘDOWOŚCI WEGLA KARBINOLOWEGO (C-OH) |
WZROST RZĘDOWOŚCI WĘGLA KARBINOLOWEGO |
|
WZROST REAKTYWNOŚCI |
|
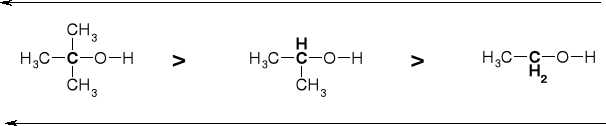
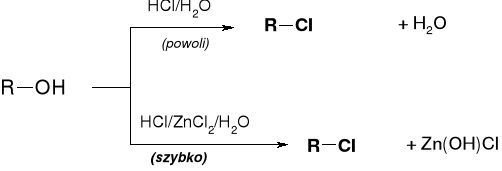
IDENTYFIKACJA RZĘDOWOŚCI ALKOHOLI - PRÓBA LUCASA |
|
|
|
|
|
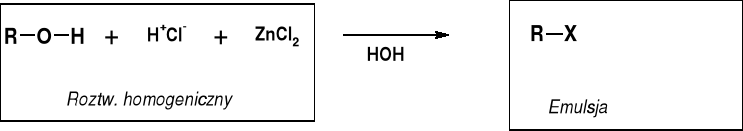
PRÓBA LUCASA - ROZRÓZNIANIE RZĘDOWOŚCI ALKOHOLI |
|
|
|
REAKCJA |
CZAS POJAWIENIA SIĘ EMULSJI |
CI-OH + HCl(H2O) + ZnCl2 → CI-Cl |
30 min. |
CII-OH + HCl(H2O) + ZnCl2 → CII-Cl |
5 min. |
CIII-OH + HCl(H2O) + ZnCl2 → CIII-Cl |
0.5 min. |
EMULSJA TWORZY SIĘ W WYNIKU KONWERSJI ROZPUSZCZALNEGO W WODZIE ALKOHOLU ROH NA NIEROZPUSZCZALNY HALOGENEK RX |
|
|
|
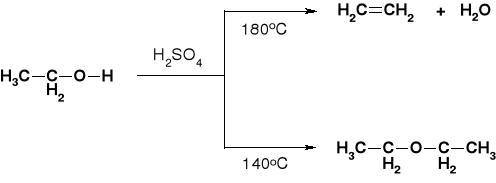
KWASY: H2SO4; H3PO4; Al2O3 |
|
ŁATWOŚĆ DEHYDRATACJI: |
|
PRZYKŁADY |
|
|
|
FENOLE NIE ULEGAJĄ DEHYDRATACJI |
|
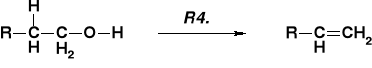
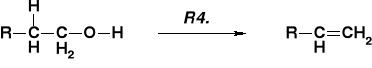
MECHANIZM DEHYDRATACJI ALKOHOLI |
|
|
|
PRZEBIEG ZALEŻNY OD RZĘDOWOŚCI ALKOHOLU |
|
|
|
|
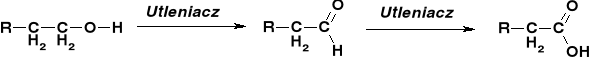
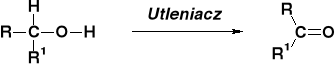
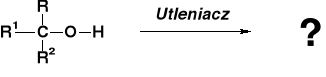
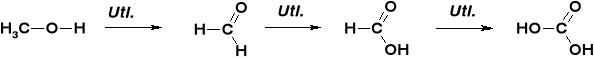
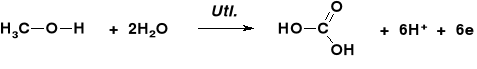
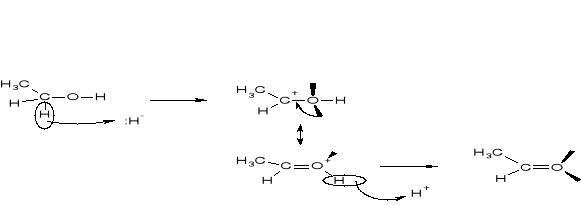
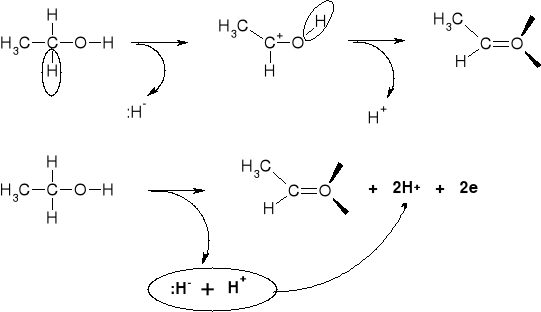
STECHIOMETRIA REAKCJI UTLENIANIA ALKOHOLI |
||
REAKCJE UTLENIENIA ALKOHOLU METYLOWEGO |
||
|
||
|
||
|
||
|
||
|
||
STOSOWANE UTLENIACZE (UKŁADY RED-OX) |
||
MnO4- + e → MnO42-
|
||
MnO4- + 4H+ + 3e → MnO2 + 2H2O
|
||
MnO4- + 8H+ + 5e → Mn2+ + 4H2O
|
||
Cr2O72- + 14H+ + 6e → 2Cr3+ + 4H2O
|
||
CrO3 + 6H+ + 3e → Cr3+ + 3H2O
|
||
DOBIERANIE STECHIOMETRII |
||
A. REAKCJA UTLENIENIA ALKOHOLU (REDUKTORA) |
ELEKTRONOWOŚĆ |
|
|
Uwolnienie 2 elektronów
|
|
B. REAKCJA REDUKCJI UTLENIACZA |
|
|
MnO4- + 4H+ + 3e → MnO2 + 2H2O
|
Pobór 3 elektronów
|
|
Dla zbilansowania elektronowego przebiegu obu reakcji współczynniki stechiometryczne reakcji „A” należy pomnożyć przez 3 a reakcji „B” przez 2. |
||
„A” × 3 |
||
|
||
W wyniku utlenienia 3 cząsteczek metanolu jest uwalnianie 6 elektronów |
||
„B” × 2 |
||
2MnO4- + 8H+ + 6e → 2MnO2 + 4H2O
|
||
Dla redukcji 2 jonów MnO4- układ pobiera 6 elektronów. |
||
|
||
SUMOWANIE ZAPISÓW „A” × 3 I „B” × 2 |
||
|
||
2MnO4- + 8H+ + 6e → 2MnO2 + 4H2O
|
||
3CH3OH + 2MnO4- + 8H+ + 6e → 3CH3C(O)H + 6H+ + 6e + 2MnO2 + 4H2O
|
||
REDUKCJA WSPÓLNYCH WYRAZÓW |
||
3CH3OH + 2MnO4- + 2H+ → 3CH3C(O)H + 2MnO2 + 4H2O
|
||
|
||
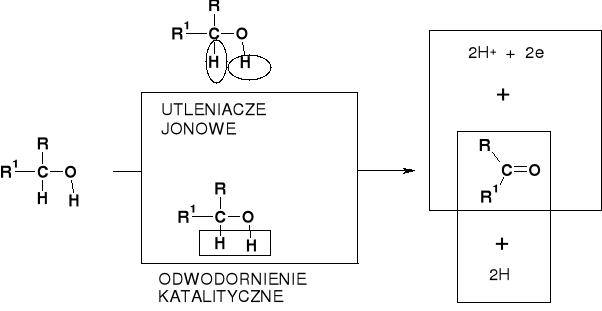
MECHANIZMY UTLENIANIA ALKOHOLI |
|
UTLENIENIE JONOWE |
|
SUMARYCZNIE |
|
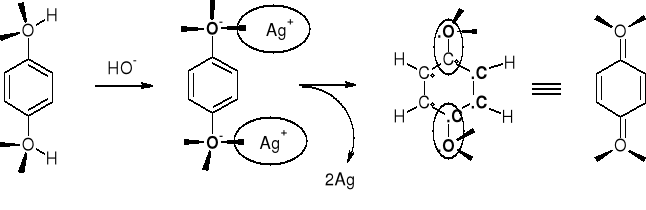
UTLENIANIE FENOLI
|
|
FENOLE - SLINIEJSZE REDUKTORY OD ALKOHOLI |
|
|
|
HYDROCHINON |
p-BENZOCHINON |
|
|
|
|
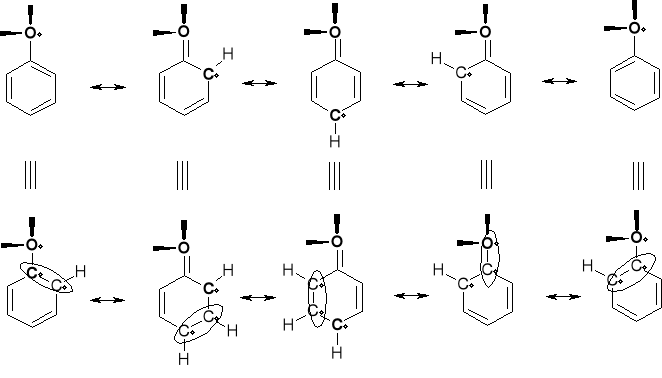
STABILNOŚĆ RODNIKA FENOKSALONOWEGO |
|
|
|
WYNIKA Z LICZBY STRUKTUR REZONANSOWYCH |
|
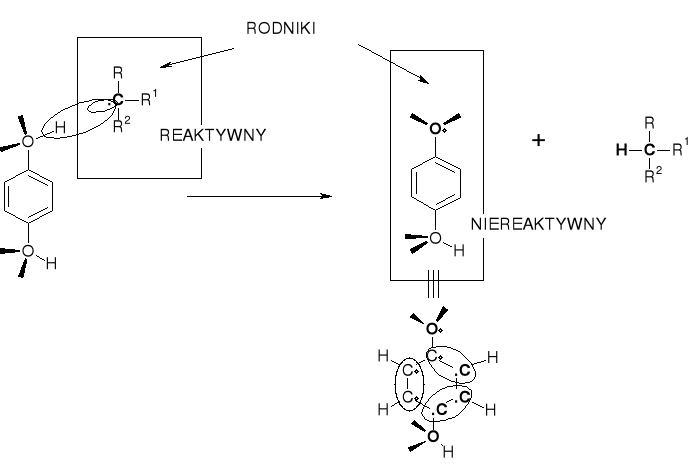
FENOLE - INHIBITORAMI REAKCJI WOLNORODNIKOWYCH |
|
|
FENOLE (HYDROCHINONY) W REAKCJI Z REAKTYWNYMI RODNIKAMI ALKILOWYMI ODDAJĄ ATOM WODORU - PRZEKSZTAŁCAJĄC SIĘ W STABILNE (STABILIZACJA REZONANSOWA) RODNIKI FENOKSYLANOWE. |
|
BARDZO STABILNY RODNIK |
|
UTLENIANIE DIOLI
|
|
|
|
|
|
UTLENIACZE: |
|
NaIO4 (roztwory wodne, pH ~6); |
Pb(OAc)4 (roztwory w AcOH, MeOH, benzenie) |
|
|
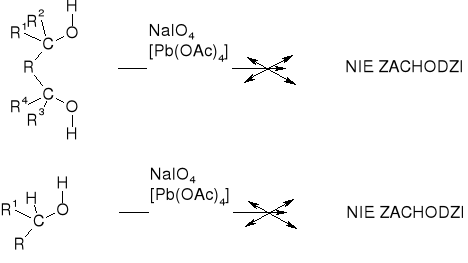
UTLENIENIE ALKOHOLI I INNYCH DIOLI DZIAŁANIEM NaIO4 I/LUB Pb(OAc)4 NIE ZACHODZI |
|
|
|
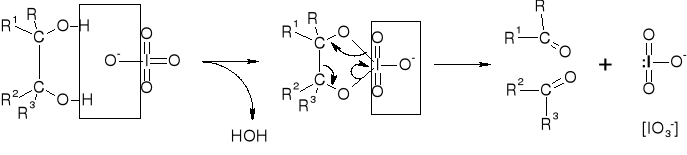
MECHANIZM UTLENIENIA DIOLI WICYNALNYCH DZIAŁANIEM NaIO4 |
|
|
|
|
|
|
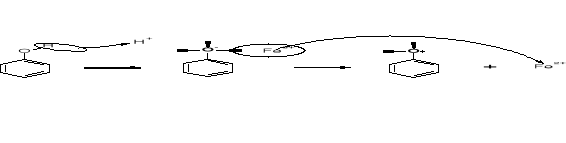
REAKCJE SE |
|
INNE REAKCJE SZKIELETU WĘGLOWEGO |
|
|
|
R7. PRZEGRUPOWANIA DIOLI |
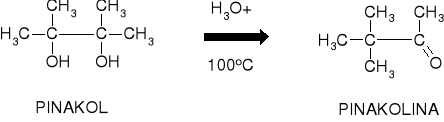
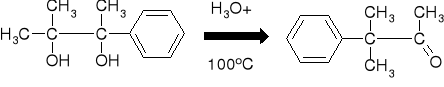
R7.1. PRZEGRUPOWANIE PINAKOLINOWE [WITTIG: 1860] |
|
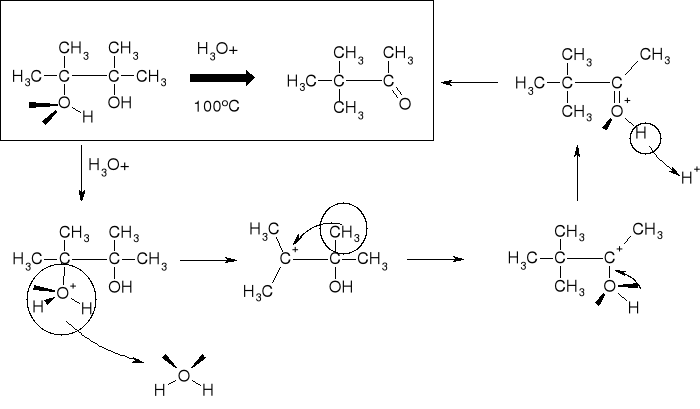
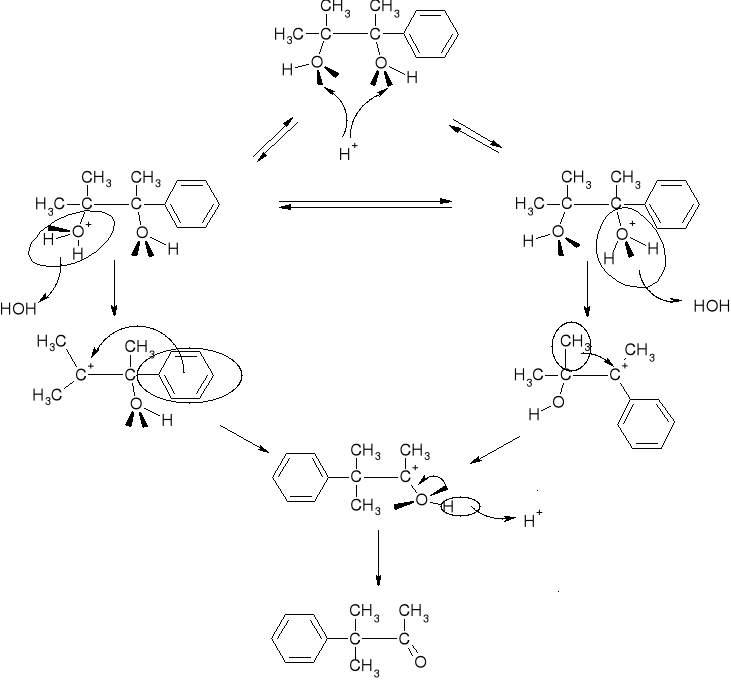
MECHANIZM PRZEGRUPOWANIA |
|
|
7.1.1. KIERUNEK PRZEGRUPOWANIA WYZNACZA |
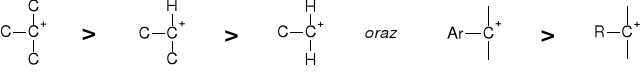
1. WPŁYW TRAWAŁOŚCI KARBOKATIONU |
|
2. WPŁYW ZDOLNOŚCI MIGRACYJNEJ GRUP |
|
|
7.1.1.1. PRZEGRUPOWANIA PINAKOLINOWE. WPŁYW TRWAŁOŚCI KARBOKATIONU NA KIERUNEK REAKCJI. |
|
MECHANIZM PRZEGRUPOWANIA |
|
|
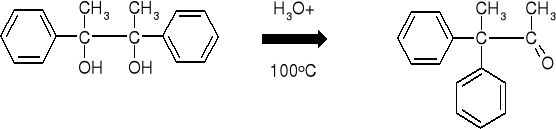
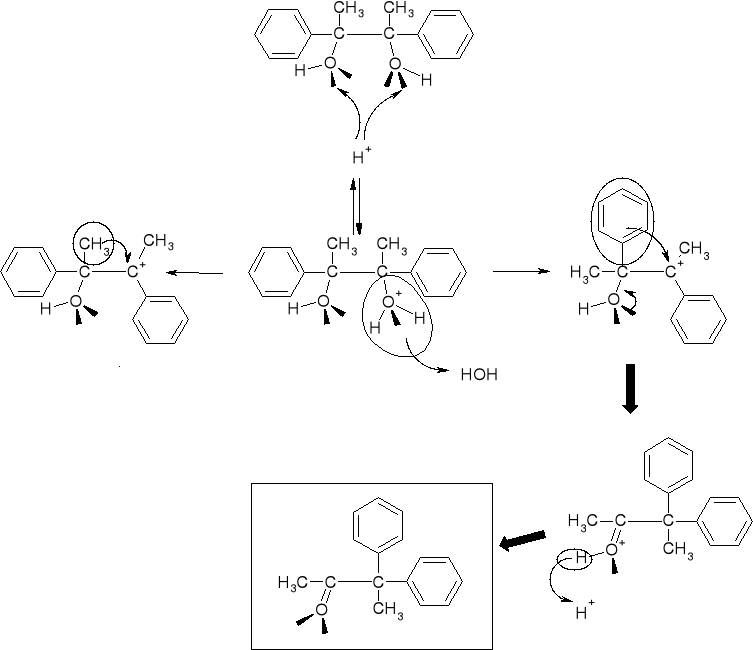
7.1.1.2. PRZEGRUPOWANIA PINAKOLINOWE. WPŁYW ZDOLNOŚCI MIGRACYJNEJ GRUP NA KIERUNEK REAKCJI. |
|
|
MECHANIZM PRZEGRUPOWANIA |
|
|
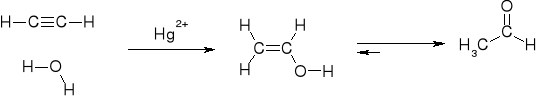
R8. TAUTOMERYZACJA ALKOHOLI WINYLOWYCH |
MECHANIZM TAUTOMERYZACJI |
|
SYNTEZA ALDEHYDU OCTOWEGO NA DRODZE ADDYCJI WODY DO ACETYLENU (VIA ALKOHOL WINYLOWY) |
|
|
Wyszukiwarka
Podobne podstrony:
I Pracownia - zakres materiału, Studia - Chemia kosmetyczna UŁ, II rok, IV semestr, CHEMIA ORGANICZN
R2C=O, Studia - Chemia kosmetyczna UŁ, II rok, IV semestr, CHEMIA ORGANICZNA konwersatorium
ALKENY-ALKINY, Studia - Chemia kosmetyczna UŁ, II rok, IV semestr, CHEMIA ORGANICZNA konwersatorium
34, Studia - Chemia kosmetyczna UŁ, II rok, IV semestr, CHEMIA FIZYCZNA laboratorium, Ćwiczenie 34
ROR, Studia - Chemia kosmetyczna UŁ, II rok, IV semestr, CHEMIA ORGANICZNA konwersatorium
WZÓR SPRAWOZDANIA, Studia - Chemia kosmetyczna UŁ, II rok, IV semestr, CHEMIA FIZYCZNA laboratorium
R-X, Studia - Chemia kosmetyczna UŁ, II rok, IV semestr, CHEMIA ORGANICZNA konwersatorium
AROMATY, Studia - Chemia kosmetyczna UŁ, II rok, IV semestr, CHEMIA ORGANICZNA konwersatorium
I Pracownia - zakres materiału, Studia - Chemia kosmetyczna UŁ, II rok, IV semestr, CHEMIA ORGANICZN
nieorgany-pytania2, Studia - Chemia kosmetyczna UŁ, II rok, III semestr, CHEMIA NIEORGANICZNA labora
Kolokwium I nieorganiczna- elektrochemia, Studia - Chemia kosmetyczna UŁ, II rok, III semestr, CHEMI
ĆWICZENIE 14, Studia - Chemia kosmetyczna UŁ, II rok, III semestr, CHEMIA NIEORGANICZNA laboratorium
ĆWICZENIE 11, Studia - Chemia kosmetyczna UŁ, II rok, III semestr, CHEMIA NIEORGANICZNA laboratorium
pytania 3 roku z nieorganów, Studia - Chemia kosmetyczna UŁ, II rok, III semestr, CHEMIA NIEORGANICZ
nieorgany pytania, Studia - Chemia kosmetyczna UŁ, II rok, III semestr, CHEMIA NIEORGANICZNA laborat
Pytania z kolokwium z chemii nieorganicznej, Studia - Chemia kosmetyczna UŁ, II rok, III semestr, CH
elektrochemia, Studia - Chemia kosmetyczna UŁ, II rok, III semestr, CHEMIA NIEORGANICZNA laboratoriu
BIO-HETEROCYKLE - PODSTAWY, Studia - Chemia kosmetyczna UŁ, III rok, VI semestr, BIOCHEMIA wykłady
Mech, Studia, II rok, II rok, IV semestr, Entomologia
więcej podobnych podstron