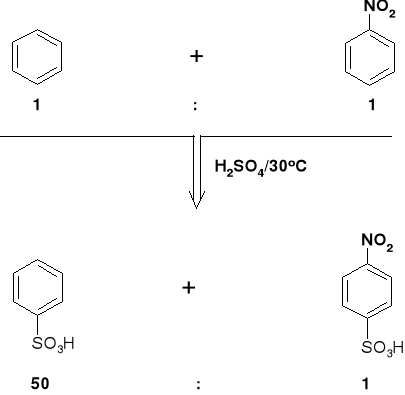
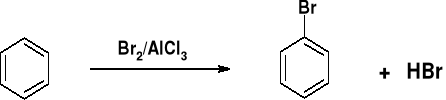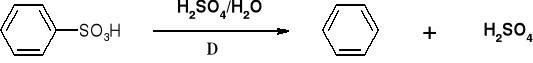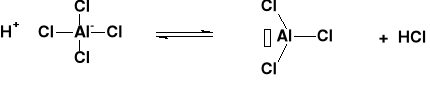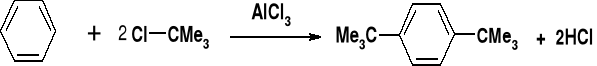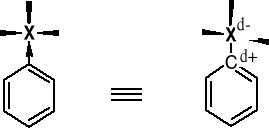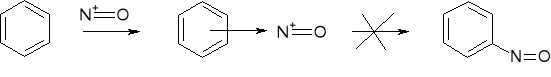ZWIĄZKI AROMATYCZNE |
|
|
|
|
|
|
|
|
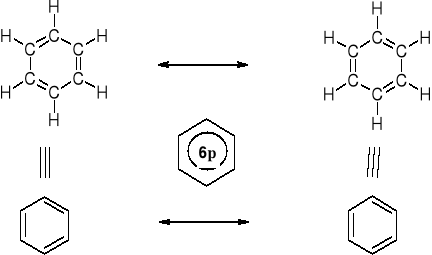
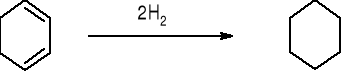
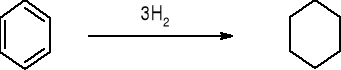
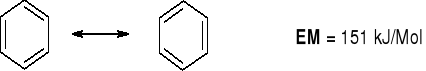
MEZOMERYCZNA STABILIZACJA UKŁADÓW AROMATYCZNYCH. ENERGIA MEZOMERII |
|
REAKCJA |
H [kJ/Mol] |
|
-120 |
|
-232 |
|
-209 |
|
|
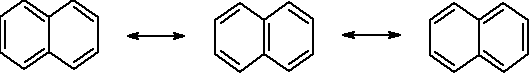
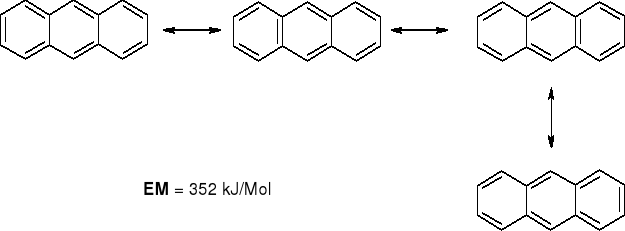
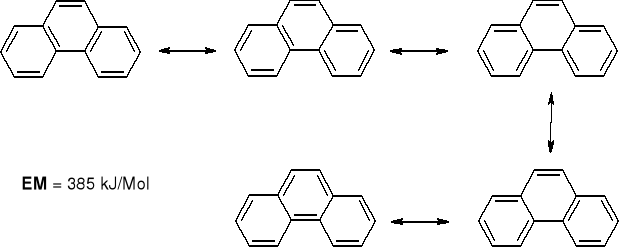
ENERGIA MEZOMERII [EM] SKONDENSOWANYCH PIERŚCIENI AROMATYCZNYCH |
|
151 kJ/Mol : 3 = 50kJ/wiązanie |
[EM]: 256 kJ/Mol |
256 kJ/Mol : 5 = 51kJ/wiązanie |
|
352 kJ/Mol : 7 = 50kJ/wiązanie |
|
385 kJ/Mol : 7 = 55kJ/wiązanie |
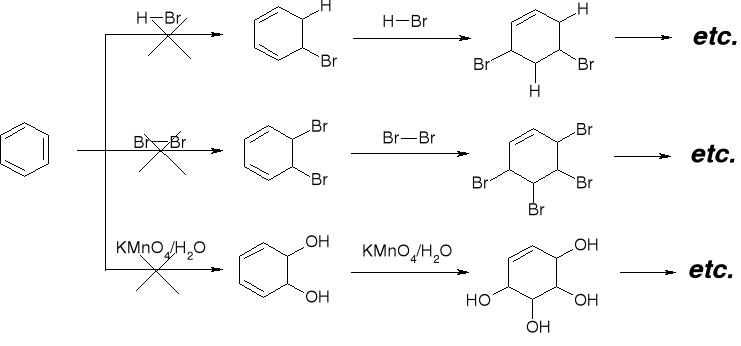
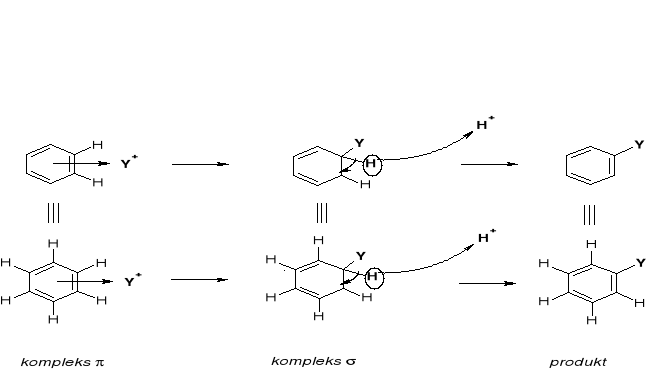
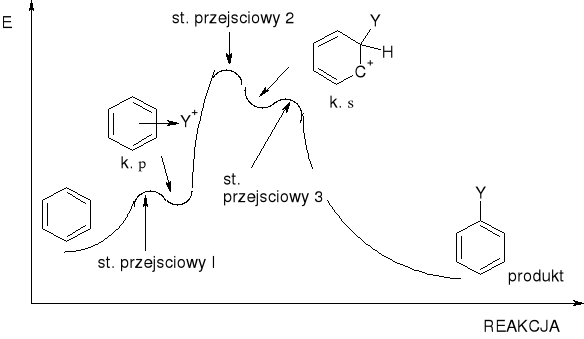
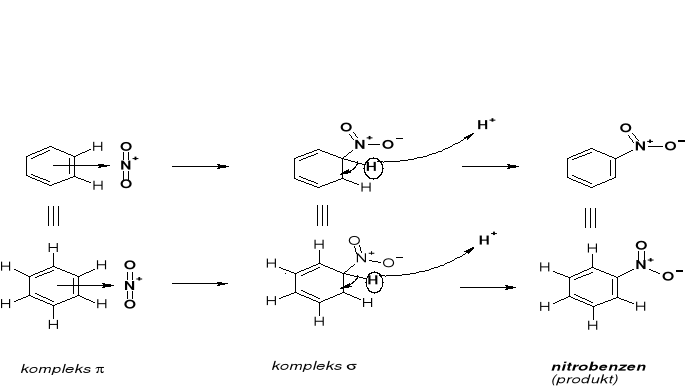
ARYLE. PODSTAWIENIE ELEKTROFILOWE SE |
|
|
|
UWAGI:
|
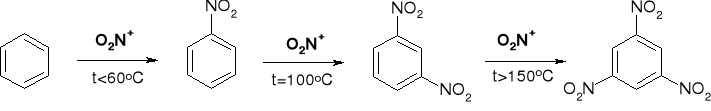
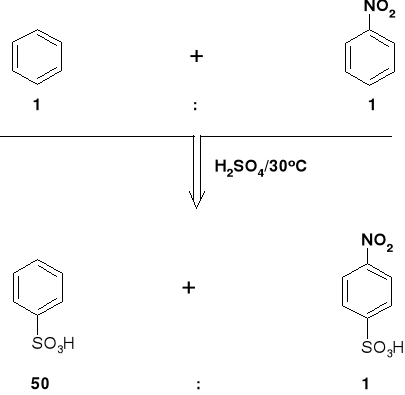
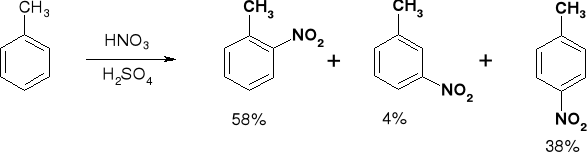
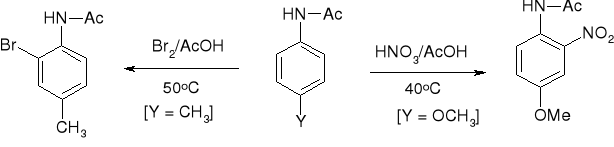
REAKCJE SE. REAKCJA NITROWANIA |
|
|
|
|
|
UWAGI: |
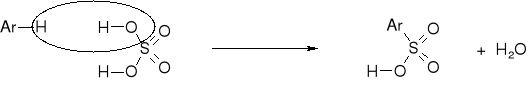
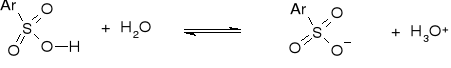
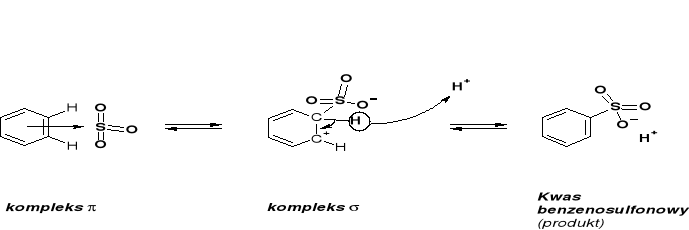
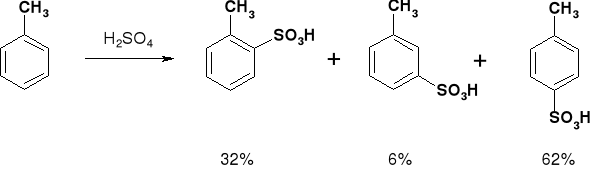
REAKCJE SE. REAKCJA SULFONOWANIA |
|
|
16S: 1s2 2s2p6 3s2p4d0 - [3s2p6d10: 1 orbital s + 3 orbitale p + 5 orbitali d; łącznie 9 orbitali] |
|
Kwasy sulfonowe - moc zbliżona do mocy kwasu siarkowego |
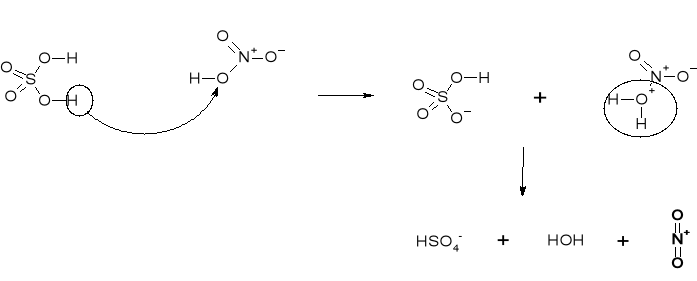
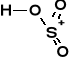
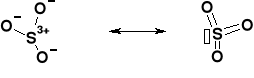
WYTWARZANIE REAGENTA SULFONUJACEGO |
|
|
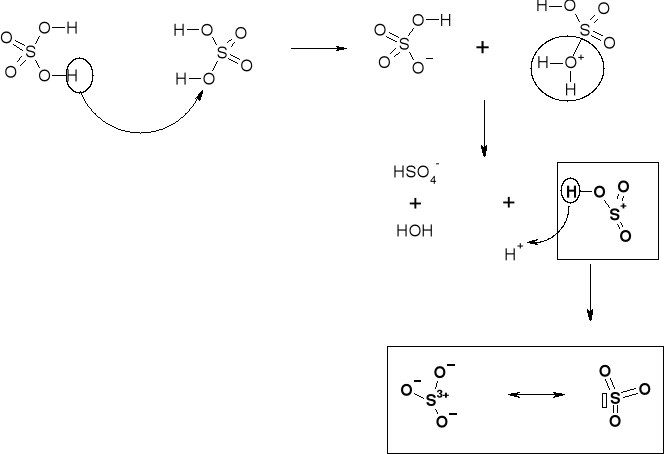
REAKCJE SE. REAKCJA SULFONOWANIA |
|||||
MECHANIZM MOŻE WYKORZYSTAĆ DWIE FORMY REAGENTA SULFONUJĄCEGO: |
|||||
|
|
||||
|
|
||||
|
|||||
UWAGI: REAKCJA SULFONOWANIA JEST REAKCJĄ ODWRACALNĄ |
|||||
|
|||||
|
|||||
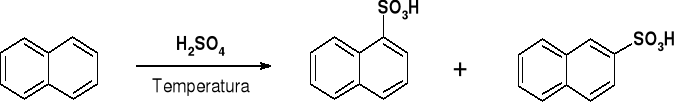
Temperatura: |
0-40oC |
85% |
|
15% |
|
|
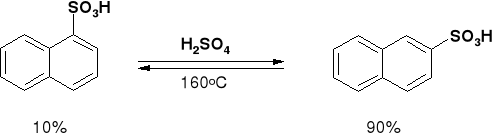
160oC |
10% |
|
90% |
|
|
|||||
|
|||||
REAKCJE SE. REAKCJE ALKILOWANIA |
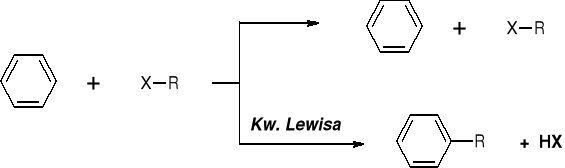
ALKILOWANIE BENZENU DZIAŁANIEM HALOGENKU ALKILU NIE ZACHODZI: |
|
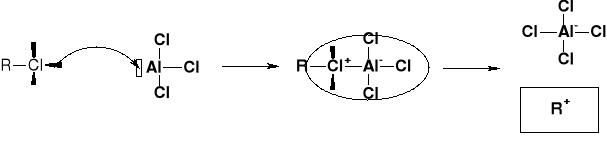
Kwasy Lewisa: AlX3; FeX3; ZnX2 (X = F, Cl, Br, I); BF3, HBF4
|
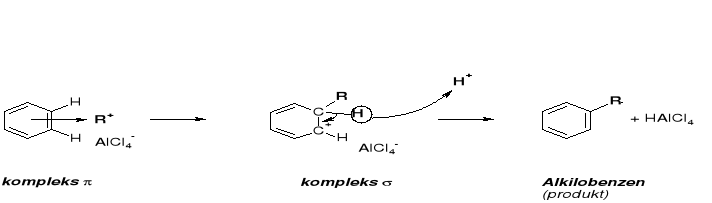
MECHANIZM ALKILOWANIA |
|
|
|
|
|
UWAGI:
|
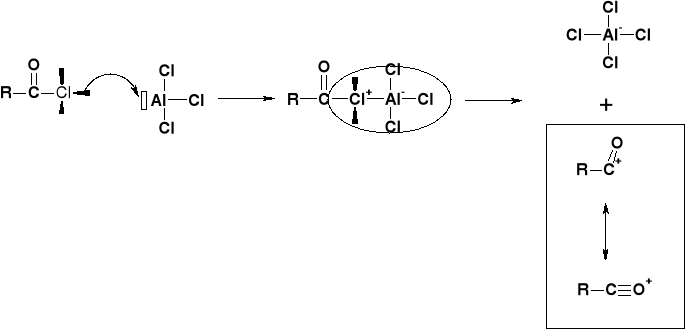
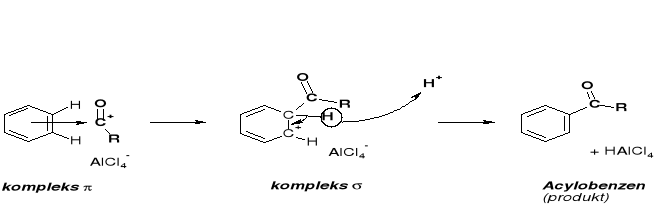
REAKCJE SE. REAKCJE ACYLOWANIA |
|
|
Kwasy Lewisa: AlX3; FeX3; ZnX2 (X = F, Cl, Br, I); BF3, HBF4
|
MECHANIZM ACYLOWANIA |
|
|
|
UWAGI:
|
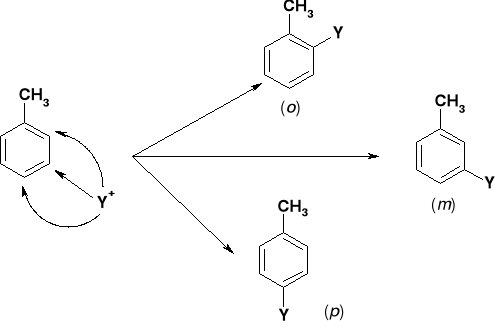
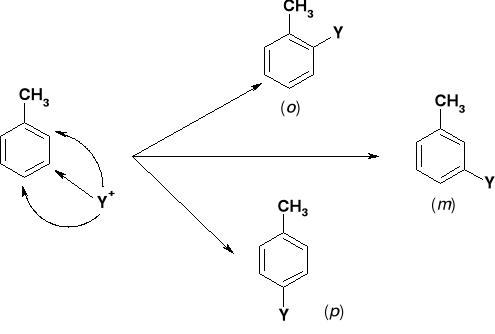
REAKCJE SE. 2. WPŁYW PODSTAWNIKÓW NA REAKTYWNOŚĆ |
2.1. WPŁYW GRUPY ALKILOWEJ NA REAKTYWNOŚĆ |
|
2.2. WPŁYW GRUPY NITROWEJ NA REAKTYWNOŚĆ |
|
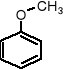
2.3. WPŁYW GRUPY HYDROKSYLOWEJ NA REAKTYWNOŚĆ |
|
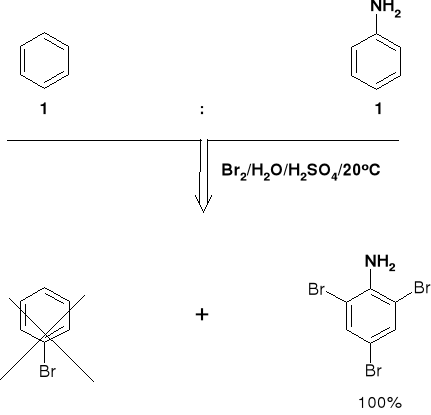
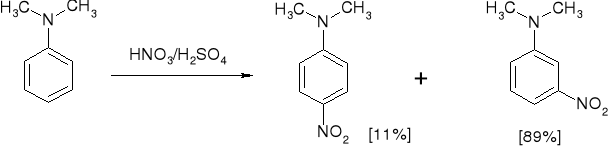
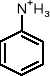
2.4. WPŁYW GRUPY AMINOWEJ NA REAKTYWNOŚĆ |
|
3.WPŁYW KIERUJĄCY PODSTAWNIKÓW W REAKCJACH SE |
3.1. WPŁYW GRUPY ALKILOWEJ W REAKCJACH SE |
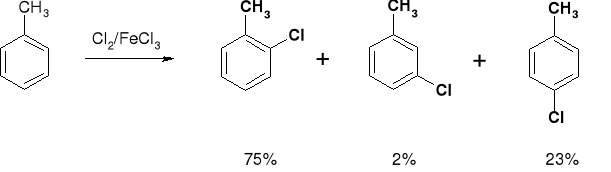
3.1.1. WPŁYW GRUPY ALKILOWEJ W REAKCJI CHLOROWANIA |
|
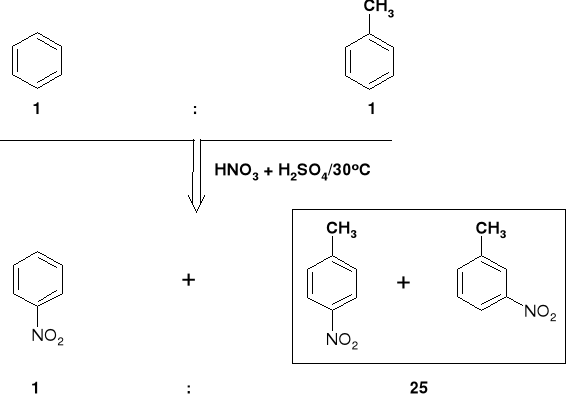
3.1.2. WPŁYW GRUPY ALKILOWEJ W REAKCJI NITROWANIA |
|
3.1.3. WPŁYW GRUPY ALKILOWEJ W REAKCJI SULFONOWANIA |
|
|
UWAGI
|
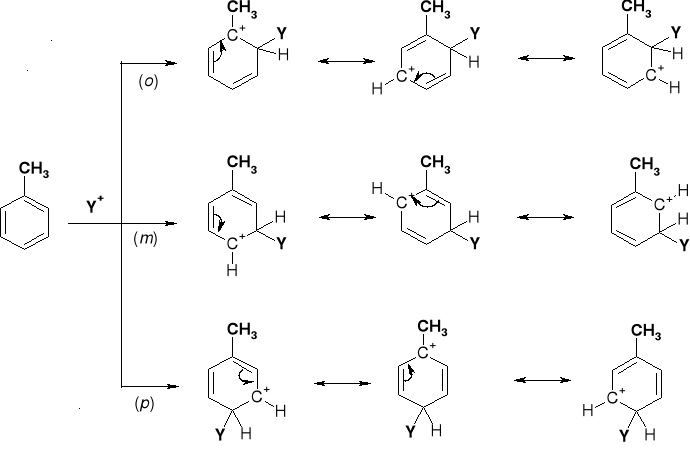
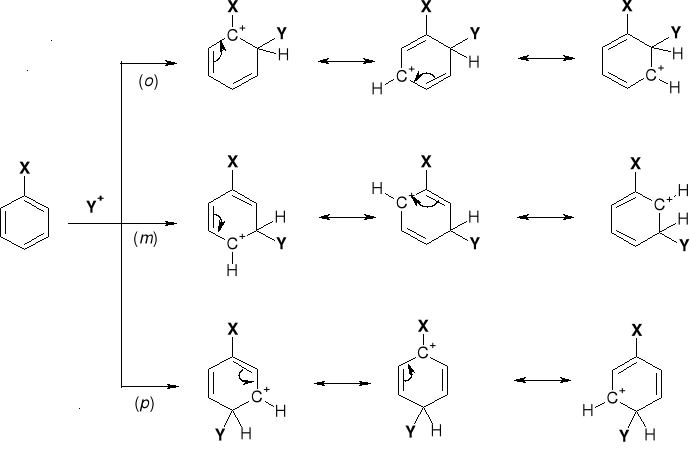
3. WPŁYW PODSTAWNIKÓW NA PRZEBIEG REAKCJI SE |
3.1. WPŁYW GRUPY ALKILOWEJ W REAKCJACH SE |
|
|
|
UWAGI: Dla podstawień w pozycjach o i p struktury rezonansowe zawierają takie w których grupa metylowa (donor elektronów) związane są z C+ - kompensując ładunek. Obecność takich uprzywilejowanych energetycznie struktur - stabilizuje kompleksy σ dla podstawień w położeniach o i p. |
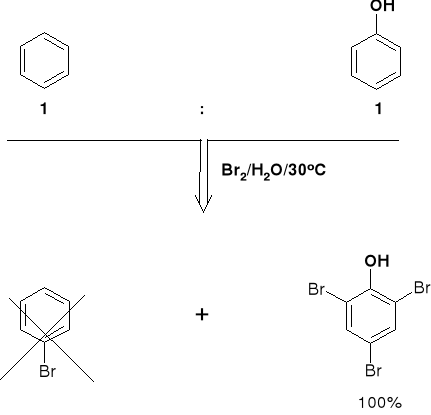
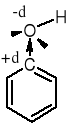
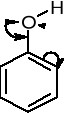
3.2. WPŁYW GRUPY HYDROKSYLOWEJ W REAKCJACH SE
|
|
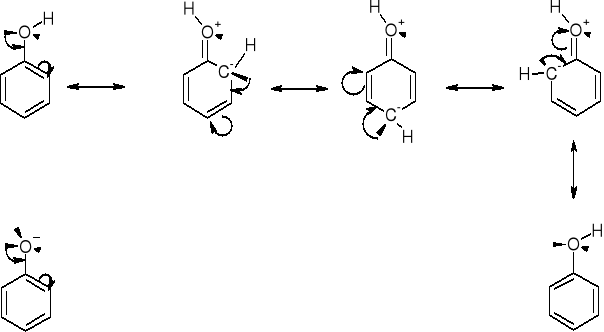
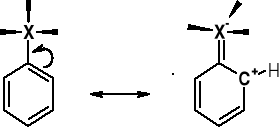
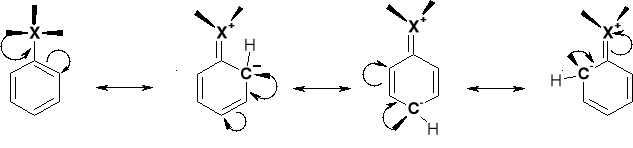
ODDZIAŁYWANIE GRUPY HYDROKSYLOWEJ Z PIERŚCIENIEM |
|
|
|
I < 0 |
M > O |
Efekty E i M są przeciwstawne: Efekt I zmniejsza gęstość elektronowa atomu węgla z którym jest związany, i poprzez efekt indukcyjny gęstość elektronową w pierścieniu benzenowym. Efekt E zwiększa gęstość elektronowa atomu węgla z którym jest związany, i poprzez efekt indukcyjny i mezomeryczny gęstość elektronową w pierścieniu benzenowym.
|
|
Ponieważ efekt M > I w pierścieniu benzenowym fenolu następuje zwiększenie gęstości elektronowej w porównaniu z benzenem niepodstawionym, dlatego fenol szybciej reaguje z reagentami elektrofilowymi niż benzen. |
|
|
|
|
|
Położenia o i p struktur rezonansowych posiadają karboanionowe atomy węgla - w wyniku czego są wyjątkowo podatne na atak czynnika elektrofilowego Y+. |
|
UWAGI: Czy jon fenolanowy wykazuje wyższą reaktywność w reakcjach SE w porównaniu z fenolem?
|
|
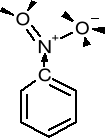
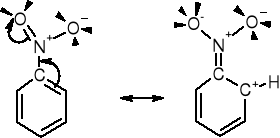
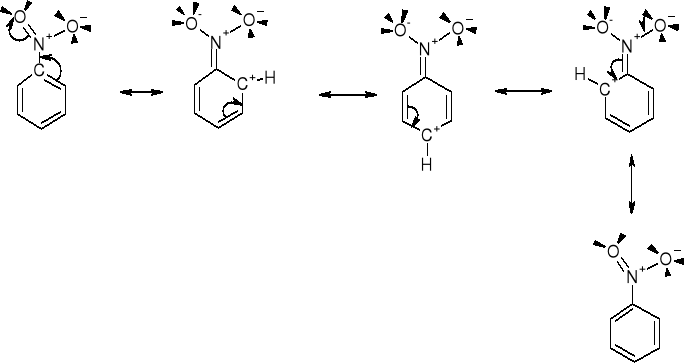
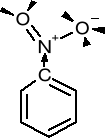
3.3. WPŁYW GRUPY NITROWEJ W REAKCJACH SE |
|
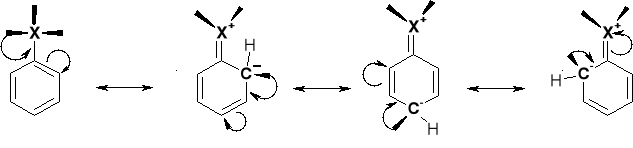
ODDZIAŁYWANIE GRUPY NITROWEJ Z PIERŚCIENIEM |
|
|
|
I < 0 |
M < O |
Efekty I i E zmniejszają gęstość elektronową atomu węgla który jest związany z grupą nitrową, i poprzez efekt indukcyjny i mezomeryczny gęstość elektronową w pierścieniu fenylowym nitrobenzenowym. |
|
Ponieważ efekt M i I < 0 w pierścieniu fenylowym nitrobenzenu następuje obniżenie gęstości elektronowej w porównaniu z benzenem niepodstawionym, dlatego nitrobenzen wolniej reaguje z reagentami elektrofilowymi niż benzen. |
|
|
|
|
|
Położenia o i p struktur rezonansowych posiadają karbokationowe atomy węgla C+- w wyniku czego są wyjątkowo mało podatne na atak czynnika elektrofilowego Y+. Dlatego podstawienie SE w pierścieniu nitrobenzenu zachodzi głównie w pozycji m. |
|
|
|
UWAGI:
|
|
3.4. WPŁYW FLUOROWCA NA PRZEBIEG REAKCJI SE |
|
AKTYWACJA/DEZAKTYWACJA W REAKCJACH SE |
|
1. EFEKT INDUKCYJNY FLUOROWCA |
|
|
|
Obniżenie gęstości elektronowej atomu węgla X-C |
|
2. EFEKT MEZOMERYCZNY FLUOROWCA |
|
|
|
M > 0 |
M < 0 |
Zwiększenie gęstości elektronowej w pierścieniu |
Dla F - niemożliwy; dla Cl, Br i I mało prawdopodobny |
M > 0 |
|
|
|
|
|
3. EFEKT WYPADKOWY: W = M + I ≤ 0 SŁABA DEZAKTYWACJA |
|
UWAGI: |
|
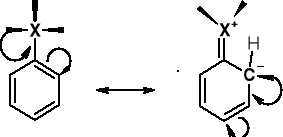
3.4. WPŁYW KIERUJĄCY FLUOROWCA W REAKCJACH SE |
|
UWAGI: Rezonans skutkuje w pojawieniu się w pozycjach (o) i (p) - karboanionu - tym samym podwyższając gęstość elektronową w tych położeniach i ich podwyższoną podatność na atak reagenta elektrofilowego E+. |
|
UWAGI: Dla podstawień w pozycjach o i p struktury rezonansowe zawierają takie w których grupa X (donor elektronów) związane są z karbokationem - kompensując ładunek. Obecność takich uprzywilejowanych energetycznie struktur - stabilizuje kompleksy π dla podstawień o i p. |
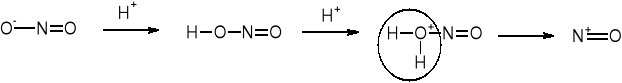
3.5. PRZEBIEG REAKCJI SE - NITROZOWANIE
|
|
|
|
|
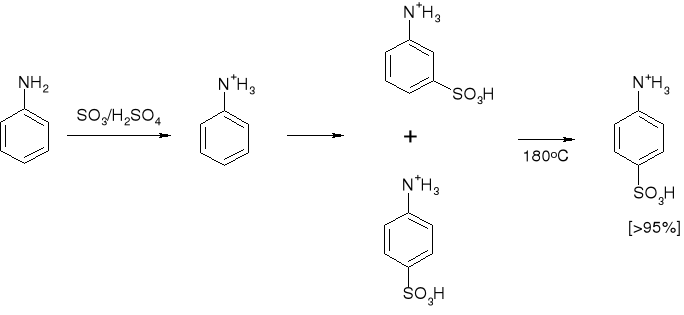
3.6.1. PRZEBIEG REAKCJI SE AMIN |
|
|
|
|
|
|
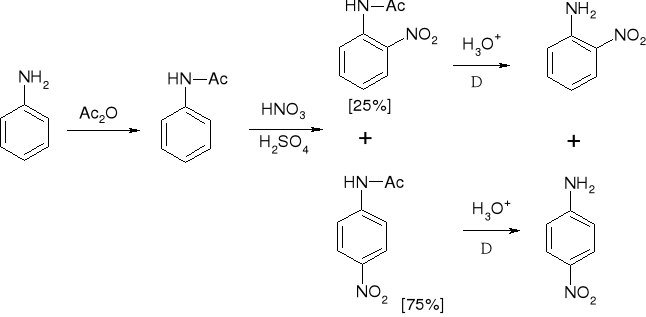
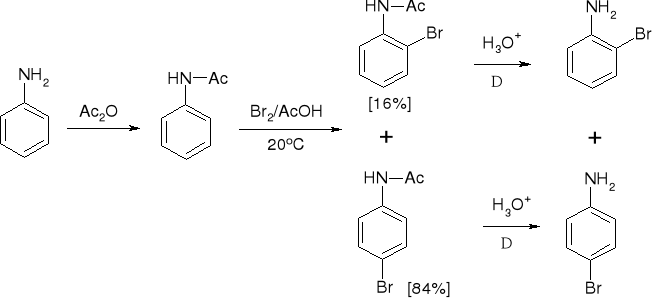
3.6.2. PRZEBIEG REAKCJI SE AMIN |
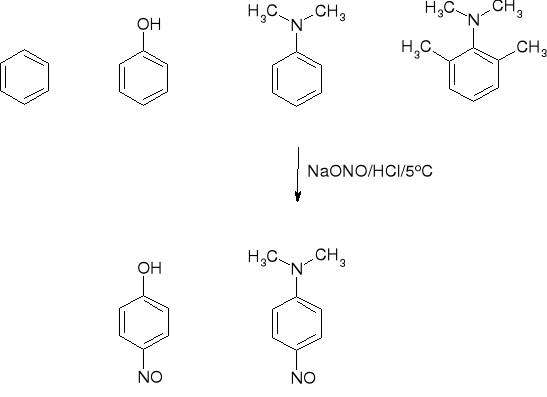
|
|
|
|
|
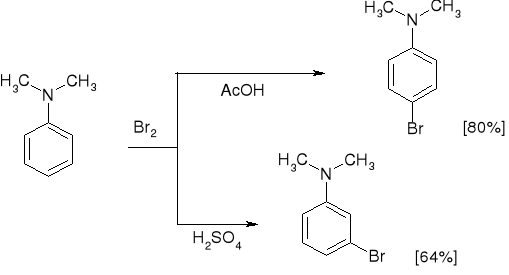
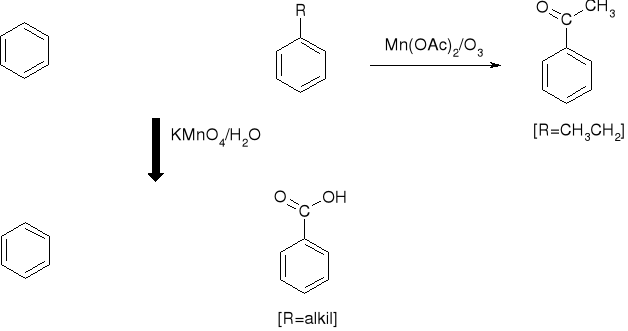
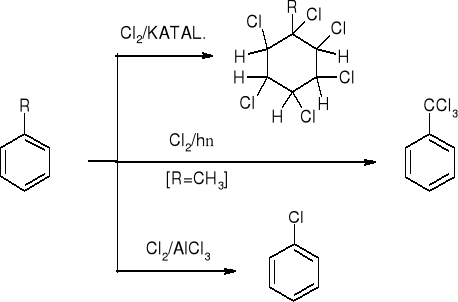
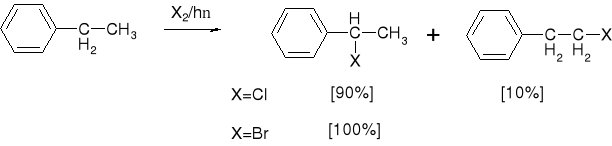
4. REAKCJE W ŁAŃCUCHU BOCZNYM |
|
|
|
|
|
Scharakteryzować efekty indukcyjne (I>0; I<0, I=0), mezomeryczne (M>0; M<0, M=0), i wypadkowe (W>0; W<0, W=0), oraz wpływ kierujący (o, m, p - zaznaczyć pozycję) podstawników w związkach 1-10: |
||||||||||||||
|
|
|
|
|
||||||||||
1 |
2 |
3 |
4 |
5 |
||||||||||
I 0 |
M 0 |
W 0 |
I 0 |
M 0 |
W 0 |
I 0 |
M 0 |
W 0 |
I 0 |
M 0 |
W 0 |
I 0 |
M 0 |
W 0 |
o |
m |
p |
o |
m |
p |
o |
m |
p |
o |
m |
p |
o |
m |
p |
|
|
|
|
|
||||||||||
6 |
7 |
8 |
9 |
10 |
||||||||||
I 0 |
M 0 |
W 0 |
I 0 |
M 0 |
W 0 |
I 0 |
M 0 |
W 0 |
I 0 |
M 0 |
W 0 |
I 0 |
M 0 |
W 0 |
o |
m |
p |
o |
m |
p |
o |
m |
p |
o |
m |
p |
o |
m |
p |
SCHEMATY SKORYGOWANE
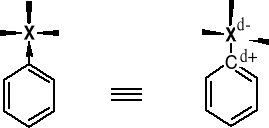
Wyszukiwarka
Podobne podstrony:
I Pracownia - zakres materiału, Studia - Chemia kosmetyczna UŁ, II rok, IV semestr, CHEMIA ORGANICZN
R2C=O, Studia - Chemia kosmetyczna UŁ, II rok, IV semestr, CHEMIA ORGANICZNA konwersatorium
ALKENY-ALKINY, Studia - Chemia kosmetyczna UŁ, II rok, IV semestr, CHEMIA ORGANICZNA konwersatorium
34, Studia - Chemia kosmetyczna UŁ, II rok, IV semestr, CHEMIA FIZYCZNA laboratorium, Ćwiczenie 34
ROR, Studia - Chemia kosmetyczna UŁ, II rok, IV semestr, CHEMIA ORGANICZNA konwersatorium
ROH, Studia - Chemia kosmetyczna UŁ, II rok, IV semestr, CHEMIA ORGANICZNA konwersatorium
WZÓR SPRAWOZDANIA, Studia - Chemia kosmetyczna UŁ, II rok, IV semestr, CHEMIA FIZYCZNA laboratorium
R-X, Studia - Chemia kosmetyczna UŁ, II rok, IV semestr, CHEMIA ORGANICZNA konwersatorium
I Pracownia - zakres materiału, Studia - Chemia kosmetyczna UŁ, II rok, IV semestr, CHEMIA ORGANICZN
nieorgany-pytania2, Studia - Chemia kosmetyczna UŁ, II rok, III semestr, CHEMIA NIEORGANICZNA labora
Kolokwium I nieorganiczna- elektrochemia, Studia - Chemia kosmetyczna UŁ, II rok, III semestr, CHEMI
ĆWICZENIE 14, Studia - Chemia kosmetyczna UŁ, II rok, III semestr, CHEMIA NIEORGANICZNA laboratorium
ĆWICZENIE 11, Studia - Chemia kosmetyczna UŁ, II rok, III semestr, CHEMIA NIEORGANICZNA laboratorium
pytania 3 roku z nieorganów, Studia - Chemia kosmetyczna UŁ, II rok, III semestr, CHEMIA NIEORGANICZ
nieorgany pytania, Studia - Chemia kosmetyczna UŁ, II rok, III semestr, CHEMIA NIEORGANICZNA laborat
Pytania z kolokwium z chemii nieorganicznej, Studia - Chemia kosmetyczna UŁ, II rok, III semestr, CH
elektrochemia, Studia - Chemia kosmetyczna UŁ, II rok, III semestr, CHEMIA NIEORGANICZNA laboratoriu
BIO-HETEROCYKLE - PODSTAWY, Studia - Chemia kosmetyczna UŁ, III rok, VI semestr, BIOCHEMIA wykłady
Mech, Studia, II rok, II rok, IV semestr, Entomologia
więcej podobnych podstron