27
Laboratoria Chemii Fizycznej
ĆWICZENIE NR 38
TEMAT: Wyznaczanie ciepła parowania metodą tensymetryczną
Piotr Tylak
Data: 5.05.2009r.
Godziny zajęć: 12:15 - 16:15
Cel ćwiczenia: obliczenie ciepła parowania na podstawie temperaturowej zależności prężności cieczy.
Wstęp teoretyczny.
Faza - część układu jednolita pod względem chemicznym i fizycznym, oddzielona od innych części wyraźną powierzchnią rozdziału. Może składać się z dowolnej ilości substancji. Może stanowić całość lub może być podzielona na szereg mniejszych jednostek, jednak wymiary fragmentów fazy muszą być większe od molekularnych. Na powierzchni rozdziału występują skokowe zmiany właściwości makroskopowych. Wewnątrz fazy właściwości nie zmieniają się.
Układ - jest to ciało lub zespół ciał poddawanych obserwacji.
Składnik niezależny - jest to każde indywiduum chemiczne tzw. zbiór wszystkich substancji niezależnie od stanu skupienia, których cząsteczki składają się z tych samych rodzajów atomów połączonych ze sobą w takich samych stosunkach.
Liczba stopni swobody - definiuje się ją jako najmniejszą liczbę parametrów intensywnych, które trzeba określić dla wyznaczenia wartości wszystkich pozostałych parametrów intensywnych. Liczbę tę oznacza się symbolem z. Według innego sformułowania jest to liczba parametrów intensywnych, które można niezależnie zmieniać nie powodując zakłócenia równowagi fazowej.
Reguła faz Gibbsa - można ją wyrazić równaniem:
![]()
.
s - liczba składników rozdzielonych między f faz układu. Liczbę stopni swobody układu można wyznaczyć sumując liczby parametrów potrzebnych do opisania poszczególnych faz, a następnie odejmując od otrzymanej sumy liczbę tych parametrów, których wartości są wyznaczone przez zależności równowagowe między różnymi fazami.
Jeżeli układ zawiera jeden składnik nie reagujący chemicznie, liczba stopni swobody wynosi z = 3-f. W stanie równowagi mogą więc występować dwie lub trzy fazy.
Dla układu jednoskładnikowego w 2 fazach mamy, więc: z=1-2+2=1 Oznacza to, że jeden z parametrów p lub T można dobrać dowolnie, a drugi przybierze wartość od niego zależną. Zatem wielkości te są od siebie zależne, co można zapisać jako:
f(p,T)=0
Matematycznym wyrazem tej funkcji jest równanie Clausiusa - Clapeyrona:
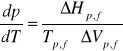
gdzie:
![]()
-entalpia przemiany fazowej
![]()
-temperatura przemiany fazowej
![]()
-zmiana objętości towarzysząca przemianie fazowej
Dla równowagi pomiędzy gazem a cieczą można przyjąć, iż:
![]()
Praktycznie, szczególnie ważne są układy zawierające parę nasyconą, tzn. parę pozostającą w równowadze z ciałem stałym. Zakładając, że spełnia ona równanie gazu doskonałego
![]()
oraz uwzględniając ![]()
, ponieważ ![]()
, wzór przybiera postać:
![]()
,
gdzie P oznacza ciśnienie pary nasyconej. Gdy ΔHpar = const, po rozdzieleniu zmiennych i scałkowaniu równania otrzymuje się:
![]()
Zależność lnp = f(1/T) jest liniowa, a współczynnik kierunkowy jest równy 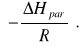
Wyniki pomiarów.
![]()
t (°C) |
h1 (mmHg) |
h2 (mmHg) |
T (°K) |
1/T |
ln pc |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Tabela wyników:
t (°C) |
T (°K) |
h1 (mmHg) |
h2 (mmHg) |
Pc=h1-h2 |
1/T |
ln(pc) |
24 |
297 |
152 |
117 |
35 |
0,0033670 |
3,5553480 |
28,5 |
301,5 |
158 |
112 |
46 |
0,0033167 |
3,8286414 |
34,5 |
307,5 |
164 |
105 |
59 |
0,0032520 |
4,0775374 |
40,5 |
313,5 |
171 |
98 |
73 |
0,0031898 |
4,2904594 |
45,5 |
318,5 |
179 |
91 |
88 |
0,0031397 |
4,4773368 |
52,5 |
325,5 |
194 |
77 |
117 |
0,0030722 |
4,7621739 |
Wykres:
Obliczenia:
Wykres przedstawia liniową zależność określoną wzorem:
ln(pc) = -3959,5 (1/T) + 16,926
Ciepło parowania toluenu oblicza się ze wzoru:
![]()
,
gdzie:
b - współczynnik kierunkowy prostej
R - stała gazowa. ![]()
![]()
b = -3959,5
ΔHp = 8,314![]()
ּ3959,5![]()
= ![]()
Wartość ciepła parowania toluenu odczytana z tablic wynosi:
ΔHp = ![]()
.
Wartość ciepła parowania otrzymana z obliczeń:
ΔHp = ![]()
.
Wnioski:
Celem ćwiczenia było wyznaczenie ciepła parowania toluenu metodą tensometryczną
Wykres pokazuje liniowa zależność lnp = f(1/T). Zależność tą opisuje równanie
ln(pc) = -3959,5 (1/T) + 16,926.
Otrzymana z doświadczalna wartość parowania wynosi ΔHp =![]()
i jest zbliżona do wartości literaturowej która wynosi ΔHp = ![]()
.
Różnica między wartością literaturowa, a doświadczalną ciepła parowania może być spowodowana błędem odczytów poziomów słupka rtęci.
Wyszukiwarka
Podobne podstrony:
Sprawozdanie 27, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, sprawka
Sprawozdanie 7, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, sprawka
Sprawozdanie 5, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, sprawka
mmgg, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II sprawka
spr57, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy
Moje 50 , Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spr
monia 11, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spr
15 wyznaczanie ciepła spalania, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, Chem
KOND41vmac, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II s
rad, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II sprawka
spr15, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy
Do druku askorbinowy, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczn
Elektroda szklana, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna c
Podczas wymuszonego przep+éywu p+éynu, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wsz
27 poprawa 2, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, Chemia fizyczna
POLSKI, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spraw
więcej podobnych podstron