Numer ćwiczenia: 17 |
Temat ćwiczenia:
Wyznaczanie entalpii swobodnej (ΔG), entalpii (ΔH) i entropii (ΔS) reakcji zachodzącej |
Data wykonania ćwiczenia: 24.03.2014 r. |
|
|
Data oddania sprawozdania: 26.03.2014 r. |
Grupa: A2 |
Góralik Monika |
Nazwisko sprawdzającego: mgr Elżbieta Kurowska |
Uwagi: |
Ocena: |
|
1. Cel ćwiczenia.
Celem ćwiczenia było wyznaczenie wartości kilku funkcji termodynamicznych: entalpii swobodnej, entalpii i entropii reakcji zachodzącej w ogniwie Clarka za pomocą pomiarów siły elektromotorycznej.
2. Wykonanie.
Zmontowano zestaw pomiarowy: ogniwo Clarka podłączone do woltomierza przymocowano do stojaka i umieszczono w naczyniu Dewara napełnionym wodą
Obniżono temperaturę wody do 5 °C (278 K) za pomocą lodu, termostatowano układ przez
ok. 15 minut i dokonano pomiaruDokonano kolejnych pomiarów w temperaturach od 10 do 30 °C (283-303 K; różnica między kolejnymi temperaturami: ok. 5 °C) poprzez wymianę zimnej wody na ciepłą
i termostatowanie przez ok. 15 minut po każdym podwyższeniu temperatury
3. Wyniki.
Tabela1.: wyniki pomiarów
T [K] |
SEM [V] |
278,0 |
1,427 |
283,1 |
1,423 |
288,0 |
1,420 |
293,0 |
1,416 |
297,9 |
1,411 |
302,9 |
1,405 |
4. Opracowanie wyników.
Dzięki znajomości równania:
gdzie:
zF - ładunek, który przepłynął przez układ [C]
E - różnica potencjałów - SEM ogniwa w danej temperaturze [V]
T - temperatura w określonym momencie pomiaru [K]
ΔH - entalpia [kJ/mol]
wyprowadzonego poprzez podstawienie zależności
ΔG=-zFE
gdzie:
ΔG - entalpia swobodna [kJ/mol]
do równania Gibbsa-Helmholtza:
oraz narysowaniu wykresu zależności SEM od temperatury wyznaczono wartość współczynnika temperaturowego.
Pierwsze równanie można skrócić do formy:
które odpowiada równaniu poniższego wykresu określonego funkcją liniową. Jej współczynnik kierunkowy równa się średniemu współczynnikowi temperaturowemu ogniwa.
Wykres1.: zależność SEM od temperatury
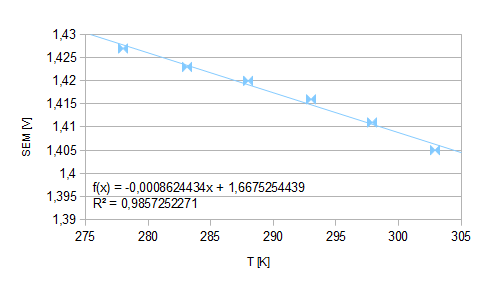
Tabela2.: wartości funkcji termodynamicznych reakcji zachodzącej w ogniwie Clarka
T [K] |
SEM [V] |
ΔG [kJ/mol] |
ΔH [kJ/mol] |
ΔS [J/mol*K] |
|||
|
|
dośw. |
teor. |
dośw. |
teor. |
dośw. |
teor. |
278,0 |
1,427 |
-275,368 |
-279,584 |
-321,503 |
-328,591 |
-165,954 |
-176,284 |
283,1 |
1,423 |
-274,596 |
-278,675 |
-321,578 |
-329,649 |
-165,954 |
-180,057 |
288,0 |
1,420 |
-274,017 |
-277,784 |
-321,812 |
-330,666 |
-165,954 |
-183,617 |
293,0 |
1,416 |
-273,246 |
-276,857 |
-321,870 |
-331,704 |
-165,954 |
-187,189 |
297,9 |
1,411 |
-272,281 |
-275,931 |
-321,718 |
-332,720 |
-165,954 |
-190,630 |
302,9 |
1,405 |
-271,123 |
-274,970 |
-321,390 |
-333,758 |
-165,954 |
-194,084 |
Reakcja stanowiąca źródło siły elektromotorycznej w badanym ogniwie o schemacie:
- Zn(Hg)| ZnSO4*7H2O | Hg2SO4 | Hg +
jest dana równaniem:
Zn + Hg2SO4 + 7H2O → ZnSO4*7H2O + 2Hg
i podczas niej są wymieniane dwa elektrony pomiędzy metalicznym cynkiem a dwoma jonami Hg+ trudno rozpuszczalnego siarczanu rtęci(I). Wartość ładunku, jaki przepływał przez ogniwo można obliczyć ze wzoru:
q=zF
gdzie:
F - stała Faradaya (96485 C/mol)
z - liczba elektronów biorących udział w reakcji (w badanym przypadku 2 elektrony)
stąd:
q=zF=2*96485=192970 C
Doświadczalną wartość zmiany entalpii obliczono ze wzoru:
gdzie T to temperatura pomiaru [K].
Przykład:
Doświadczalną wartość zmiany entalpii swobodnej obliczono ze wzoru:
ΔGT=-zFE
Przykład:
ΔG278=-192970*1,427=-275368,19 J/mol=--275,368 kJ/mol
Doświadczalna wartość zmiany entropii została wyznaczona ze wzoru:
Przykład:
(Ta wartość jest stała dla wszystkich temperatur, w których dokonywano pomiaru - patrz: Wnioski)
Teoretyczną wartość zmiany entalpii wyznaczono ze wzoru:
Gdzie:
i
Przykład:
Teoretyczna wartość zmiany entropii została obliczona ze wzoru:
Gdzie:
Przykład:
Teoretyczną wartość entalpii swobodnej wyznaczono ze wzoru:
ΔGT= ΔHT- T*ΔST
Przykład:
ΔG278= -328,591-278*(-0,176284)=-279,584 kJ/mol
Wartości ΔH0298, ΔG0298, ΔS0298 i ΔCp dla substratów i produktów zostały zaczerpnięte
z tabeli podanej w opisie ćwiczenia w sekcji „opracowanie wyników”.
5. Wnioski.
Na podstawie pomiarów SEM dokonanych podczas ćwiczenia wyznaczono wartości zmiany entalpii, zmiany entalpii swobodnej i zmiany entropii reakcji zachodzącej w badanym ogniwie. Różnią się od obliczonych wartości teoretycznych przez błędy wynikające z niepewności pomiaru temperatury i SEM przez woltomierz, problemy z utrzymaniem stałej temperatury i odmienne warunki wyznaczania literaturowych wartości funkcji termodynamicznych dla reagentów od tych, w których wykonywano opisane w niniejszym sprawozdaniu doświadczenie. Doświadczalna wartość entropii jest stała ze względu na przyjęcie liniowej zależności SEM od temperatury.
Wyszukiwarka
Podobne podstrony:
Ogniwo galwaniczne, Chemia
cw3 ogniwo clarka id 123321 Nieznany
17 ogniwo Clarka
ogniwo Clarka
28 ogniwo Clarka
17 ogniwo Clarka
SEM ogniwa1, Technologia chemiczna, Chemia fizyczna, Laboratorium, inne, SEM ogniwa
wpływ stężenia i temperatury na lepkość roztworów, Chemia fizyczna, laboratorium, Chemia fizyczna
Ćwiczenie 1 - oznaczanie stalej i stopnia dysocjacji, Biotechnologia PWR, Semestr 3, Chemia fizyczna
chem.fiz.równowagi fazowe, Inżynieria środowiska, inż, Semestr III, Chemia fizyczna, laboratorium
Sprawozdanie 38 Patrycja, laboratorium chemia fizyczna
chemia fizyczna laboratoria, iwona chem. fiz. ćw. 91
Badanie równowagi fazowej w układzie trójskładnikowym 8.3, Technologia chemiczna, Chemia fizyczna, l
elektrolityzadania st, Technologia chemiczna, Chemia fizyczna, laboratorium
chemia fizyczna laboratoria, 95,94, 97
chemia fizyczna laboratoria, 31,32,33vigora, 97
więcej podobnych podstron