KIERUNEK:
TEMAT: Wyznaczanie stosunku ciepła właściwego ![]()
metodą Clementa Desormes'a
SYMBOL: C -1
DATA
PROWADZĄCY:
Tabela wyników pomiarów:
ciśnienie atmosferyczne p0=769mmHg
1mmHg=13,591mmH2O
p0=10451,479 mmH2O
nr
|
h1 [mmH2O] |
h2 [mmH2O] |
h3 [mmH2O] |
h4 [mmH2O] |
1 |
298 |
704 |
458 |
543 |
2 |
317 |
213 |
275 |
254 |
3 |
290 |
713 |
448 |
553 |
4 |
358 |
173 |
286 |
243 |
5 |
215 |
788 |
428 |
571 |
6 |
354 |
177 |
285 |
244 |
7 |
170 |
835 |
418 |
581 |
8 |
398 |
131 |
297 |
232 |
9 |
290 |
710 |
446 |
553 |
10 |
357 |
171 |
287 |
241 |
Δh = 1mmH2O
![]()
I - WSTĘP TEORETYCZNY
Gaz doskonały charakteryzuje się następującymi cechami: 1) cząsteczki są tak małe, że nie zajmują zupełnie objętości, tzn. są cząsteczkami punktowymi; 2) siły cząsteczkowe są tak małe, że można przyjąć, iż są one równe zeru.
Przemiana izotermiczna- ogrzewanie gazu przy stałej temperaturze; zmienia się objętość V i ciśnienie p. zgodnie z prawem Boyl'a-Mariotte'a: pV=constans. Przy zmianach objętości zmienia się liczba N0 cząstek przypadająca na 1 cm3.
Przemiana izobaryczna- takie ogrzewanie gazu, przy którym ciśnienie p nie zmienia się natomiast objętość V rośnie. Objętość Vt gazu ogrzanego do temperatury t określona jest zależnością, nazwaną prawem Gay-Lussaca:
Vt= V0(1+αt),
gdzie V0-objętość gazu w temperaturze 0°C, α- współczynnik rozszerzalności objętościowej-jednakowy dla wszystkich gaz (α=0,00366).
Przemiana izochoryczna- ogrzewanie gazu w warunkach niezmiennej objętości. Rośnie wówczas średnia energia kinetyczna ![]()
cząsteczek. N0 nie zmienia się, wzrasta natomiast ciśnienie gazu na ścianki naczynia. Ciśnienia pt gazu ogrzanego do temperatury t wyrażone jest zależnością, nazwaną prawem Charlesa:
![]()
,
gdzie p0-ciśnienie gazu w temperaturze 0°C.
Przemiana ogólna- takie ogrzewanie gazu, przy którym zmieniają się równocześnie wszystkie trzy wielkości określające stan gazu:
pV=nRT,
gdzie R- stała gazowa.
W procesie adiabatycznym nie ma przepływu ciepła do układu ani z układu na zewnątrz. Procesy takie można realizować doświadczalnie metodą oddzielenia układu od otoczenia materiałami, które są dobrymi izolatorami cieplnymi, albo przez przeprowadzenie procesu bardzo szybko. Ponieważ przepływ ciepła jest dość powolny, więc każdy proces można uczynić praktycznie adiabatycznym, przeprowadzając go dostatecznie szybko.
W procesie adiabatycznym Q jest równe zeru, więc z pierwszej zasady termodynamiki otrzymujemy:
![]()
Dlatego też energia wewnętrzna układu wzrasta w procesie adiabatycznym dokładnie o tyle, ile pracy włożono w układ.
Ciepło jest to wielkość fizyczna charakteryzująca sposób przekazywania energii między układem i otoczeniem za pośrednictwem nieuporządkowanych zderzeń między cząsteczkami układu i otoczenia oraz przez promieniowanie.
Ciepło właściwe jest to ilość energii potrzebna do ogrzania 1g substancji o 1K lub 1°C. Ciepło właściwe substancji c w dowolnej temperaturze określa się jako:
![]()
Stąd ciepło, jakie należy dostarczyć ciału o masie m i cieple właściwym c, ażeby podnieść jego temperaturę od T1 do T2, jest równe:
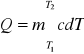
gdzie c jest funkcją temperatury. Dla zwykłych temperatur i dla zwykłych przyrostów temperatury, ciepło właściwe można uważać za wielkość stałą. Określając ściśle warunki otrzymujemy jednoznaczne wartości c, takie jak ciepło właściwe przy stałym ciśnieniu cp, ciepło właściwe przy stałej objętości cv itp.
Ciepłem właściwym molowym Cn nazywamy ilość ciepła ΔQ potrzebną do ogrzania jednego mola substancji o jeden stopień. Dla n moli gazu ogrzanego o ΔT przy stałej objętości ΔQ= n Cv ΔT. Ciepło to zostaje zużyte na wzrost energii wewnętrznej U:
![]()
(1)
Dla n moli gazu ogrzanego przy stałym ciśnieniu ![]()
. Ponieważ podczas przemiany izobarycznej objętość gazu przy ogrzaniu rośnie, to gaz wykonuje pracę. Ciepło ΔQ dostarczane podczas ogrzewania układu jest więc zużyte nie tylko na zmianę temperatury, ale i na wykonanie pracy ![]()
(bo ![]()
). Zgodnie z I zasadą termodynamiki:
![]()
(2)
Zakładając, że w obu procesach ΔT jest takie same, otrzymujemy, że i ΔU są równe. Porównując (1) i (2) otrzymujemy:
![]()
. (3)
Zgodnie z klasyczną kinetyczno- molekularną teorią dla gazów doskonałych (zasada ekwipartycji energii), wartości molowych Cp i Cv zależą od ilości stopni swobody i związanych z ruchem postępowym i rotacyjnym cząsteczek gazu:
![]()
, ![]()
![]()
(4)
(Zaniedbano tu stopnie swobody związane z oscylacjami atomów w cząsteczce[6]). Dla wszystkich gazów jednoatomowych otrzymujemy:
![]()
![]()
![]()
(5)
W naszym doświadczeniu badanym gazem jest powietrze, które jest mieszaniną cząsteczek jedno- dwu- i trzyatomowych. Ilościowo dominują molekuły dwuatomowe, które mają, poza trzema stopniami swobody związanymi z ruchem postępowym, dodatkowe dwa stopnie swobody związane z ruchem obrotowym. Dla powietrza otrzymujemy więc następujące przybliżone wartości teoretyczne:
![]()
![]()
![]()
(6)
Wzory (4), (5), (6) są zgodne ze wzorem (3) otrzymanym na gruncie termodynamiki fenomenologicznej.
Barometr rtęciowy - przyrząd do pomiaru ciśnienia atmosferycznego. Jest to długa szklana rura wypełniona rtęcią, następnie odwrócona i zanurzona w naczyniu z rtęcią. Przestrzeń ponad słupem rtęci zawiera wyłącznie parę rtęci, której ciśnienie w temperaturach normalnych jest tak małe, że może być pominięte.
Manometr otwarty - przyrząd do pomiaru ciśnienia względnego. Składa się on z rurki w kształcie litery U zawierającej ciecz, przy czym jedno ramię jest otwarte (a więc na ciecz działa ciśnienie atmosferyczne), podczas gdy drugie połączone jest z układem(zbiornikiem), którego ciśnienie p chcemy zmierzyć
p - p0 = ρgh
Ciśnienie względne p - p0 jest więc proporcjonalne do różnicy wysokości słupów cieczy w obu ramionach manometru. Gdy naczynie zawiera gaz znajdujący się pod wysokim ciśnieniem, w rurce używa się cieczy o dużej gęstości takiej jak rtęć, można używać także wody, ale tylko wtedy gdy mamy do czynienia z niskimi ciśnieniami gazu.
II - PRZYRZĄDY:
Butla o pojemności ok. 20l uszczelniona korkiem i zaopatrzona w kran pozwalający na wymianę powietrza z otoczeniem, pompka, manometr wodny, barometr rtęciowy.
III - PRZEBIEG POMIARU I OPIS PROCESÓW ZACHODZĄCYCH W BADANYM UKŁADZIE
Badanym gazem w tym eksperymencie jest powietrze. Poddajemy je kolejnym przemianom podczas których zmieniają się ciśnienie p, temperatura T i objętość właściwa v. Schematyczny wykres tych przemian przedstawia rysunek:
Wykres p-V
B
p1
C
ciśnienie |
p2 E
A
po D
V1 V2
V- objętość właściwa
Odczytałam wartość ciśnienia atmosferycznego p0 na barometrze rtęciowym znajdującym się w pracowni.
Przez otwarcie kranu K wyrównałam ciśnienie w zbiorniku z ciśnieniem atmosferycznym.
Za pomocą pompki zwiększyłam ciśnienie w zbiorniku do wartości na jaką pozwalał manometr. Wpompowując do naczynia powietrze dokonujemy adiabatycznego sprężania gazu. Na wykresie p-V procesowi temu odpowiada odcinek adiabaty A-B. Ponieważ przy sprężaniu wykonujemy pracę, nad układem wzrasta ciśnienie i temperatura gazu.
Odczekałam kilka minut na wyrównanie temperatury w butli z temperaturą otoczenia - przemiana izochoryczna. Procesowi temu na wykresie odpowiada odcinek izochory B-C. Stan układu po tej przemianie, (pkt C) oznaczono jako p1 i V1, temperatura równa się temperaturze otoczenia T0. Odczytałam i zapisałam poziomy wody w manometrze h1, h2 w mmH2O.
Otworzyłam kran K na okres 2-3 sekund, tak aby ciśnienie w zbiorniku wyrównało się z ciśnieniem otoczenia - adiabatyczne rozprężenie gazu, odcinek C-D na wykresie. Ciśnienie wyrównuje się z ciśnieniem otoczenia p0, spada temperatura i zmienia się objętość gazu, którą w stanie D na wykresie oznaczono przezV2. Stany C i D są związane z równaniem adiabaty
p1V1κ = p0V2κ (7a)
czyli
(V1/V2) κ = p0/p1 (7b)
Ponownie odczekałam parę minut na wyrównanie temperatury w butli z temperaturą otoczenia - przemiana izochoryczna. Odczytałam i zapisałam poziomy wody w manometrze h3, h4. Proces ten na wykresie opisuje odcinek izochory D-E. Stan układu w punkcie E oznaczono przez p2 i V2 , zaś temperatura jest równa temperaturze T0. Ponieważ w stanach E i C temperatury są takie same, to można odpowiadające im na wykresie punkty połączyć odcinkiem izotermy E-C i są związane równaniem
p2V2 = p1V1 (8a)
czyli
(V1/V2) = (p2/p1) (8b)
Wstawiając (8b) do(7b) otrzymujemy
(p2/p1) κ = (p0/p1) (9)
Logarytmując obie strony powyższego równania:
κ ln(p2/p1) = ln(p0/p1) (10)
stąd κ = ln(p0/p1) / ln(p2/p1) (11)
Z powyższych rozważań widać, że do wyznaczenia κ = Cp/Cv nie jest nam potrzebna znajomość temperatury, ani objętości. Wystarczy pomiar ciśnienia w trzech stanach C,D i E. Wyrażając wartości ciśnień p1, p2, p0 w milimetrach słupa wody ![]()
wyznaczamy ze wzoru:
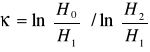
IV - OPRACOWANIE WYNIKÓW
H0=10451,48 mmH2O
Obliczam dla kolejnych pomiarów wartości: ![]()
, ![]()
, oraz
H1= H0 + dh12, H2 = H0 + dh34 (dane w tabeli)
![]()
obliczam ze wzoru: 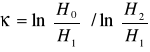
Tabela wyników:
nr |
dh12[mmH2O] |
H1 |
dh34[mmH2O] |
H2[mmH2O] |
|
|
|
1 |
406 |
10857,48 |
85 |
10536,48 |
1,27 |
0,05 |
0,0025 |
2 |
104 |
10555,48 |
21 |
10472,48 |
1,25 |
0,07 |
0,0049 |
3 |
423 |
10874,48 |
105 |
10556,48 |
1,34 |
0,02 |
0,0004 |
4 |
185 |
10636,48 |
43 |
10494,48 |
1,31 |
0,01 |
0,0001 |
5 |
573 |
11024,48 |
143 |
10594,48 |
1,34 |
0,02 |
0,0004 |
6 |
177 |
10628,48 |
41 |
10492,48 |
1,30 |
0,02 |
0,0004 |
7 |
665 |
11116,48 |
163 |
10614,48 |
1,33 |
0,01 |
0,0001 |
8 |
267 |
10718,48 |
65 |
10516,48 |
1,33 |
0,01 |
0,0001 |
9 |
420 |
10871,48 |
107 |
10558,48 |
1,35 |
0,03 |
0,0009 |
10 |
186 |
10637,48 |
46 |
10497,48 |
1,33 |
0,01 |
0,0001 |
suma |
x |
x |
x |
x |
13,15 |
- |
0,0198 |
Obliczam średnią arytmetyczną ze wzoru:
![]()
![]()
Średni błąd kwadratowy pojedynczego pomiaru obliczam ze wzoru:
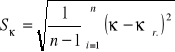
![]()
Średni błąd kwadratowy średniej arytmetycznej obliczam ze wzoru:
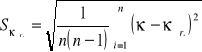
![]()
Wyznaczony doświadczalnie współczynnik ![]()
wynosi ![]()
.
V - WNIOSKI
Przybliżona wartość teoretyczna ![]()
dla powietrza wynosi 1,4, a więc odbiega od wyznaczonej przeze mnie wartości doświadczalnej ![]()
. Nieścisłości mogą wynikać z tego, że wartość κ jest wartością przybliżoną, ponadto wyznaczoną dla gazu doskonałego o cząsteczkach dwuatomowych. Obliczona przeze mnie wartość odnosi się do powietrza, czyli gazu rzeczywistego, a ponadto mogło się w nim znajdować więcej molekuł trzyatomowych, co mogło wpłynąć na wyniki pomiarów. Błędy mogą wynikać również z niedokładności aparatury pomiarowej.
VI - LITERATURA
1] T. Dryński, Ćwiczenia laboratoryjne z fizyki, str. 171-173.
2] R. Resnick, D. Halliday str. 522-523, 671, 674.
3] Instrukcja do ćwiczenia C-1
4] H. Szydłowski, Pracownia fizyczna, rozdz. I.
7
Wyszukiwarka
Podobne podstrony:
Zjawiska transportu, Studia, Fizyka, ćwiczenia
Spektrometr-76, Studia, Fizyka, Sprawozdania, 76a
06 Badanie zaleznosci sily, Księgozbiór, Studia, Fizyka
M 6 3, Politechnika Lubelska, Studia, Studia, fizyka
metoda Bragga, Księgozbiór, Studia, Fizyka
Sprawozdanie 75, budownictwo studia, fizyka
Wahadlo matematyczne, Studia, pomoc studialna, Fizyka- sprawozdania
WYZNACZENIE PRĘDKOŚCI DŹWIĘKU METODĄ SKŁADANIA DRGAŃ ELEKTRYCZNYCH 3, budownictwo studia, fizyka
Kopia cechowanie termopary, Księgozbiór, Studia, Fizyka, Biofizyka
fiele6, STUDIA, Fizyka, Fizyka(1)
Wahadło matematyczne, budownictwo studia, fizyka, wahadło matematyczne
modułu sztywności metodą dynamiczną, Budownictwo-studia, fizyka
J 5 1, Politechnika Lubelska, Studia, Studia, fizyka
Drgania har. -Aga, Księgozbiór, Studia, Fizyka
33, Studia, Fizyka, LABORKI, fizyka spr
ruch drgający, Budownictwo-studia, fizyka
więcej podobnych podstron