Wstęp teoretyczny 32
Cele ćwiczenia jest zbadanie właściwości fizycznych gazów, badane będą przemiany izobaryczne, izochoryczne oraz izotermiczne dla gazu.
Gaz - stan skupienia materii, w którym ciało fizyczne łatwo zmienia kształt i może zajmować całą dostępną mu przestrzeń.
Teoria kinetyczno-molekularna gazów wyjaśnia makroskopowe własności gazu na podstawie praw rządzących ruchem atomów, cząsteczek.
podstawowy wzór teorii kinetyczno-molekularnej gazów:
![]()
Nazwa ta bierze się stąd, że powyższy wzór wiąże parametry gazu: ciśnienie p oraz objętość V, a więc wielkości makroskopowe (mierzalne), z wielkościami mikroskopowymi: liczbą cząsteczek N i ich średnią energią kinetyczną EK.
Na podstawie tego wzoru możemy powiedzieć, że:
Ciśnienie gazu w zbiorniku zamkniętym jest wprost proporcjonalne do liczby cząsteczek w naczyniu i średniej energii kinetycznej cząsteczek, a odwrotnie proporcjonalne do objętości naczynia.
Średnia energia kinetyczna gazu.
Jest to suma energii kinetycznych każdej z poszczególnych cząsteczek gazu podzielona przez liczbę cząsteczek. Średnią energię kinetyczną możemy również wyrazić poprzez wzór:
![]()
![]()
T - temperatura w stopniach Kelvina
k - stała Boltzmana, która zawsze wynosi
Ważnym jest, by temperatura była zawsze w stopniach Kelvina, jeżeli mamy podaną ją w stopniach Celsjusza, zamieniamy ją wg wzoru:
gdzie t - temperatura w stopniach Celsjusza.
Wzór na średnią energię kinetyczną mówi nam, że jeżeli w jakiejś przemianie obserwujemy wzrost temperatury gazu, oznacza to wzrost średniej energii kinetycznej jego cząsteczek, a więc wzrost średniej prędkości ruchu postępowego.
Oczywiście dociekliwi również na końcu paragrafu znajdą link do zagadnienia omawiającego wyprowadzenie wzoru na średnią energię kinetyczną.
Zauważcie, że dwa podane przeze mnie wzory: podstawowy wzór teorii kinetyczno-molekularnej gazów oraz wzór na średnią energię kinetyczną gazu, można połączyć:
Równanie stanu gazu doskonałego
doskonałego prawa Charlsa i Gay-Lusaca oraz avogadra wynika, że objętość gazu jest proporcjonalna odpowiednio do jego temperatury bezwzględnej i liczby moli. Prawo Boyle'a mówi, że objętość jest odwrotnie proporcjonalna do ciśnienia. Łącząc te 3 zależności otrzymujemy: ![]()
czyli ![]()
Stała proporcjonalności w zależności ![]()
oznaczana przez R nosi nazwę stałej gazowej:
pV=nRT
Jest to równanie stanu gazu doskonałego. Gaz, który w dowolnych warunkach stosuje się do tej zależności nazywa się gazem doskonałym. Wartość R można wyznaczyć mierząc p, V, n i T dla próbki gazu pod niskim ciśnieniem (zachowującego się wówczas jak gaz doskonały) i podstawiając odpowiednie wartości do wzoru ![]()
wyrażając ciśnienie w atmosferach, a objętość w litrach, otrzymuje się R= 0,08205781 l* atm/(K*mol). Równanie stanu gazu doskonałego obejmuje zależności opisujące reakcję 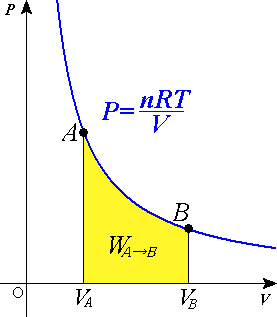
gazu doskonałego na zmiany ciśnienia, objętości, temperatury i liczby moli jego cząsteczek.
Prawo Boyle'a Mariotte'a
"W stałej temperaturze objętość V danej masy gazu jest odwrotnie proporcjonalna do jego ciśnienia p."
pV = const
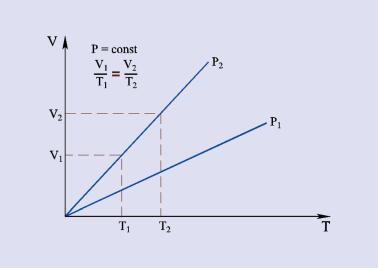
Prawo Charlesa
Pod stałym ciśnieniem objętość stałej ilości gazu zmienia się liniowo z temperaturą
![]()
![]()
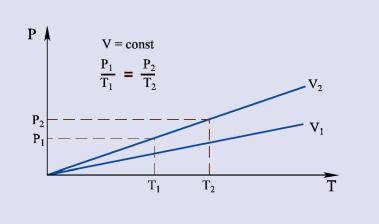
Przemiana izochoryczna
Prawo Gay-Lussaca
Objętość stałej masy gazy jest wprost proporcjonalna do temperatury w skali bezwzględnej
![]()
Dla dowolnej ilości moli gazu n w objętości V równanie van der Waalsa przybiera postać:
Równanie van der Waalsa stanowi na ogół bardzo dobre przybliżenie równania stanu gazów rzeczywistych, szczególnie dla dużych ciśnień i w temperaturach i ciśnieniu zbliżonych do parametrów skraplania gazu i powyżej.
Jeśli można zaniedbać oddziaływanie między cząsteczkami (a=0) i rozmiary samych cząsteczek (b=0) czyli traktować gaz jako gaz doskonały, to równanie van der Waalsa przechodzi w równanie Clapeyrona. Bardziej ogólnym równaniem opisujacym gazy rzeczywiste jest wirialne równanie stanu gazu.
Wyszukiwarka
Podobne podstrony:
Wstęp teoretyczny 68, Studia, Pracownie, I pracownia
Wstęp teoretyczny 57, Studia, Pracownie, I pracownia
Wstęp teoretyczny 11, Studia, Pracownie, I pracownia
Wstęp teoretyczny 74, Studia, Pracownie, I pracownia
Wstęp teoretyczny 76, Studia, Pracownie, I pracownia
Wstęp teoretyczny 1, Studia, Pracownie, I pracownia
Wstęp teoretyczny, Studia, Pracownie, I pracownia, 40 Temperaturowa zależność przenikalności magnety
Wstęp 59, Studia, Pracownie, I pracownia, 59 Rezonans elektromagnetyczny, Waldek
Zagadnienia teoretyczne, Studia, Pracownie, I pracownia, 59 Rezonans elektromagnetyczny, Marek
Wstęp 60, Studia, Pracownie, I pracownia, 60 Wyznaczanie współczynnika załamania światła ciał stałyc
Ćwiczenie 68, wstep teoretczny, Uniwersytet Wrocławski, Instytut Fizyki Doświadczalnej, I Pracownia
Wstęp 70, Studia, Pracownie, I pracownia, 70 Wyznaczanie stałej Plancka z charakterystyk optycznych
cw22 wstep, Studia, Pracownie, I pracownia, 22 Pomiar wilgotności powietrza atmosferycznego, 22 Piot
Zagadnienia teoretyczne 7, Studia, Pracownie, I pracownia, 7 Badanie drgań wahadła skrętnego {torsyj
cw68 wstep, Studia, Pracownie, I pracownia, 68 POMIAR PRZEPUSZCZALNOŚCI OPTYCZNEJ
O3-wstęp, Studia, Pracownie, I pracownia
Badanie wahadła skrętnego, Studia, Pracownie, I pracownia, 7 Badanie drgań wahadła skrętnego {torsyj
24 - oddane 21.04.2010, Studia, Pracownie, I pracownia, 24 Wyznaczenie mechanicznego równoważnika ci
więcej podobnych podstron