|
Akademia Górniczo-Hutnicza w Krakowie Wydział Górnictwa i Geoinżynierii |
|
Rok akademicki: 2015/2016
|
Przedmiot: Technologie oczyszczania wody i ścieków.
|
Rok studiów: II |
Data wykonania 09.12.2015
|
Temat: Chemiczne oczyszczenie ścieków - neutralizacja.
|
Prowadzący: dr Anna Hołda |
Data oddania 12.2015
|
Student: Daria Bidzińska |
Ocena: |
Cel ćwiczenia
Celem ćwiczenia było ustalenie warunków neutralizacji ścieków kwaśnych i zasadowych.
Wstęp teoretyczny
Odczyn pH roztworu - określa stężenie, a ściślej aktywność jonów wodorowych wyrażoną
w molach na dm3.
Tabela 2 - Skala odczynu pH wody.
Odczyn roztworu |
pH |
Kwaśny |
<7 |
Zasadowy |
>7 |
Obojętny |
7 |
Wody naturalne |
6,5-8,5 |
Przewodnictwo właściwe wody - zdolność roztworu wodnego do przewodzenia prądu elektrycznego. Definiowane jako odwrotność oporu właściwego słupa cieczy zawartego między elektrodami o powierzchni 1cm3 oddalonymi od siebie o 1cm.
G=1/R [mS/cm]
Tabela 3 - Skala czystości wody.
Stopień czystości wody |
Przewodnictwo [mS/cm] |
Ultra czysta - dejonizowana |
5,5-10·10-5 |
Destylowana |
0,1-1·10-4 |
Pitna |
5-50 |
Morska |
5000 |
Zasadowość - zdolność wody do zobojętniania mocnych kwasów mineralnych wobec umownych wskaźników. Właściwość tę nadają jej wodorowęglany, węglany oraz rzadziej wodorotlenki, borany, krzemiany i fosforany.
Alkaliczna - występuje dla pH>8,3
Całkowita - występuje dla pH> 4,6
Kwasowość - powodują: wolny CO2, kwasy mineralne i organiczne oraz produkty hydrolizy soli obecnych w wodzie.
Mineralna - występuje dla pH<4,6. Woda charakteryzuje się silnie korozyjnymi właściwościami wobec betonu i metali.
Ogólna - występuje dla 4,6<pH<8,3
Neutralizacja - proces chemicznego zobojętnienia ścieków o odczynie kwaśnym lub zasadowym, przy użyciu odpowiednich reagentów. Proces ten jest stosowany w zależności od potrzeb jako proces wstępny, wspomagający lub ostateczny przed odprowadzeniem ścieków do odbiornika i zależy od stężenia wolnych kwasów i zasad w ściekach, pH roztworu, rodzaju czynnika neutralizującego, intensywności mieszania w urządzeniach do neutralizacji.
Metodami neutralizacji ścieków są:
wzajemne wymieszanie ścieków kwaśnych z odpływami alkalicznymi tego samego lub najbliższego zakładu
wykorzystanie rezerwy neutralizacyjnej odbiornika dzięki istnieniu naturalnej zasadowości wody
saturacja ścieków zasadowych gazami spalinowymi lub kominowymi zawierającymi 10÷15% CO2 (rekarbonizacja)
przepuszczanie ścieków kwaśnych przez złoża zasadowe
dawkowanie różnych odczynników (NaOH lub Ca(OH)2)
Spis literatury i stron internetowych:
Technologia wody i ścieków - Ćwiczenia laboratoryjne, część 1 i 2 - Agnieszka Gala, Anna Hołda, Ewa Kisielowska, Anna Młynarczykowska, Stanisława Sanak-Rydlewska - Wydawnictwo AGH
Wykonanie ćwiczenia
Pomiar pH
W osobnych próbkach ścieku kwaśnego i zasadowego umieszczono pehametr (uprzednio skalibrowany roztworem buforowym), który dokonał pomiaru odczynu próbek.
Pomiar przewodnictwa
W osobnych próbkach ścieku kwaśnego i zasadowego umieszczono konduktometr (uprzednio skalibrowany roztworem wzorcowym 0,1M KCl), który dokonał pomiaru przewodności próbki.
Parametr |
Ściek zasadowy |
Ściek kwaśny |
pH [-] |
12,4 |
1,6 |
Przewodnictwo [mS/cm] |
18,1 |
31,2 |
Oznaczanie zasadowości alkalicznej wobec fenoloftaleiny
Do kolby stożkowej odmierzono 50cm3 próbki ścieku. Konicznym było rozcieńczenie próbki 20-krotnie. Dlatego w kolbie miarowej umieszczono 5cm3 próbki zasadowego ścieku, a pozostałą objętość (do 100 cm3) uzupełniono wodą destylowaną do kreski, do uzyskania menisku wklęsłego. Do próbki dodano 3 krople fenoloftaleiny i zaobserwowano odbarwienie na kolor różowy. Rozpoczęto oznaczanie zasadowości alkalicznej, miareczkując roztworem HCl o stężeniu 0,1M, aż do zaniku zabarwienia.
Wszystkie próbki poddano rozcieńczaniu i przebiegało to w opisany powyżej sposób. Oznaczanie wszystkich próbek powtórzono dwukrotnie do uzyskania dwóch zbliżonych wyników nie różniących się więcej niż o 0,2cm3 zużytego do miareczkowania titranta.
Oznaczanie zasadowości całkowitej wobec oranżu metylowego
W kolbie stożkowej umieszczono 5cm3 próbki zasadowego ścieku, rozcieńczonego 20-krotnie wodą destylowaną. Do próbki dodano 3 krople oranżu metylowego i zaobserwowano odbarwienie na kolor żółty. Rozpoczęto oznaczanie zasadowości całkowitej, miareczkując roztworem HCl o stężeniu 0,1M, aż do zmiany zabarwienia na pomarańczowy.
Oznaczanie kwasowości mineralnej
W kolbie stożkowej umieszczono 1cm3 próbki kwasowego ścieku, rozcieńczonego 100-krotnie wodą destylowaną. Do próbki dodano 3 krople oranżu metylowego i zaobserwowano odbarwienie na kolor pomarańczowy. Rozpoczęto oznaczanie kwasowości mineralnej, miareczkując roztworem NaOH o stężeniu 0,1M, aż do zmiany zabarwienia na żółty.
Oznaczanie kwasowości ogólnej
W kolbie stożkowej umieszczono 1cm3 próbki kwasowego ścieku, rozcieńczonego 100-krotnie wodą destylowaną. Do próbki dodano 3 krople fenoloftaleiny i nie zaobserwowano żadnego odbarwienia. Rozpoczęto oznaczania kwasowości ogólnej, miareczkując roztworem NaOH o stężeniu 0,1M, aż do zmiany zabarwienia na słabo różowy, utrzymujący się nie krócej niż 3 minuty.
|
Zasadowość alkaliczna |
Zasadowość całkowita |
Kwasowość mineralna |
Kwasowość ogólna |
CHCl [M] |
0,1 |
0,1 |
- |
- |
CNaOH [M] |
- |
- |
0,1 |
0,1 |
Vpróbki [cm3] |
5 |
5 |
1 |
1 |
V1 titranta [cm3] |
4,8 |
4,9 (przemiareczkowane) |
2,1 |
2 |
V2 titranta [cm3] |
4,6 |
4,6 |
2,6 (przemiareczkowane) |
2,1 |
V3 titranta [cm3] |
- |
4,5 |
2,1 |
- |
V średnie [cm3] |
4,7 |
4,55 |
2,1 |
2,05 |
Opracowanie wyników
Oznaczanie zasadowości alkalicznej Zp:
![]()
a - objętość 0,1M HCl użyta do miareczkowania badanej próbki ścieku, [cm3]
V - objętość próbki wody użytej do oznaczania, [cm3]
![]()
![]()
Oznaczanie zasadowości całkowitej Zm:
![]()
b - objętość 0,1M HCl użyta do miareczkowania badanej próbki ścieku, [cm3]
V - objętość próbki wody użytej do oznaczania, [cm3]
![]()
![]()
Oznaczanie kwasowości mineralne Kwn:
![]()
a - objętość 0,1M NaOH użyta do miareczkowania badanej próbki ścieku, [cm3]
V - objętość próbki wody użytej do oznaczania, [cm3]
![]()
![]()
Oznaczanie kwasowości ogólnej Kog
![]()
a - objętość 0,1M NaOH użyta do miareczkowania badanej próbki ścieku, [cm3]
V - objętość próbki wody użytej do oznaczania, [cm3]
![]()
![]()
Neutralizacja przez wzajemne wymieszanie ścieków kwaśnych i alkalicznych
Warunkiem prawidłowo przeprowadzonej neutralizacji jest uzyskanie założonej wartości odczynu ścieków. W tym celu należy połączyć 1 objętość ścieków kwaśnych z X objętościami ścieków alkalicznych, przy czym X oblicza się ze wzoru:
![]()
A - kwasowość mineralna ścieków kwaśnych Kwm [mval/dm3]
B - zasadowość alkaliczna (wobec fenoloftaleiny) ścieków alkalicznych Zp [mval/dm3]
C - ½ różnicy zasadowości ogólnej i zasadowości alkalicznej ścieków alkalicznych ½ (Zm-Zp) [mval/dm3]
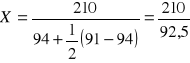
![]()
![]()
ścieków alkalicznych
W badaniach należy tak dobrać stosunek objętościowy ścieków alkalicznych i kwaśnych, żeby objętość mieszaniny była stała i wynosiła 0,5dm3.
Próbkę przygotowaną na podstawie obliczeń dokładnie wymieszano i przeniesiono do cylindra na 0,5dm3. Pobrać 10cm3 ścieków i oznaczono odczyn. Odczyn wyniósł 2,2, stąd wiadomo iż proces neutralizacji został przeprowadzony nieprawidłowo, gdyż próbka powinna mieścić się w zakresie 6,5-9.
Neutralizacja ścieków kwaśnych mlekiem wapiennym
Dawkę wodorotlenku wapnia potrzebną do neutralizacji ścieków kwaśnych można orientacyjnie ustalić na podstawie oznaczenia kwasowości ścieków surowych. Teoretyczna dawkę CaO obliczamy według wzoru:
![]()
A - kwasowość mineralna ścieków kwaśnych Kwm [mval/dm3]
B - ½ różnicy kwasowości ogólnej i mineralnej ścieków kwaśnych ½ (Kog-Kwm) [mval/dm3]
28 - przelicznik, 1mval CaO = 28mg CaO
![]()
![]()
Obliczenia wykonano, lecz doświadczenia nie przeprowadzano.
Neutralizacja ścieków kwaśnych wodorotlenkiem sodu
Dawkę wodorotlenku sodu potrzebną do neutralizacji ścieków kwaśnych można orientacyjnie ustalić na podstawie oznaczenia kwasowości ścieków surowych. Teoretyczna dawkę NaOH obliczamy według wzoru:
![]()
A - kwasowość mineralna ścieków kwaśnych Kwm [mval/dm3]
B - ½ różnicy kwasowości ogólnej i mineralnej ścieków kwaśnych ½ (Kog-Kwm) [mval/dm3]
40 - przelicznik, 1mval NaOH = 40mg NaOH
![]()
![]()
Obliczenia wykonano, lecz doświadczenia nie przeprowadzano.
Podsumowanie i wnioski
Po przeprowadzeniu wszelkich obliczeń wszystkie wyniki zestawiono w Tabeli 9.
Przewodność: Zgodnie z skalą czystości wody (Tabela 3) określanej na podstawie przewodności, stwierdzono, że badana próba wody, której przewodność wyniosła 0,226[mS/cm], jak i ścieku (1,395 [mS/cm]) znajdują się na pograniczu wody destylowanej
i pitnej.
pH: Odczyn pH próbki wody (8,07) mieści się w normie skali wód naturalnych. Ściek natomiast miał charakter silnie kwaśny (2,48).
Ponadto, zgodnie z Rozporządzeniem Ministra Środowiska z dnia 29 marca 2007 r.
w sprawie jakości wody przeznaczonej do spożycia przez ludzi, badana próbka spełnia wymogi, gdyż pH i przewodność mieszczą się w dopuszczalnych granicach: pH 6,5-9,5,
a przewodność do 2500 [mS/cm].
Zasadowość i kwasowość: Próbka wody analizowana była pod kątem zasadowości całkowitej
i kwasowości ogólnej, z czego wynika, że jej odczyn pH powinien znajdować się między 4,5,
a 8,3. Badanie pehametrem wykazało, że jest to prawda.
Próbka ścieku analizowana była pod kątem kwasowości mineralnej i kwasowości ogólnej, co potwierdza kwasowy charakter płynu.
Wszelkie niezgodności są wynikiem niedokładności i błędów pomiarów. Najbardziej narażone na błąd są metody, w których wykorzystywane są ludzkie zmysły, jak np. analiza miareczkowa i konieczność obserwowania zmiany barwy.
Wyszukiwarka
Podobne podstrony:
Neutralizacja, AGH, SEMESTR 3, TECHNOLOGIE OCZYSZCZANIA WODY I ŚCIEKÓW, Ćwiczenie 5
Bilans jonowy, AGH, SEMESTR 3, TECHNOLOGIE OCZYSZCZANIA WODY I ŚCIEKÓW, Ćwiczenie 3
Oznaczanie podstawowych parametrów wody i ścieków, AGH, SEMESTR 3, TECHNOLOGIE OCZYSZCZANIA WODY I Ś
1 - Oznaczanie podstawowych parametrów wody i ścieków, AGH, SEMESTR 3, TECHNOLOGIE OCZYSZCZANIA WODY
Metody Oznaczania Związków Nieorganicznych 3, AGH, SEMESTR 3, TECHNOLOGIE OCZYSZCZANIA WODY I ŚCIEKÓ
Warunki zaliczenia, AGH, SEMESTR 3, TECHNOLOGIE OCZYSZCZANIA WODY I ŚCIEKÓW
Technologie oczyszczania wody i ścieków - Tematy referatów, AGH, SEMESTR 3, TECHNOLOGIE OCZYSZCZANIA
Zasadowość-kwasowość-związki-twardość, AGH, SEMESTR 3, TECHNOLOGIE OCZYSZCZANIA WODY I ŚCIEKÓW
Wzór sprawozdania, AGH, SEMESTR 3, TECHNOLOGIE OCZYSZCZANIA WODY I ŚCIEKÓW
3 - Bilans jonowy wody, AGH, SEMESTR 3, TECHNOLOGIE OCZYSZCZANIA WODY I ŚCIEKÓW, Ćwiczenie 3
2006 06 08 Techn frezowania - zadanie, AGH, Semestr 8, Technologia wybranych elementów maszyn, cnc
6A, AGH, Semestr IV, TMM[Majkut,Felis], Ćwiczenia, projekty, projekty tmm, projekty tmm
biologiczne oczyszczanie ścieków, uniwersytet warmińsko-mazurski, inżynieria chemiczna i procesowa,
toś zerowka 2012 (58 pytań), Inżynieria Środowiska, 5 semestr, Technologie oczyszczania ścieków, wyk
Ścieki, Inżynieria Środowiska, 5 semestr, Technologie oczyszczania ścieków, wykłady, egzamin
toś zerowka 2012 (58 pytań z odp), Inżynieria Środowiska, 5 semestr, Technologie oczyszczania ściekó
TOSegzamin, Inżynieria Środowiska, 5 semestr, Technologie oczyszczania ścieków, wykłady, egzamin
Osad czynny-protokół, Ochrona Środowiska, semestr V, Oczyszczanie wody i ścieków II, Lab
więcej podobnych podstron