Łódź 7.12.2013r.
Wydział: BiNoŻ
Kierunek: Biotechnologia
nr indeksu:
15
ĆWICZENIE Nr 41
WYZNACZANIE MOLOWEGO PRZEWODNICTWA GRANICZNEGO
POLITECHNIKA ŁÓDZKA
2013
Zagadnienia teoretyczne
Przewodnictwem właściwym roztworu (κ) nazywamy przewodnictwo roztworu znajdującego się pomiędzy dwiema równoległymi elektrodami,
o powierzchni jednostkowej, odległymi od siebie o jednostkę długości.
Pomiar przewodnictwa elektrolitycznego przeprowadza się w specjalnym naczyńku z wtopionymi elektrodami platynowymi, pokrytymi czernią platynową, do którego wlewa się badany roztwór. Naczyńko takie przyłącza się do konduktometru, który jest zautomatyzowanym mostkiem Wheatstone'a.
Przewodnictwo właściwe κ, związane ze zmierzonym przewodnictwem roztworu w naczyńku G:
gdzie k - stała naczyńka [l/s]
Ponieważ odległość między elektrodami (l) i powierzchnia (s) są z reguły trudne do określenia, stałą naczyńka wyznaczamy doświadczalnie. W tym celu napełnia się naczyńko roztworem wzorcowym, najczęściej 0,01 n roztworem chlorku potasowego i wykonuje pomiar przewodnictwa Gw.
Stała naczyńka będzie więc równa:
gdzie κw - przewodnictwo właściwe roztworu wzorcowego
Gw - przewodnictwo roztworu wzorcowego
Przewodnictwem molowym elektrolitu nazywamy przewodnictwo takiej objętości roztworu, w której zawarty jest 1 mol elektrolitu i która znajduje się pomiędzy równoległymi elektrodami, oddalonymi od siebie o jednostkę długości:
gdzie c - stężenie molowe badanego roztworu
Dla rozcieńczonych roztworów mocnych elektrolitów (są to elektrolity, które w roztworach o skończonych stężeniach są całkowicie zdysocjowane, a
w fazie stałej sieć krystaliczną tworzą jony, a nie obojętne cząsteczki) przewodnictwo λ można opisać empiryczną zależnością Kohlrauscha:
,
przewodnictwa pozwalającą na obliczenie granicznego przewodnictwa molowego λ0 (czyli molowego nieskończenie rozcieńczonego roztworu elektrolitu, które zależy od temperatury, rodzaju rozpuszczalnika i ruchliwości jonów) metodą ekstrapolacji.
Dla elektrolitów słabych (są to elektrolity, które w roztworze dysocjują na jony tylko częściowo, a wiązanie w niezdysocjowanej cząsteczce nie ma charakteru jonowego) taka ekstrapolacja nie jest możliwa i przewodnictwo graniczne oblicza się jako sumę przewodnictw molowych:
Można natomiast obliczyć stopień dysocjacji elektrolitu:
![]()
oraz (korzystając z prawa rozcieńczeń Ostwalda) stałą dysocjacji:
WYKONANIE ZADANIA:
Obliczenia:
Na podstawie dokonanych pomiarów można obliczyć stałą naczyńka konduktometrycznego, użytego do ćwiczenia:
![]()
κKCl - przewodnictwo właściwe roztworu wzorcowego KCl = 0,1413 Sm-1 (w 25 °C)
ΓKCl - zmierzone przewodnictwo roztworu wyjściowego KCl = 1,673 mS
Znając wartość stałej naczyńka konduktometrycznego obliczam przewodnictwa właściwe i molowe badanych roztworów:
Przewodnictwo właściwe:
- dla roztworu NaCl, o stężeniu 0,05 mol/dm3
![]()
- dla roztworu NaCl, o stężeniu 0,025 mol/dm3
![]()
- dla roztworu NaCl, o stężeniu 0,010 mol/dm3
![]()
- dla roztworu NaCl, o stężeniu 0,0050mol/dm3
![]()
- dla roztworu NaCl, o stężeniu 0,0025 mol/dm3
![]()
Przewodnictwo molowe:
- dla roztworu NaCl, o stężeniu 0,05 mol/dm3
![]()
- dla roztworu NaCl, o stężeniu 0,025 mol/dm3
![]()
- dla roztworu NaCl, o stężeniu 0,010 mol/dm3
![]()
- dla roztworu NaCl, o stężeniu 0,0050mol/dm3
![]()
- dla roztworu NaCl, o stężeniu 0,0025 mol/dm3
![]()
W ten sposób policzone wartości przewodnictw właściwych i molowych badanych roztworów zamieszczono w tabeli:
stężenie roztworu (mol/dm3) |
przewodnictwo |
przewodnictwo właściwe κ [Sm-1] |
przewodnictwo molowe λ [Sm2mol-1] |
|||
|
Γ1 |
Γ2 |
Γ3 |
Γsr |
|
|
0,0025 |
0,47 |
0,48 |
0,48 |
0,476 |
0,0420 |
0,016080 |
0,0050 |
0,72 |
0,74 |
0,73 |
0,73 |
0,0616 |
0,012330 |
0,0100 |
1,36 |
1,37 |
1,37 |
1,36 |
0,0115 |
0,011500 |
0,025 |
3,05 |
3,07 |
3,07 |
3,063 |
0,2587 |
0,010350 |
0,05 |
5,70 |
5,71 |
5,71 |
5,706 |
0,4819 |
0,009638 |
Na podstawie tych wartości można wyznaczyć przewodnictwo graniczne tego elektrolitu, sporządzając wykres zależności λ = f(c1/2) i drogą ekstrapolacji znajdując szukaną wartość graniczną.
Molowe przewodnictwo graniczne odczytane z równania krzywej metodą ekstrapolacji liniowej wynosi 0,0156 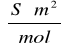
.
Wartość teoretyczna oczytana z tablic wynosi
![]()
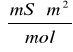
= 0,012375 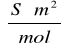
Wnioski
Celem tego ćwiczenia było wyznaczenie molowego przewodnictwa granicznego dla danego roztworu. Moim roztworem badanym był roztwór NaCl. Roztworem wzorcowym do wyznaczenia stałej naczynka konduktometrycznego był KCl. Wszystkie pomiary wykonane były w temperaturze 250C.
Wartość granicznego przewodnictwa molowego literaturowego dla NaCl wynosi 0,012375 S*m2*mol-1, natomiast wartość dla tego granicznego przewodnictwa w przeprowadzonym przeze mnie doświadczeniu wyniosła 0,0156 S*m2*mol-1. Wynika stąd, że moje doświadczenie zostało przeprowadzone z niewielkim błędem aczkolwiek wyniki można uznać za poprawne. Na małą dokładność wyniku mogły się złożyć następujące czynniki: niedokładne przemycie naczynka po badaniu roztworu wzorcowego, niedokładne sporządzenie roztworów o zadanych stężeniach.
Wyszukiwarka
Podobne podstrony:
sprawozdanie nr 27, CHEMIA FIZYCZNA SPRAWKA 4 SEM
Sprawozdanie - Nr 11, Chemia fizyczna AGH laborki, lab 11
Politechnika Łódzka Sprawozdanie nrE Chemia Fizyczna
Politechnika Łódzka Sprawozdanie nr8 Chemia Fizyczna
41, CHEMIA FIZYCZNA SPRAWKA 4 SEM
Chemia fizyczna - sprawozdanie (4-1)(7), WNOŻ, Semestr 3, Chemia Fizyczna
SPRAWOZDANIE 8.5, STUDIA, semestr 4, Chemia fizyczna, Laboratorium
Sprawozdanie nr 6, Studia, Chemia, chemia7
chemia fizyczna cw 13, Politechnika Wrocławska inżynieria materiałowa 2012, chemia fizyczna lab
Sprawozdanie nr 8, Studia, Chemia, chemia7
Moje sprawozdanie nr 45 koniec bez wnioskow, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
Moje sprawozdanie nr 45 koniec + wnioski, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
sprawozdanie 45miki, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
SPRAWOZDANIE 54, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
sprawozdanie 44, Politechnika Łódzka Biotechnologia, Chemia fizyczna LABORKI
Zagadnienia teoretyczne 41, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, semestr
więcej podobnych podstron