|
|
Energia jonizacji - jest to najmniejsza energia potrzebna do oderwania jednego elektronu od atomu lub cząsteczki.
Powinowactwo elektronowe - energia wydzielana w wyniku pobrania elektronu podczas tworzenia jonu ujemnego.
Elektroujemność - zdolność do przyciągania elektronu przez atom, grupę lub cząsteczkę.
Reguła oktetu (wg Kossela) w procesie tworzenia wiązań chemicznych atom oddaje, pobiera lub uwspólnia taką liczbę elektronów aby uzyskać 8 elektronów (oktet) (strukturę najbliższego gazu szlachetnego)
Wiązanie chemiczne - wzajemne oddziaływanie rdzeni atomowych i elektronów walencyjnych tworzących cząsteczkę chemiczną lub makroskopowy zbiór cząsteczek.
Rodzaje wiązań (jonowe, kowalencyjne, metaliczne)
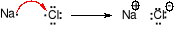
Wiązanie jonowe (heteropolarne) zostaje utworzone w wyniku przejścia elektronu (elektronów) walencyjnych z atomów pierwiastka elektrododatniego do atomów pierwiastka elektroujemnego. Atomy pierwiastków tworzących wiązanie jonowe muszą różnić się znacznie elektroujemnością. Utworzone jony wiążą siły elektrostatyczne, każdy jon dodatni otoczony jest przez jony ujemne i na odwrót. Dla związku w którym występują wiązania jonowe nie można podać wzoru sumarycznego, a jedynie zgodnie z umową podaje się wzór empiryczny.
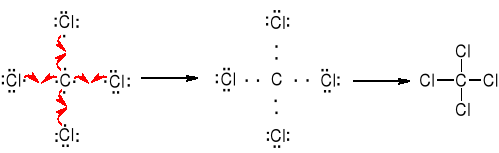
Związki z wiązaniami jonowymi są ciałami stałymi o wysokich temperaturach topnienia i wysokich temperaturach wrzenia. Rozpuszczają się w rozpuszczalnikach polarnych, słabo lub wcale w niepolarnych. Reakcje między związkami z wiązaniami jonowymi przebiegają natychmiastowo.Wiązanie kowalencyjne (homopolarne) polega na utworzeniu wspólnej pary elektronowej (wiązanie pojedyncze), ewentualneie dwóch (wiązanie podwójne) lub trzech par elektronowych (wiązanie potrójne) przez dwa atomy, z których każdy dostarcza na utworzenie dubletu (lub dubletów) taką samą liczbę niesparowanych elektronów.
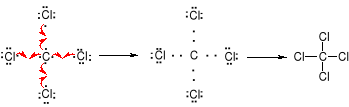
Związki w których występują wiązania kowalencyjne charakteryzują się niskimi temperaturami topnienia i temperaturami wrzenia, rozpuszczają się w rozpuszczalnikach niepolarnych. Między cząsteczkami z wiązaniami kowalencyjnymi występują słabe oddziaływania van der Waalsa. Reakcje pomiędzy związkami z wiązaniami kowalencyjnymi polegają na rozerwaniu istniejących wiązań i wytworzeniu nowych. Szybkości tych reakcji można mierzyć eksperymentalnie.
Wiązanie koordynacyjne (semipolarne) jest szczególnym przypadkiem wiązania kowalencyjnego. Polega ono na utworzeniu wspólnej pary elektronowej z elektronów pochodzących od jednego atomu (donora). Drugi atom (akceptor) tymi elektronami uzupełnia własną powłokę walencyjną do oktetu.
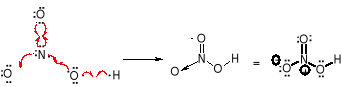
Po utworzeniu wiązania koordynacyjnego, jest ono nieodróżnialne od wiązania kowalencyjnego. O obecności wiązania koordynacyjnego może świadczyć para ładunków formalnych pojawiająca się we wzorze konstytucyjnym. Ładunek formalny oblicza się ze wzoru: q=new-nep-1/2.neb (q=new-nep -nb)
new - liczba elektronów walencyjnych
nep - liczba elektronów na atomie
neb - liczba elektronów tworzących wiązanie; nb liczba utworzonych wiązań przez atom
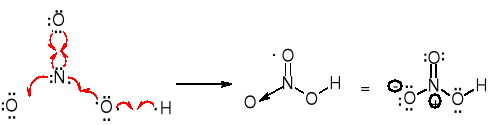
W kwasie azotowym(V) dla atomu azotu: 5-0-1/2.4=+1; 5-0-4=+1; dla atomu tlenu: 6-6-1= -1
Wiązania wodorowe powstaje pomiędzy atomem wodoru (kowalencyjnie związanym z atomem fluoru, tlenu lub azotu) a innym, małym, silnie elektroujemnym atomem (fluor lub tlen). Obecność wiązań wodorowych powoduje podwyższenie temperatury wrzenia (woda - siarkowodór, alkohol etylowy - eter dimetylowy). Wiązania wodorowe powodują, że zmierzona masa cząsteczkowa jest wielokrotnością masy cząsteczkowej obliczonej ze wzoru sumarycznego. Pozorny wzrost masy cząsteczkowej powoduje właśnie podwyższenie temperatury wrzenia.
Elektroujemność niektórych grup:
-CH3 |
2,30 |
-CJ3 |
2,50 |
-CH2Cl |
2,47 |
-CBr3 |
2,57 |
-CHCl2 |
2,63 |
-CF3 |
3,29 |
-CCl3 |
2,79 |
|
|
Elektroujemność węgla w zależności od hybrydyzacji:
Csp3 < Csp2 < Csp
Efekt indukcyjny różnych grup odniesiony do wodoru:
+I |
-I |
||
-O- |
-NR3+ |
-COOH |
-OR |
-COO- |
-SR2+ |
-F |
-COR |
-CR3 |
-NH3+ |
-Cl |
-SH |
-CHR2 |
-NO2 |
-Br |
-SR |
-CH2R |
-SO2R |
-I |
-OH |
-CH3 |
-CN |
-OAr |
-C≡CR |
|
-SO2Ar |
-COOR |
Ar |
Efekt mezomeryczny najczęściej spotykanych grup:
+M |
-M |
||
-O- |
-NH-COR |
-NO2 |
-CO-H |
-S- |
-O-COR |
-CN |
-CO-R |
-NR2 |
-SR |
-SO3H |
-NO |
-NHR |
-SH |
-SO2-OR |
-Ar |
-NH2 |
-F > -Cl > -Br > -I |
-COOH |
|
-OR |
-CH3 (hiperkonjugacja) |
-COOR |
|
-OH |
|
-CONH2 |
|
Reguły stosowane przy rysowaniu struktur granicznych:
Struktury graniczne mogą różnić się tylko rozmieszczeniem elektronów, lecz nie położeniem jąder atomowych. Jeżeli położenia jąder nie są takie same, to mamy do czynienia z izomerią albo tautomeria, a nie mezomerią.
W mezomerii uczestniczą tylko takie struktury, które mają taką samą ilość par elektronów. Jeżeli rozpatruje się mezomerię rodników, to ilość niesparowanych elektronów musi być taka sama we wszystkich strukturach granicznych.
Struktury graniczne powinny mieć taką samą, albo porównywalną energię. Te struktury, których wzory pozwalają przypuszczać, że odpowiadają im o wiele większe zawartości energii niż dla pozostałych struktur, nie biorą udziału w mezomerii lub ich udział w rzeczywistej budowie cząsteczki jest znikomy.
Mezomeria występuje tylko w tych cząsteczkach, lub w częściach cząsteczek, które mają budowę płaską. W mezomerii biorą udział tylko elektrony należące do tych atomów, które leżą w jednej płaszczyźnie. Znaczne wychylenie atomów z płaszczyzny utrudnia nakładanie się orbitali p.
Gdy dwa atomy różniące się elektroujemnością połączone są wiązaniem , atom o większej elektroujemności może ściągnąć do siebie ruchliwe elektrony :
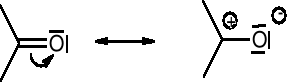
Wolna para elektronowa atomu związanego wiązaniem σ z innym atomem o hybrydyzacji sp lub sp2 jest zdelokalizowana:
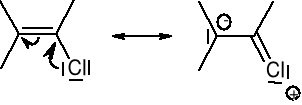
Wiązania rozdzielone jednym wiązaniem σ są ze sobą sprzężone i ulegają delokalizacji:
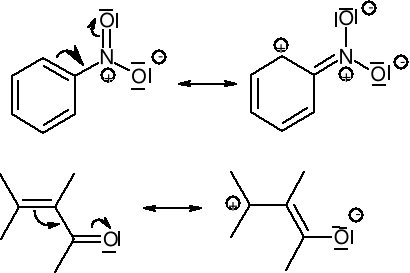
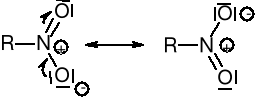
W chemii organicznej zdecydowana większość reakcji przebiega z udziałem atomu węgla (na atomie węgla). Pojęcie kwasów i zasad wg Bröensteda, Lewisa czy Pearsona nie było zbyt dogodne, ponieważ w żaden sposób moc zasad (kwasów) nie przekładała się na szybkość reakcji. Wprowadzono więc podział substancji reagujących na nukleofile i elektrofile.
Nukleofilem - nazywa się jony ujemne, cząsteczki obojętne, które dysponują wolnymi parami elektronów i podczas reakcji ze związkami organicznymi atakują te atomy węgla, przy których występuje zmniejszona gęstość elektronów. Odczynniki nukleofilowe są zasadami zarówno według definicji Bröensteda, jak i Lewisa.
Elektrofilem - nazywa się jony dodatnie i obojętne cząsteczki, które są zdolne do przyłączenia pary elektronów i podczas reakcji ze związkami organicznymi atakują te atomy węgla, przy których występuje zwiększona gęstość elektronów. Odczynniki elektrofilowe są kwasami Lewisa.
Miarą nukleofilowości odczynnika są stałe szybkości ich reakcji z cząsteczką substratu. O nukleofilowości odczynnika decydują dwa czynniki: zasadowość i polaryzowalność.
Nukleofilowość wzrasta wraz z zasadowością np.: R-O- >OH- >C6H5-O- >CH3COO- >H2O
Reguła ta spełniona jest również w wielu jonach, w których ładunek ujemny znajduje się na atomie tego samego okresu: R3C- >R2N- >RO- >F-
W śród chlorowców charakter nukleofilowy wzrasta od jonu fluorkowego do jonu jodkowego, a więc odwrotnie do zasadowości. Nukleofilowość zależy tu bardziej od polaryzowalności: I- >Br- >Cl- >F-
Energia dysocjacji niektórych wiązań (rozpad homolityczny):
Wiązanie |
Energia dysocjacji KJ/mol |
Wiązanie |
Energia dysocjacji KJ/mol |
Wiązanie |
Energia dysocjacji KJ/mol |
CH3-H |
436 |
CH3-F |
453 |
F-F |
126 |
CH3-CH2-H |
411 |
CH3-Cl |
352 |
Cl-Cl |
243 |
(CH3)2CH-H |
394 |
CH3-Br |
293 |
Br-Br |
193 |
(CH3)3C-H |
381 |
CH3-I |
235 |
I-I |
151 |
CH2=CH-H |
453 |
CH3-CH2-Cl |
348 |
H-F |
570 |
CH2=CH2-CH2-H |
323 |
(CH3)2CH-Cl |
306 ? |
H-Cl |
432 |
C6H5-CH2-H |
327 |
(CH3)3C-Cl |
314 |
H-Br |
369 |
|
|
CH2=CH-Cl |
436 |
H-I |
298 |
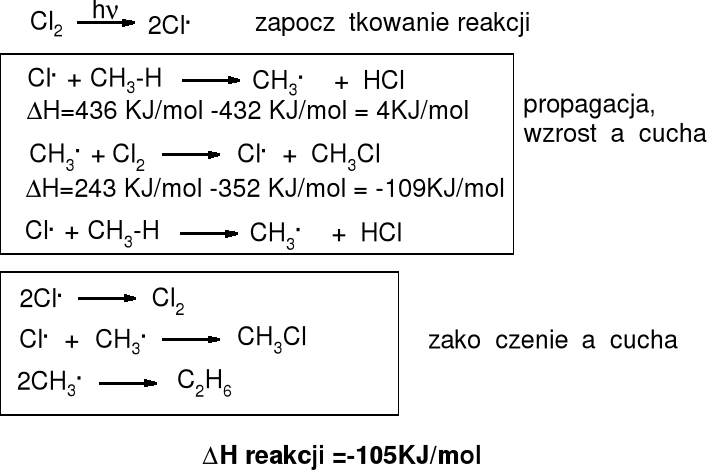
Mechanizm i entalpia reakcji chlorowania alkanów |
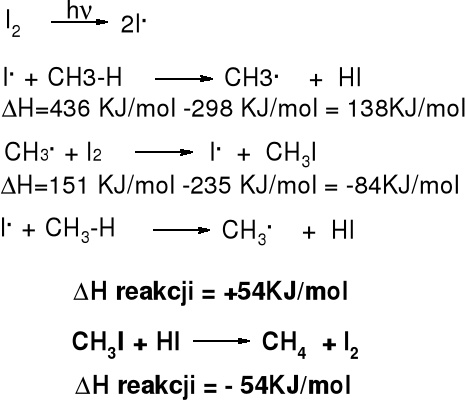
Mechanizm i entalpia reakcji jodowania alkanów |
|
|
Obliczanie składu mieszaniny poreakcyjnej w reakcji halogenowania alkanów:
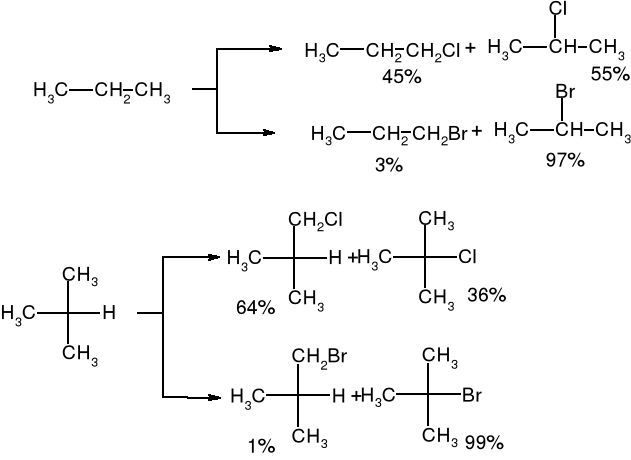
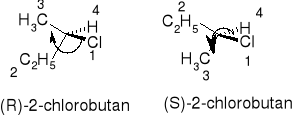
IZOMERIA OPTYCZNA
|
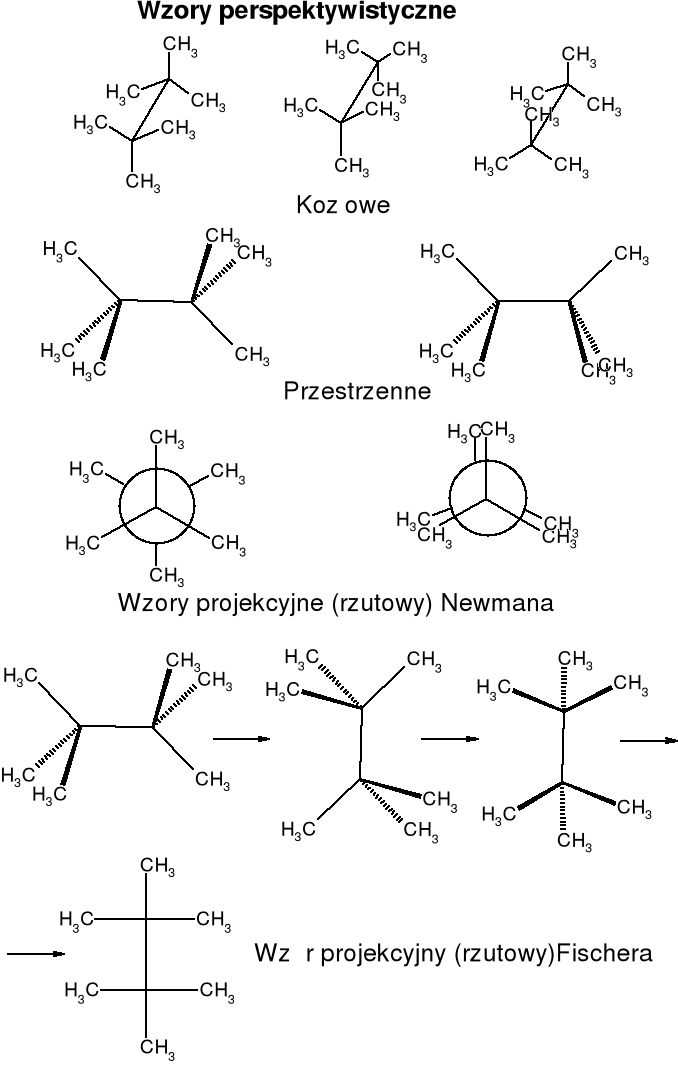
Konstytucja związku o danym wzorze cząsteczkowym określa sposób i kolejność powiązania atomów. Konfiguracja cząsteczki o określonej konstytucji jest to rozmieszczenie w przestrzeni jej atomów, bez uwzględnienia różnych położeń atomów wynikających z rotacji wewnętrznej wokół jednego lub kilku wiązań pojedynczych. Stereoizomerami są takie izomery, które mają identyczną konstytucję, a różnią się jedynie przestrzennym rozmieszczeniem atomów. Chiralność jest to właściwość przedmiotu polegająca na tym, że jest on nieidentyczny ze swym odbiciem lustrzanym. Dotyczy tylko indywidualnych cząsteczek, a ściślej ich modeli. Jeżeli cząsteczka związku nie posiada takich elementów symetrii jak: płaszczyzna symetrii (m), środek symetrii (i) (może posiadać oś dwukrotną), to jest chiralna. Enancjomery są to cząsteczki stanowiące nawzajem odbicie lustrzane. Asymetria oznacza brak elementów symetrii. Każda cząsteczka asymetryczna jest chiralna. Diastereoizomery - stereoizomery nie będące enancjomerami. Konformacja cząsteczki o określonej strukturze jest to różne rozmieszczenie jej atomów w przestrzeni, wynikające z rotacji wewnętrznej wokół wiązań pojedynczych. |
Reguły pierwszeństwa: 1 Atomy o wyższych liczbach atomowych mają pierwszeństwo przed atomami których liczby atomowe są niższe. W przypadku izotopów o pierwszeństwie decyduje liczba masowa. 2 Jeżeli zastosowanie reguły 1 dla atomów bezpośrednio związanych z centrum asymetrii nie pozwala jednoznacznie uporządkować podstawników wg pierwszeństwa, to rozpatruje się następne z kolei atomy, nie połączone bezpośrednio z centrum asymetrii.
3 Sposób postępowania wobec grup zawierających wiązania podwójne i potrójne polega na zamianie wiązania wielokrotnego na dwa lub trzy wiązania pojedyncze. Np. grupę >C=O traktuje się jako Konfiguracja absolutna (konfiguracja RS):
|
|
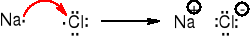
Wyszukiwarka
Podobne podstrony:
Chemia org - Węglowodany, Studia WNOŻ SGGW 2008-2013, Inżynierskie, Semestr 2, Chemia organiczna, Ró
Chemia org - Egzamin 09.2004, Studia WNOŻ SGGW 2008-2013, Inżynierskie, Semestr 2, Chemia organiczna
Rys tech - Sprawko - Stopy żelaza(2), Studia WNOŻ SGGW 2008-2013, Inżynierskie, Semestr 1, Rysunek t
INFAQ, Studia WNOŻ SGGW 2008-2013, Inżynierskie, Semestr 1, Technologia informacyjna
Przechowalnictwo cz1 - Test, Studia WNOŻ SGGW 2008-2013, Inżynierskie, Semestr 7, Przechowalnictwo
Zakres materiału na 1 kolokwium-podstawy rysunku technicznego, Studia WNOŻ SGGW 2008-2013, Inżyniers
Sprawko - Mleko 1, Studia WNOŻ SGGW 2008-2013, Inżynierskie, Semestr 5, Technologia mleka
Poznanie w filozofii oznacza tyle co, Studia WNOŻ SGGW 2008-2013, Inżynierskie, Semestr 1
zboza.pyt.wd, Studia WNOŻ SGGW 2008-2013, Inżynierskie, Semestr 5, Technologia zbóż
Postęp i Zagrożenia Zbóż - Wykłady, Studia WNOŻ SGGW 2008-2013, Inżynierskie, Semestr 7, Postęp i za
Przechowalnictwo cz2 - Test(1), Studia WNOŻ SGGW 2008-2013, Inżynierskie, Semestr 7, Przechowalnictw
Zagadnienia prawne, Studia WNOŻ SGGW 2008-2013, Inżynierskie, Semestr 7, Ochrona środowiska
Mięso wykłady, Studia WNOŻ SGGW 2008-2013, Inżynierskie, Semestr 5, Technologia mięsa
Reakcje charakterystyczne kationĂlw, STUDIA IŚ, semestr II, Chemia
reakcje w roztworach wodnych, Studia, I rok, I rok, I semestr, Chemia I
program zajęć 2008, WNoŻ, Studia inżynierskie, II semestr, Chemia organiczna
Laboratorium 4 Reakcje utleniania i redukcji, Studia - Inżynieria materiałowa, Chemia ogólna i nieor
REAKCJA SYNTEZY JĄDROWEJ, Studia, chemia jądrowa
Jądrowe reakcje-onet wiem, Studia, chemia jądrowa
więcej podobnych podstron