15 I 2010 sala 201 WIL - kolokwium zaliczeniowe
LABORATORIA:
dr inż. T. Stryszewska
dr inż. E. Stanaszek - Tomal
dr inż. A. Kozak
mgr inż. T. Zdeb
DO ZALICZENIA PRZEDMIOTU:
- obecność na wykładach
- kolokwium (test jednokrotnego wyboru lub test uzupełnień)
- obecność na laboratoriach
- kartkówki
- sprawozdania (za termin oddania 2.0 lub 5.0; za merytoryczność treści)
- możliwość jednej poprawki w czasie sesji
MATERIAŁY:
Czarnecki, Broniecki, Henning „Chemia w budownictwie”
Broniewski, Fiertak : „Chemia budowlana. Materiały pomocnicze do ćwiczeń laboratoryjnych” wyd. PK
Inne podręczniki
Tablice i kalendarze chemiczne
WYKŁAD 1
18.09.2009r
Chemia - nauka o substancjach, ich strukturze, własnościach i reakcjach, w których zachodzi
przemiana jednej substancji w drugą
Budowa chemiczna - jako wyznacznik własności technicznych materiałów budowlanych; rodzaje ciał i stanów materii występujących w tych materiałach
Chemiczne metody oceny przydatności materiałów budowlanych
Chemiczne uwarunkowania przydatności gruntów budowlanych oraz chemiczne metody ich poprawy
Zagrożenia i uciążliwości w odniesieniu do wykonawcy i użytkownika materiałów i obiektów budowlanych
Zagrożenia środowiska spowodowane przez przemysł materiałów budowlanych
Zjawiska i przemiany natury chemicznej występujące podczas:
Wytwarzania materiałów i elementów budowlanych oraz utylizacji odpadów na cele budowlane
Stosowanie materiałów budowlanych przy wznoszeniu budowli i wykonywaniu robót wykończeniowych
Użytkowanie obiektu
Sytuacji awaryjnych
MATERIAŁ
EKOLOGIA TECHNOLOGIA
KONSTRUKCJA
PRZEJŚCIE OD ELEMENTU BUDOWY MATERII DO ELEMENTU BUDOWLI
Atom
podstawowy Cząsteczka
element struktury zbiór atomów odpowiednio
uporządkowanych i
powiązanych ze sobą
Pierwiastek
Substancja prosta,
zbiór atomów tego Związek chemiczny
samego rodzaju substancja złożona, zbiór
cząsteczek tego samego
rodzaju
MATERIAŁY BUDOWLANE LUB SKŁADNIKI MATERIAŁÓW BUDOWLANYCH
Układy fizyczne jednorodne |
Układy fizyczne niejednorodne |
||
SZKLIWA |
KRYSZTAŁY |
KOLOIDY |
KOMPOZYTY |
skład: FAZA BEZPOSTACIOWA |
skład: FAZA KRYSTALICZNA |
ZAWARTOŚĆ FAZY ROZPROSZONA |
ROZPROSZENIE MAKROSKOPOWE |
elementy budowlane, prefabrykaty
materiały o odpowiednio ukształtowanej geometrii
ustrój budowlany
odpowiednio dobrany zbiór elementów
konstrukcja, obiekt budowlany
odpowiednio dobrany zbiór ustrojów i elementów budowlanych
Wiązanie chemiczne - wynik charakterystycznego oddziaływania występującego pomiędzy
różnymi indywiduami chemicznymi; należy traktować jako pewien
nowy jakościowo stan wytwarzający się pomiędzy tymi indywiduami.
SIŁY SPÓJNOŚCI W TWORZYWACH
SIŁY KOHEZJI (KOHEZJA) SIŁY ADHEZJI (ADHEZJA)
SIŁY WEWNĄTRZCZĄSTECZKOWE - SIŁY I RZĘDU
(międzyatomowe wiązania chemiczne)
jonowe (heteropolarne, elektrowalencyjne)
atomowe (homeopolarne, kowalencyjne)
koordynacyjne (semipolarne, donorowo-akceptorowe)
metaliczne
SIŁY MIĘDZYCZĄSTECZKOWE - SIŁY II RZĘDU
siły Van der Waalsa
mostki wodorowe (protonowe)
SIŁY WEWNĄTRZCZĄSTECZKOWE - wiązanie jonowe
(heteropolarne biegunowe, elektrowalencyjne)
- tworzenie wiązania jest wywołane dążeniem układu do zmniejszenia posiadanej energii całkowitej
- według bezwymiarowej skali Paulinga Δ Eu > 1,9
- wiązanie chemiczne polegające na elektrostatycznym oddziaływaniu pomiędzy jonami wytworzonymi w wyniku całkowitego przejścia elektronów walencyjnych od atomu mniej elektroujemnego (jon dodatni) do atomu bardziej elektroujemnego (jon ujemny)
A0 + B0 A+B-
e- jon + jon -
- wiązanie bezkierunkowe
- występują między atomami i pierwiastkami chętnie oddającymi lub przyłączającymi elektrony, czyli pierwiastkami grupy IA, IIA oraz VIA i VIIA, z reguły metalami i niemetalami
- przykłady: NaCl, MgCl2 , CuCl2 , CaO, MgO, Al2O3 , AlCl3
- zniszczenie wiązania polega na zniszczeniu siły między jonami
- jest to wiązanie z grupy mocnych Ed ≈ 400÷800 kJ/mol np.: Na-Cl = 774 kJ/mol; Ca-O = 564 kJ/mol; Al-O = 364 kJ/mol
1 mol = 6,02*1023 cząsteczek - liczba Avogadro
- tworzą materiały o strukturze kryształu jonowego
- materiał jest silnie upakowany ze względu na silnie oddziaływanie elektrostatyczne między jonami, przy czym jony tego samego znaku nie stykają się ze sobą
Kryształy jonowe - bryły, charakteryzują się tzw. liczbą koordynacyjną równą ilości jonów
otaczających w najbliższym sąsiedztwie kation lub anion; zależy od
promieni sąsiadujących jonów(anionów i kationów); (bliski kontakt
atomów, najsilniej upakowany - gęstość)
WŁAŚCIWOŚCI SUBSTANCJI O WIĄZANIACH JONOWYCH
(heteropolarnych, elektrowalencyjnych)
- posiadają budowę krystaliczną
- w stanie stopionym przewodzą prąd elektryczny, w stanie stałym są praktycznie nieprzewodzące
- topią się w temperaturze zwykle > 773 K (> 500°C)
- są bardzo twarde ( na statyczne i powierzchniowe działania)
- są bardzo kruche ( podatne na działania dynamiczne)
- rozpuszczają się w rozpuszczalnikach POLARNYCH, a powstałe roztwory dobrze przewodzą prąd elektryczny
- w roztworach wodnych dysocjują (rozpadają się) na jony
SIŁY WEWNĄTRZCZĄSTECZKOWE - wiązania atomowe
(homeopolarne, kowalencyjne)
- powstanie wiązania jest wynikiem tworzenia się wspólnych par elektronów między atomami
- liczba wiązań kowalencyjnych, które może utworzyć atom jest równa liczbie niesparowanych elektronów walencyjnych; wspólne pary elektronów tworzą się z elektronów o przeciwnej wartości magnetycznej spinowej liczby kwantowej
- występują jako wiązania atomowe czyste lub spolaryzowane
- wg bezwymiarowej skali Paulinga; wiązania atomowe czyste: Eu > 1,9 i Δ Eu < 0,4; wiązania atomowe spolaryzowane: Eu > 1,7 i Δ Eu < 0,4 ÷ 1,7
Wiązania atomowe czyste:
- najczęściej powstają w wyniku łączenia się atomów tych samych pierwiastków
- siła wiązania pochodzi od wspólnej pary elektronów pochodzących od obydwu pierwiastków tworzących cząsteczkę
- wg bezwymiarowej skali Paulinga Eu > 1,9 i Δ Eu < 0,4
A• + B• A : B

- wiązanie ukierunkowane, symetryczne, równoległe do linii łączącej środki atomów, kierunkowa natura uwspólnionych elektronów jest przedstawiona jako kąt wiązania (diament 109,5°)
- występują między atomami pierwiastków o dużej, ale zbliżonej elektroujemności, z reguły niemetalami
- przykłady: diament, german;
gazy: H2 , H:H, H-H; O2 , O::O, O=O, N2 , N≡N
- jest to wiązanie z grupy mocnych Ed ≈ 250 ÷ 1000 kJ/mol np. N≡N = 946 kJ/mol; wszystkie wartości dotyczą wiązań wielokrotnych
Wiązania atomowe spolaryzowane:
- najczęściej powstają w wyniku przesunięcia wspólnej pary elektronów w kierunku atomu bardziej elektroujemnego
- w wyniku utworzenia się wiązania atomowego spolaryzowanego powstają cząstki o budowie DIPOLOWEJ
- wg bezwymiarowej skali Paulinga Eu > 1,7 i Δ Eu = 0,4 ÷ 1,7
A• + B• A : B

B - b. elektroujemny
DIPOL ELEKTRYCZNY - moment dipolowy
Dipol elektryczny - jest układem dwóch ładunków punktowych o tych samych wartościach
bezwzględnych ale przeciwnych znakach (+q, -q), oddalonych od siebie
na pewną odległość „l”
DIPOL ELEKTRYCZNY - elektryczny moment dipolowy
Elektryczny moment dipolowy - jest to wektorowa wielkość fizyczna charakteryzująca dipol
elektryczny. Powstaje w wyniku asymetrii rozkładu ładunku
elektrycznego.
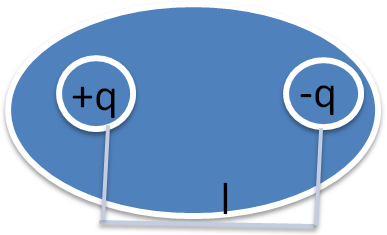
μ - moment dipolowy [Cm] (kulombometr, ma być nad literką strzałka)
q - wartość dodatniego ładunku elektrycznego [C]
l - odległość między środkami ciężkości ładunków elektrycznych [m]
WYKŁAD 2
19.09.2009r
- wiązanie ukierunkowane, niesymetryczne
- powstają pomiędzy atomami pierwiastków elektrododatnich - niemetali niewiele różniących się elektroujemnością
- przykłady: H2O, HCl
- posiadają liczby koordynacyjne ≤ 4
- jest to wiązanie z grupy średniomocnych Ed ≈ 350 ÷ 500 kJ/mol
- krańcowym przypadkiem tego wiązania jest wiązanie jonowe
- w stanie stałym posiadają budowę kryształu cząsteczkowego lub kowalencyjnego
- w stanie stałym i ciekłym NIE przewodzą prądu elektrycznego - niemetale (wyjątek grafit)
- kryształy cząsteczkowe (molekularne) mają stosunkowo niską temperaturę topnienia i wrzenia
- kryształy kowalencyjne są trwałe, odporne mechanicznie, mają wysoką temperaturę wrzenia
- rozpuszczają się w rozpuszczalnikach NIEPOLARNYCH (podobne rozpuszcza podobne)
- w roztworach wodnych NIE dysocjują na jony
- reagują zwykle wolno
SIŁY WEWNĄTRZCZĄSTECZKOWE - wiązanie koordynacyjne
(semipolarne, donorowo-akceptorowe)
- odmiana wiązania koordynacyjnego, utworzona między donorem (dawcą elektronów), a akceptorem (biorcą elektronów) tzn. że wspólna para elektronów pochodzi tylko od jednego z atomów
A: + B A : B
donor akceptor
- w danym jonie, między atomami tego samego typu mogą występować wiązania koordynacyjne obok wiązań innego typu
- przykłady: jony: H3O+ , SO42- , NH4+ ;
jony kompleksowe Al[(OH)6]3-
H3O+ H O H
H
Ö
+
H
H H
SIŁY WEWNĄTRZCZĄSTECZKOWE - wiązania metaliczne
- są charakterystyczne dla metali
- tworzą je dodatnio naładowane rdzenie atomowe, rozmieszczone w węzłach sieci krystalicznej oraz przemieszczające się między nimi zdelokalizowane elektrony tzw. chmurę elektronową (gaz elektronowy) czyli uwspólnione elektrony z ostatniej powłoki walencyjnej
- wg bezwymiarowej skali Paulinga Eu < 1,7 i Δ Eu = 0
- rdzenie atomowe
- wiązanie bezkierunkowe, zdelokalizowane ( co wynika z dążności do najlepszego upakowania struktury metalu)
- występują między atomami metali, ale także w graficie
- zniszczenie wiązania polega na zniszczeniu elektrostatycznego oddziaływania jonów dodatnich i ujemnych (sił Coulomba) oraz sił odpychania dodatnio naładowanych jonów metalu
-posiadają duże liczby koordynacyjne : 8 lub 12
- jest to wiązanie z grupy średniomocnych Ed = 250 ÷ 500 kJ/mol
WŁAŚCIWOŚCI:
- w stanie stałym posiadają budowę krystaliczną
- przewodzą prąd elektryczny
- przewodzą ciepło
- są połyskliwe
- są ciągliwe
- są kowalne (formowanie)
- nie występują w nich kruche pękania (gdyż jest bufor w postaci chmury elektronowej)
SIŁY MIĘDZYCZĄSTECZKOWE - siły Van der Waalsa
- słabe oddziaływania chwilowych dipoli elektrycznych w sąsiednich cząsteczkach
- występują we wszystkich stanach skupienia i na pograniczu tych stanów
- są addytywne
- mogą decydować o właściwościach mechanicznych materiałów budowlanych, jeśli ich sumaryczna wartość przekracza moc wiązania wewnątrzcząsteczkowego
- przykład: przyczepność powłoki lakierniczej do metalu, wiązanie między poszczególnymi materiałami w laminatach
- jest to wiązanie słabe Ed ≈ 25 kJ/mol
- siły orientacji: oddziaływania elektrostatyczne różnoimiennych ładunków (efekt Keesoma) Ed ≈ 25 kJ/mol
- siły indukcji: oddziaływanie cząstki obdarzonej ładunkiem elektrycznym na cząstkę o symetrycznym rozkładzie ładunku (efekt Debey'a) Ed ≈ 10 kJ/mol
- siły dyspersji: oddziaływanie między trwałym dipolem a wzbudzonym dipolem lub między dwoma wzbudzonymi rezonansem elektrycznym dipolami (efekt Londona) Ed < 10 kJ/mol
Orientacji:
jon dipol trwały jon dipol trwały
dipol trwały dipol trwały dipol trwały dipol trwały
Indukcji:
jon cząsteczka obojętna jon dipol indukowany
dipol trwały cząsteczka obojętna dipol trwały dipol indukowany
Dyspersji:
cząsteczki obojętne
- oddziaływanie Van der Waalsa wzrasta proporcjonalnie do zdolności atomu do polaryzacji (niesymetryczności rozłożenia elektronów wokół jądra atomu) - wzrasta ze wzrostem liczby atomowej pierwiastka
- oddziaływanie Van der Waalsa wzrasta ze wzrostem ciśnienia, a maleje ze wzrostem temperatury co powodowane jest wzrostem energii wewnętrznej na poziomie atomów, jonów i cząsteczek
- oddziaływanie Van der Waalsa maleje proporcjonalnie do odległości między jądrami poszczególnych cząsteczek według zależności : F = 1/rn
F - siła oddziaływania [N]
r - odległość pomiędzy jądrami poszczególnych cząstek [m]
n = 2 - oddziaływanie jon - jon
n = 3 - oddziaływanie jon - dipol trwały
n = 4 - oddziaływanie dipol trwały - dipol trwały
n = 5 - oddziaływanie jon - dipol indukowany
n = 6 - oddziaływanie dipol trwały - dipol indukowany
- kształtują takie właściwości KOHEZYJNE jak: temperatura wrzenia, temperatura topnienia, ciepło właściwe, gęstość, twardość, lepkość, napięcie powierzchniowe cieczy. Właściwości te ROSNĄ wraz ZE WZROSTEM sił Van der Waalsa
- są PRZYCZYNĄ ZJAWISK takich jak: adhezja, adsorpcja, zwilżanie, asocjacja cząstek cieczy, tworzenie się koloidów
SIŁY MIĘDZYCZĄSTECZKOWE - wiązania wodorowe
(mostki wodorowe, mostki protonowe)
- specyficzne oddziaływanie między cząsteczkami tego samego rodzaju lub jako dodatkowe wiązanie wewnątrzcząsteczkowe
- słabe oddziaływanie polegające na przyciąganiu elektrostatycznym między atomem wodoru, a atomem nukleofilowym zawierającym wolne pary elektronów (szczególna odmiana sił Van der Waalsa)
- występują wtedy, gdy wodór jest połączony wiązaniem atomowym spolaryzowanym z pierwiastkiem o dużej elektroujemności np. tlenem posiadającym jakby „nadmiar ujemnego ładunku” prowadząc do deformacji jego powłoki elektronowej w wyniku silnego oddziaływania elektrostatycznego
- przy powstaniu wiązania wodorowego, istniejące wiązanie kowalencyjne ulega częściowemu osłabieniu
- „chmura elektronowa” wodoru zostaje „podzielona” między dwie komórki
- donorami wodoru mogą być: grupa wodorotlenkowa (-OH), grupa aminowa (-NH2), grupa tiolowa (-SH)
- akceptorami mogą być atomy: tlenu, azotu, siarki, chloru, fluoru oraz innych niemetali
- w zależności od długości wiązania rozróżnia się wiązania słabsze (dł. wiązania > 3*10-7 m) i silniejsze (dł. wiązania około 1,5*10-7 m)
- związki zawierające wiązanie wodorowe występują we wszystkich stanach skupienia
Występowanie większej liczby wiązań wodorowych powoduje
Tt kryształu - ↑
Tw cieczy - ↑
ciepło parowania - ↑
- przykłady: woda, ciekły amoniak, tworzywa sztuczne, otrzymywane na drodze poliaddycji (EP, PU) kwasy karboksylowe, białka, kwasy nukleinowe
- jest to wiązanie słabe Ed = 20 ÷ 40 kJ/mol
ZJAWISKO ASOCJACJI:
Asocjacja - łączenie się cząstek w większe aglomeraty
Mechanizm - wewnątrz cząsteczki, atom wodoru oddaje e- tworząc wiązanie atomowe. Proton H+ ma zdolność do wnikania w powłoki elektronowe pierwiastków silnie elektroujemnych
Asocjacja H2O - wewnątrz cząsteczki H2O występuje wiązanie atomowe spolaryzowane w kierunku O2-, wtedy H+ staje się protonem mającym możliwość wnikania w powłoki elektronowe O2- należącego do sąsiedniej cząsteczki.
Asocjat H2O
100°C - (H2O)6 - 6 cząsteczek połączonych H+
20°C - (H2O)75 - 75 cząsteczek połączonych H+
0°C - (H2O)90 - 90 cząsteczek połączonych H+
Efekt asocjacji (wyższa) Tw - ↑; (wyższe) ciepło parowania cp - ↑
Własności fizykochemiczne wybranych wodorków niemetali
Nazwa związku |
wzór |
Mcz [unit] |
Tw [C] |
cp [kJ/mol] |
Asocjacja |
Metan (niepolarny) |
CH4 |
16,04 |
-161 |
8,2 |
Brak |
4-wodorek Si (niepolarny) |
SiH4 |
32,09 |
-11 |
13,0 |
Brak |
Amoniak (polarny) |
NH4 |
17,03 |
-33 |
23,3 |
Występuje |
3-wodorek P (polarny) |
PH3 |
34,00 |
-98 |
14,6 |
Brak |
Woda (polarna) |
H2O |
18,02 |
100 |
40,7 |
Duża |
Siarkowodór (polarny) |
H2S |
34,08 |
-60 |
18,7 |
Brak
|
Fluorowodór (polarny) |
HF |
20,01 |
28 |
25,6 |
Występuje |
Chlorowodór (polarny) |
HCl |
36,46 |
-85 |
16,1 |
Brak |
Efekt asocjacji makrocząstek poliamidów (nylon,stylon)
ft - ↑
polimer |
symbol |
Mcz [unit] |
ft [MPa] |
asocjacja |
poliamid |
PA |
25000 |
60 |
Duża |
polichlorek winylu + 4% plastyfikatora |
PCV |
Ok. 90000 |
40 |
Słaba |
polichlorek winylu + 30% plastyfikatora |
PE |
Ok. 90000 |
12 |
Brak |
polietylen |
PE |
200000 |
15 |
Brak |
Siły spójności w materiałach budowlanych
70 - 80% materiałów budowlanych stanowią metale, ich sole i tlenki
20 - 30% materiałów budowlanych stanowią materiały organiczne (drewno, związki wielocząsteczkowe, polimery)
- metale: stal, żeliwo, metale nieżelazne
siły I rodzaju: metaliczne
siły II rodzaju: brak
cechy:
- wysoki połysk
- brak przezroczystości
- wysokie przewodnictwo ciepła i elektryczności
- kowalność, plastyczność, wytrzymałość mechaniczna
- sole metali: w spoiwach budowlanych: wapniowe sole SiO42- , CO32- , SO42- , materiały kamienne; związki ilaste
siły I rodzaju: jonowe i atomowe spolaryzowane, koordynacyjne
siły II rodzaju: w spoiwach i materiałach ilastych: wodorowe
cechy:
- wysoka temperatura wrzenia
- po przekroczeniu sił niszczących rozsypują się
- zwilżalność i rozpuszczalność w wodzie
- w środowisku wodnym mogą podlegać korozji
- po rozpuszczeniu przewodzą prąd elektryczny
- sole metali: ceramika i szkło
siły I rodzaju: jonowe i atomowe spolaryzowane (brak wiązania koordynacyjnego - ulega zniszczeniu w procesach wytwarzania materiałów budowlanych)
siły II rodzaju: praktycznie brak
cechy:
- wysoka temperatura wrzenia
- po przekroczeniu sił niszczących rozsypują się
- zwilżalność i bardzo słaba rozpuszczalność w wodzie
- ceramika w środowisku wodnym może podlegać korozji
-tlenki metali: w spoiwach budowlanych : CaO, MgO, Al2O3
siły I rodzaju: atomowe silnie spolaryzowane
siły II rodzaju: wodorowe
cechy:
- wzrost temperatury topnienia
- wzrost twardości
- niższa rozpuszczalność w wodzie
- spadek reaktywności chemicznej
- w stanie rozpuszczonym znikome przewodzenie prądu elektrycznego
- materiały organiczne: drewno, bitumy, tworzywa sztuczne
siły I rodzaju: atomowe, uzupełniająco atomowe spolaryzowane
siły II rodzaju: siły Van der Waalsa, dodatkowo w drewnie i tworzywach sztucznych - mostki wodorowe
cechy:
- całkowity brak rozpuszczalności w wodzie
- brak reaktywności chemicznej z wodą → odporność korozyjna
- wytrzymałość mechaniczna zależna od rodzaju i ilości sił II rzędu (rodzaju)
- słaba odporność na działanie temperatury
- właściwości termomechaniczne zależne od temperatury
- ciecze polarne i niepolarne
- ciecze polarne - woda, stopiona leizna bazaltowa T> 1500°C
siły I rodzaju: atomowe spolaryzowane
zasadniczy typ sił spójności: siły orientacji i indukcji (Van der Waalsa) oraz mostki wodorowe
- ciecze niepolarne: benzyna
siły I rodzaju: atomowe
zasadniczy typ sił spójności: siły dyspersji (Van der Waalsa)
- stopy soli i stopy metali
- stopy soli: stopione glinokrzemiany w magmie skorupy ziemskiej T > 1400°C; stopione glinokrzemiany w piecu cementowym T > 1400°C
siły I rodzaju: jonowe
zasadniczy typ sił spójności: elektrostatyczne oddziaływanie jon-jon
- stopy metali: miedź T > 1083°C
siły I rodzaju: metaliczne
zasadniczy typ sił spójności: metaliczne
μ = q*l
atomowe
spolaryzowane
atomowe
spolaryzowane
koordynacyjne
+
+
+
+
+_++
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
- +
+
-
+
+
- +
- +
+
-
+
-
- +
- +
+ - +
- + -
+
+
- +
- +
- +
+ - +
- + -
+
-
+
-
-
+
+ - +
- + -
+ - +
- + -
rezonans elektryczny
+ - +
- + -
- +
Wyszukiwarka
Podobne podstrony:
wykďz˝ad 7, PK, CHM -Chemia budowlana, wykład
wyklad 6, PK, CHM -Chemia budowlana, chemia wyklady
test chemia2, PK, CHM -Chemia budowlana, marcin, Chemia Budowlana, fwd sciagi chemia
Zagadnienia Chemia, PK, CHM -Chemia budowlana, chemia e-mail
korozja bet, PK, CHM -Chemia budowlana, chemiaa
Test z CHEMII, PK, CHM -Chemia budowlana, chemia-internet
Matryca to, PK, CHM -Chemia budowlana, chemia EGZAMIN
sciaga chemia 1, PK, CHM -Chemia budowlana, chemia EGZAMIN
test chemia3, PK, CHM -Chemia budowlana, marcin, Chemia Budowlana, fwd sciagi chemia
sciaga chemia, PK, CHM -Chemia budowlana, chemia EGZAMIN
Tabelka2, PK, CHM -Chemia budowlana, chemia-internet
KOLOID, PK, CHM -Chemia budowlana, chemia e-mail
ROZTWORY I KOLOIDY, PK, CHM -Chemia budowlana, chemia e-mail
test chemia2, PK, CHM -Chemia budowlana, marcin, Chemia Budowlana, fwd sciagi chemia
Zagadnienia Chemia, PK, CHM -Chemia budowlana, chemia e-mail
ciaga z wykladow, budownictwo pk, sem 1, chemia
więcej podobnych podstron