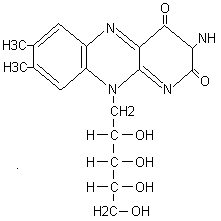
I. PRZENOSZENIE INFORMACJI HORMONALNEJ DO KOMÓRKI - może zachodzić w dwojaki sposób:
Hormon wiąże się z receptorem śródkomórkowym (hor. nierozpuszczalne w wodzie o budowie steroidowej np.; hor. płciowe, kory nadnerczy, kalcytrioloraz hor, tarczycy np.; T3,T4). Hormony te wiążą się z białkiem nośnikowym co zapewnia transport oraz przedłuża okres półtrwania. Po przeniknięciu hor. przez błonę komórki, wiąże się on z receptorem cytoplazmatycznym lub jądrowym. Kompleks hormon-receptor spełnia funkcję przekaźnika śródkomórkowego. Połączenie to ma charakter wiązania kowalencyjnego a stabilizują je wiązania hdrofobowe. Z chwilą przejścia kompleksu hormon-receptor do jądra kom. Następuje jego aktywacja dzięki której staje się zdolny do związania z chromatyną. Hormon wpływa na transkrypcję określonego genu i w konsekwencji na biosyntezę swoistego białka.
Hormon wiąże się z receptorem błony plazmatycznej. Rozpoczęcie reakcji biologicznej następuje przez związanie hormonu z receptorem powierzchni błony komórkowej. Hormony te działają na chromatynę za pomocą wtórnych przekaźników (informatorów II, mediatorów)np.; cAMP, fosfatydyloinozytol, jony wapniowe. Pierwszym przekaźnikiem jest hormon. Wyróżniamy trzy szlaki:
szlak cyklazy adenylanowej - (przykłady hormonów; ACTH, wazopresyna, katecholaminy, kalcytonina, kortykoliberyna, folitropina, glukagon, hCG, LH, LPH, MSH, PTH, TSH, acetylocholina, angiotensynaII, opioidy, somatostatyna) cAMP powstaje z ATP pod wpływem cyklazy adenylanowej. W procesie aktywacji lub inhibicji cyklazy adenylowej pośredniczą białka G. GS-białko pobudzające, Gi- białko hamujące, które współdziałają z białkami receptorowymi R. Rs- receptor stymulatorowy (pobudzający), Ri- receptor inchibitorowy (hamujący). Cząsteczka może więc ujawniać 2 przeciwstawne sobie reakcje biologiczne, zależnie od połączenia jej z receptorem Rs bądź Ri.
szlak fosfolipidowy - fosfolipidy inozytolowe występują po wewnętrznej stronie bł. plazmatycznej. Charakteryzują się one wysoką zawartością reszt kw. stearynowego i arachidonowego. Są to np.; PI, PIP, PIP2.Acetylocholina, ADH, katecholaminy- łącząc się z receptorami błonowymi- stanowią sygnały dla białek G. Białko G aktywuje enzym fosfolipazę C, która hydrolizuje PIP2 na dwa przekaźniki wtórne: DAG oraz IP3. IP3 oddziałuje na kanały wapniowe. Jony Ca2+ występują tu w charakterze trzeciego przekaźnika, który pobudza metabolizm komórkowy, aktywując kinazy białek zależne od kolmoduliny. Inaktywacja IP3 zachodzi przy udziale fosfatazy odszczepiającej hydrolitycznie kolejne grupy fosforanowe, aż do wolnego inozytolu, który może być ponownie wykorzystany. DAG jest swoistym aktywatorem kinazy białek C. Głównym zadaniem kinazy białek C jest uczynnianie fosfatazy IP3 przekształcającej go w IP2. inaktywacja DAG może zachodzić w dwojaki sposób: -drogą przekształcenia DAG w kwas fosfatydowy; - na skutek hydrolizy DAG z uwolnieniem kwasów tłuszczowych.
szlak wapniowy - hormony powodują wzrost stężenia wapnia w komórce. Dłuższe działanie powoduje zwiększenia napływu do komórki jonów Ca2+ lub ograniczenie ich wypływu. Podstawowym białkiem, pełniącym rolę receptora tych jonów w komórce, jest kalmodulina. Wiąże się ona odwracalnie z wapniem. Kalmodulina ulega zmianą konformacyjnym. Oprócz kalmoduliny komórka zawiera jeszcze amfitropowe białka błonowe(klapaktyny,lipomoduliny, kallektryny, endoneksyny, kalcimedyny itd...)
II. ODDYCHANIE KOMÓRKOWE
ŁAŃCUCH ODDEHOWY - w przenoszeniu elektronów od substratu do tlenu uczestniczą dehydrogenazy, współdziałające z nukleotydami nikotynamidowymi, flawinowymi oraz z liponianem, a poza tym flawoproteiny pośredniczące, ubichinon oraz układ cytochromowy.
DEHYDROGENAZY NIKOTYNAMIDOWE - jest ich około 200, przenoszą odwracalnie 1 atom H i jeden elektron na utlenioną postać NAD+ lub NADP+ z uwolnieniem protonu
DEHYDROGENAZY WSPÓŁDZIAŁAJĄCE Z FLAWINAMI - niekiedy zawierają niehemowe żelazo. Należą tu: dehydrogenaza NADH, dehydrogenaza bursztynianowa, dehydrogenaza cholinowa, acylo-CoA
DEHYDROGENAZY WSPÓŁDZIAŁAJĄCE Z LIPONIANEM - odpowiadają za oksydacyjną dekarboksylację 2-oksokwasów. Zredukowany liponian jest następnie utleniany przez dehydrogenazę liponianową, która współdziała z FAD.
FLAWOPROTEINY POŚREDNICZĄCE (METALOFLAWOPROTEINY) - zawierają barwniki flawinowe, często żelazo niehemowe, siarkę a niekiedy cynk. Uczestniczą w działaniu dehydrogenaz NADH powodując ich utlenianie, współdziałają także z flawoproteinami przenoszącymi elekrtony. Uczestniczą w przejściu dwuelektronowych reakcji utleniania w reakcje jednoelektronowe.
UBICHINON (KOENZYM Q) - jest syntetyzowany z tyrozyny, stanowi ostatnie ogniwo łańcucha oddechowego, do którego dochodzą atomy wodoru. Zbliżony budową do wit E i K. Jest ruchomym elementem łańcucha oddechowego, zbierającym równoważniki redukujące z flawoprotein i przekazującym je cytochromom
BIAŁKA ŻELAZOWO - SIARKOWE - stanowią jednoelektronowy układ oksydoredukcyjny. Współpracują zarówno z flawoproteinami jak i cytochromem b.
UKŁAD CYTOCHROMOWY - cytochromy stanowią układ w którym każda cząsteczka cytochromu przenosi jeden elektron na zasadzie zmiany wartościowości żelaza. Pierwszym biorcom elektronów od ubichinonu jest cytochrom b o masie cząsteczkowej 28kDa. Dalszym przenośnikiem jest cytochrom c1 a następnie cytochrom c. C1 jest lipoproteiną o masie 360kDa. Jest to polimer zbudowany z podjednostek o masie 51kDa, zawierających po jednym atomie żelaza. C ma masę 13kDa, zawiera 104 reszty aminokwasowe, jest jedynym cytochromem rozpuszczalnym i ruchomym składnikiem łańcucha oddechowego. Cytochromy aa3 są nazywane oksydazą cytochromową. Jest to kompleks 13 podjednostek polipeptydowych. Właściwości katalityczne są przypisywane trzem najcięższym podjednostkom kodowanym przez mitochondrialny DNA. W jego skład wchodzą 2 układy żelazoporfirynowe, zaiwrające oprócz żelaza atom miedzi. Enzym ten ma duże powinowactwo do tleny, reakcja którą katalizuje jest nieodwracalna.
FOSFORLACJA OKSYDACYJNA - wykorzystywanie do syntezy ATP energii uwolnionej w czasie tlenowego oddychania i wychwytywanej podczas transportu H+ ē na tlen. Zachodzi tylko w mitochondriach. Gdy łańcuch rozpoczyna się od NAD to na ½ O2 są syntetyzowane 3 ATP. Gdy od FAD to 2 ATP. Jest kilka teorii wyjaśniających produkcję ATP w fosforylacji oksydacyjnej:
FOSFORYLACJA SUBSTRATOWA - wykorzystanie dla syntezy ATP energii powstałej na skutek wewnętrznej reorganizacji związku organicznego, którego poziom energetyczny obniża się:
- fosforylacja I - 1,3-bisfosfoglicerynian => 3-fosfoglicerynian
- fosforylacja II - fosfoenolopirogronian => pirogronian
- fosforylacja III - bursztynylo CoA => bursztynian
WIĄZANIE MAKROERGICZNE (MAKROCZĄSTECZKOWE) ATP - są to połączenia typu bezwodnikowego bogate w energię, które przy hydrolizie wyzwalają więcej niż 25 kJ/mol, decydują o dużej aktywności związku. Związki tego rodzaju uczestniczą często jako pośredniki w reakcjach endoergicznych. Hydroliza wiązania fosforanowego ATP w wyniku której powstaje ADP i P wyzwala około 29 kJ/mol natomiast następnego wiązania - rozpad ATP do AMP i PP uwalnia około 36 kJ/mol. Rozpad AMP z uwolnieniem adenozyny i fosforanu dostarcza 12 kJ/mol energii.
REGULACJA ŁAŃCUCHA ODDECHOWEGO
Najważniejszym czynnikiem regulacji jest stosunek stężeń ATP do ADP+P wewnątrz mitochondriów. Ze wzrostem stężenia ATP proces fosforylacji zwalnia.
KONTORLA ODDECHOWA - zależność między stężeniem ADP a szybkością oddychania.
INHIBITORY - wiele substancji z grupy barbituranów, jad rybi - rotenon, niektóre steroidy oraz związki rtęci hamują utlenianie substratów. Łańcuch oddechowy może być zablokowany w miejscu transportu elektronów między cytochromem b a cytochromem c przez antymycynę A, dimerkaptopropanol oraz naftochinony. Ostatni etap transportu elektornów przez oksydazę cytochromową skutecznie blokuje KCN oraz CO, antybiotyk, oligomycyna
ROZPRZĘGNIĘCIE FOSFORYLACJI OKSYDACYJNEJ - ma miejsce gdy a łańcuchu oddechowym zachodzi przenoszenie elektronów bez fosforylacji oksydacyjnej. Mogą je wywołać czynniki
- fizyczne np. ultradźwięki, promienie UV, promienie Roentgena oraz uszkodzenie błon mitochondrialnych przez np. rozpuszczalnika.
- chemiczne - dinitrofenol, dikumarol, arseniany, jodooctan ...
KATALIZATORY - utlenianie substratów katalizowane jest przez dehydrogenazy współdziałające z NAD. Niektóre czynniki np. wit K i E wpływają kożystnie na proces fosforylacji oksydacyjnej
III. GLIKOLIZA - ENERGETYKA I SCHEMAT:
GLIKOLIZA - proces glikolizy i fermentacji przebiega jednakowo do momentu wytworzenia pirogronianu.
1. fosforylaza glikogenowa
2. heksokinaza
3. fosfoglikomutaza
4. izomeraza glukozofosforanowa
5. fosfofruktokinaza
6. aldolaza fruktozobisfosforanowa
7. izomeraza triozofosforanowa
8. dehydrogenaza gliceraldehydo-3-fosforanowa
9. kinaza fosfoglicerynowa
10. mutaza bifosfoglicerynianowa
11. hydrataza fosfopirogronianowa
12. kinaza pirogronianowa
13. dehydrogenaza mleczanowa
14. karboksylaza pirogronianowa
15. dehydrogenaza pirogronianowa
kwas pirogronowy może: przekształcać się w acetylo CoA; przekształcać się w mleczan; przekształcać w szczawiooctan; być wykorzystywany w procesie glukoneogenezy; być wykorzystany do syntezy alaniny;
BILANS ENERGETYCZNY GLIKOLIZY: ufosforowanie glukozy - 1 ATP; ufosforowanie fruktozo-6-fosforanu -1 ATP; powstanie 1,3-bisfosfoglicerynianu 6 ATP; fosforylacja substratowa 4 ATP
W sumie wychodzi 8 ATP, gdy glikoliza rozpoczyna się od glikogeny - 9 ATP
REGULACJA GLIKOLIZY - efekt Pasteura - hamowanie glikolizy przez oddychanie tlenowe (konsekwencja ADP i fosforan)
- efekt CRAB TREE - hamowanie oddychania przez glukozę (obniżenie zużycia tlenu)
IV. CYKL KREBSA-ENERGETYKA I SCHEMAT:
CYKL KREBSA - drugi etap oddychanie komórkowego zachodzący w mitochondriach, końcowa droga spalania metabolitów powstałych z rozkładu cukrów, tłuszczów i białek. Cykl ten polega na całkowitym utlenianiu czynnego octanu powstałego w procesie glikolizy w szeregu przemian od kwasu octowego do kwasu szczawiooctowego. W przebiegu tych reakcji odłączane są cząsteczki dwutlenku węgla (CO2) oraz atomy wodoru, które łączą się z NAD.
W jednym przebiegu cyklu następuje spalanie dwóch atomów węgla, w wyniku czego powstają dwie cząsteczki CO2, odłącza się 8 protonów i 8 elektronów, które biorąc udział w fosforylacji oksydacyjnej dają 11 cząsteczek ATP, dwunasta cząsteczka ATP (lub GTP) powstaje w wyniku fosforylacji substratowej. Sumarycznie równanie cyklu Krebsa przedstawia się następująco:
acetylo-CoA + 3NAD + FAD + ADP + Pi + 2H2O = 2CO2 + 3NADH+ + FADH2 + ATP + 2H+ + CoA
1. syntaza cytrynianowa
2. akonitaza
3. dehydrogenaza izocytrynianowa
4. dehydrogenaza α-ketoglutaranianowa
5. triokinaza bursztynianowa
6. dehydrogenaza bursztynianowa
7. fumaraza
8. dehydrogenaza jabłczanowa
9. dehydrogenaza pirogronowa
REGULACJA DZIAŁANIA CYKLU KREBSA
1. syntaza cytrynianowa - stymuluje ADP, NAD+, hamuje ATP, NADH
2. dehydrogeneza izocytrynianowa - stymuluje ADP, Mn2+, Mg2+; hamuje ATP, NADH
3. dehydrogenaza 2-oksoglutaranu - hamuje bursztynylo CoA, ATP, NADH
4. dehydrogenaza bursztynianowa - stymuluje fosforan, bursztynian, fumaran; hamuje szczawiooctan, kwas malonowy
ATP - hamuje; ADP - stymuluje
V. B-OKSYDACJA - jest procesem katabolitycznym, w skutek czego dochodzi do wydzielania energii zgromadzonej w kwasach tłuszczowych. Zachodzi w mitochondriach. Proces ten jest wieloetapowy i wymaga 4 enzymów. Kwasy tłuszczowe o parzystej liczbie atomów węgla rozpadają się w procesie B-oksydacji na cząsteczki acetylo-CoA, które mogą ulec dalszemu utlenieniu w cyklu Krebsa bądź też wykorzystane do syntez kwasów tłuszczowych i steroidów oraz reakcji acetylacji. Kwasy tłuszczowe o nieparzystej liczbie atomów węgla w cząsteczce po odłączeniu dwuwęglowych fragmentów wytwarzają ostateczny produkt w postaci propionylo-CoA (propionylo-CoA pod wpływem ATP daje metylomalonylo-CoA, który pod wpływem mutazy metylomalonylo-CoA daje bursztynylo-CoA. Ten ostatni może zostać włączony do cyklu Krebsa)
1. aktywacja kwasów tłuszczowych pod wpływem syntetaz acetylo-CoA (strata 2ATP)
2. transport kwasów tłuszczowych przez błonę mitochondrialną. Przeniesienie reszty acylowej z CoA na karnitynę pod wpływem acetylotransferazy karnitynowej. Powstaje O-acylokarnityna. O-acylokarnityna + CoA-SH pod wpływem O-acylotransferazy acylo-CoA: karnityna daje acylo-CoA + karnityna
3. B-oksydacja:
- aktywny kwas tłuszczowy pod wpływem dehydrogenazy acylo-CoA i FAD daje aktywny kwas tłuszczowy nienasycony (powstaje zredukowany FAD, który oddaje atomy wodoru do łańcucha oddechowego)
- aktywny kwas tłuszczowy nienasycony pod wpływem hydratazy enoilo-CoA daje aktywny 3-hydroksykwas
- aktywny 3-hydroksykwas pod wpływem dehydrogenazy 3-hydroksyacylo-CoA daje 3-oksoacylo-CoA
- 3-oksoacylo-CoA przy udziale CoA-SH pod wpływem acylotransferazy acetylo-CoA daje acetylo-CoA +acylo-CoA.
RÓŻNICA MIĘDZY B-OKSYDACJĄ KW NIENASYCONYCH OD NASYCONYCH -w przypadku kw nienasyconych zachodzi mniejsza liczba procesów odwodorowania. Powstaje mniej ATP wytwarzanego w procesie fosforylacji tlenowej (o 2ATP mniej na każde podwójne wiązanie kwasu nienasyconego)
VI WITAMINY
NAZWA |
FUNKCJE |
NIEDOBÓR |
WYSTĘPOWANIE |
|||
A retinol
|
- wzrost i ogólny rozwój organizmu - tworzenie kości - produkcja hormonów - widzenie - prawidłowy rozwój i funkcjonowanie skóry - ochrona przed nowotworami |
- kurza ślepota - choroba śluzówek - zahamowanie wzrostu |
ryby morskie, tran, wątroba wołowa, żółtko jaj, masło oleje roślinne |
|||
D kalciferol |
- przemiany wapnia i fosforanów - właściwa mineralizacja kości |
- krzywica - tracenie zębów - łatwość złamań kości |
Ryby morskie, tran, wątroba, żółtko jajek, masło, masło roślinne, sery żółte |
|||
E tokoferol |
- zapobieganie uszkodzeniu błon kom przez procesy utleniania - ochrona przed rozwojem miażdżycy |
- choroby gonad - nieprawidłowy rozwój ciąży - zwyrodnienie mięśni |
Soja, kiełki zbóż, oleje roślinne, żółtko jaj, kasze, orzechy, kapusta |
|||
K filochinon |
- regulacja procesów krzepnięcia krwi i zapobieganie krwawieniom - utrzymywanie prawidłowej struktury kości i gojenie złamań |
- obniżenie krzepliwości krwi |
Lucerna, szpinak, kapusta, marchew, pomidory, groch, wątroba, żółtko |
|||
B1 tiamina |
- przemiany metaboliczne glukozy we krwi w związki wysokoenergetyczne - funkcjonowanie włókien układu nerwowego, serca i mięśni - produkcja krwinek czerwonych |
- choroby układu nerwowego i serca - beri-beri - zaburzenia metabolizmu |
|
|||
B2 ryboflawina |
- produkcja związków wysokoenergetycznych - właściwe funkcjonowanie skóry i błon śluzowych |
- zmiany skórne (zajady, łojotok) - zmiany w obrębie jamy ustnej i spojówki - światłowstręt i zahamowanie wzrostu |
drożdże, wątroba, mleko, jaja, jarzyny |
|||
B5 kwas pantotenowy |
- metabolizm tłuszczów, węglowodanów i białek - synteza hormonów - prawidłowa budowa i funkcjonowanie skóry - ochrona przed infekcjami |
- zahamowanie wzrostu, - choroby sierści i skóry |
Drożdże, żółtko jaj, wątroba, mleko, jarzyny |
|||
B6 pirydoksyna |
- synteza i regulacje ponad 60 białek organizmu - produkcja czerwonych i białych krwinek |
- anemia - łojotok - epilepsja - schorzenia skóry - depresja |
Kiełki pszenicy, wątroba, drożdże, mleko, mięso, |
|||
B12 kobalamina |
- tworzenie czerwonych komórek krwi - tworzenie materiału genetycznego - prawidłowe funkcjonowanie układu nerwowego |
- niedokrwistość złośliwa
|
Wątroba, mleko, cielęcina, sery żółte, żółtko |
|||
PP witamina B3, niacyna, kwas nikotynowy |
- procesy utleniania i redukcji w organizmie - redukcja poziomu cukru we krwi - regulacja przepływu krwi w naczyniach - regulacja poziomu cholesterolu |
- choroby skóry (pelagra) - przewodu pokarmowego - narwowego |
Otręby, drożdże, nasiona fasoli, grochu, wątroba, nerki, ryby |
|||
C Kwas askorbinowy |
- zmniejszenie szkodliwego działania chemicznych procesów utleniających (przeciwutleniacz) - produkcja kolagenu i podstawowych białek - zwiększenie wydajności układu odpornościowego - przyspieszenie gojenia ran |
- szkorbut (gnilec) - trudne gojenie ran - obniżenie odporności organizmu |
Porzeczki, cytryna, pomarańcza, kapusta kiszkona, ogórki, liście pietruszki, sałata |
|||
Kwas foliowy Folacyna Witamina B9 |
- regulacja różnych proc metabolicznych tworzenie DNA i RNA - chemiczny przekaźnik w mózgu - zapobieganie chorobom serca i miażdżycy - tworzenie erytrocytów |
- zahamowanie syntezy kwasów nukleinowych, wzrostu tkanek i organizmu - wypadanie włosów - powstawanie ognisk martwicy w mięśniach |
Szpinak, mleko, jaja, wątroba, drożdże |
|||
H biotyna |
- synteza aminokwasów, białek i kwasów tłuszczowych - prawidłowa budowa i funkcjonowanie skóry i włosów - wspomaganie funkcji tarczycy |
- utrata łaknienia - zapalenie skóry - wypadanie włosów |
Mleko, wątroba, jaja, marchew, maliny, drożdże |
|||
A retinol
|
||||||
D kalciferol
|
||||||
E tokoferol
|
||||||
K filochinon
|
||||||
B1 tiamina
|
||||||
B2 ryboflawina
|
H biotyna |
|||||
B5 kwas pantotenowy
|
||||||
|
|
|||||
C Kwas askorbinowy
|
||||||
Kwas foliowy, Folacyna, Witamina B9
|
||||||
VII. CYKL PENTOZOWY
Znaczenie: Dostarcza zredukowane NADP, potrzebnego do różnych syntez kwasów tłuszczowych i steroidów. Jest głównym dostarczycielem pentoz a zwłaszcza rybozy.
Bilans energetyczny: w wyniku tego cyklu powstaje 6 cząsteczek glukozy i 6 cząsteczek CO2. poza tym powstaje 6 cząsteczek pentoz, z których morze być utworzonych 5 cząsteczek heksoz.
1. dehydrogenaza glukozo-6-fosforanowa
2. glukonolaktaza
3. dehydrogenaza fosfoglukonionowa dekarboksylująca
4. izomeraza rybozofosforanowa
5. 3-epimeraza rybulozofosforanowa
6. transketolaza
7. transaldolaza
VI. CYKL MOCZNIKOWY
- mocznik jest syntetyzowany z N2 i CO2 (w wątrobie i nerkach)
- aminokwasy ulegają dekarboksylacji i dezaminacji - stąd składniki do: cyklu Krebsa małego, cyklu mocznikowego, cyklu ornitynowego
- przemiana energetycznie deficytowa
SCHEMAT:
1. CO2 + NH3 ( syntetaza karbamoilofosforanowa, 2ATP, H2O, Mg2+, AGA) karbamoilofosforan
2. karbamoilofosforan + ornityna (transferaza karbamoilofosforanowa) cytrulina
3. cytrulina + kw. asparaginowy (ATP, syntetaza argininobursztynianowa) kw. argininobursztynowy
4. kw. argininobursztynowy (liaza) arginina + kw. fumarowy (ten ostatni do cyklu Krebsa)
5. arginina (arginaza) ornityna + izomocznik mocznik (dwuaminoketon)
- proces wymaga dostarczenia 3 ATP
- jedna gr NH2 dezaminacja kw glutaminowego; druga gr NH2 z kw. asparaginowego
- mocznik ulega filtracji w nerkach, ale jego część jest zpowrotem wchłaniania w kanalikach
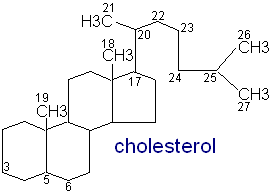
IX. GŁÓWNE ETAPY POWSTAWANIA CHOLESTEROLU - Wytwarzany jest na błonach gładkich ER. Substratem do jego wytwarzania jest acetylo CoA.
1. 2 cząsteczki acetylo-CoA przy udziale acetylotransferazy acetylo-CoA dają acetoacetylo-CoA (odłącza się CoA-SH)
2. acetoacetylo-CoA pod wpływem syntetazy hydroksymetyloglutarylo-CoA daje HMG-CoA (odłącza się CoA-SH)
3. HMG-CoA pod wpływem reduktazy HMG-CoA daje kwas mewalonowy
4. kwas mewalonowy pod wpływem kinazy mewalonianowej (kosztem 2ATP) daje aktywny mewalonian
5. aktywny mewalonian pod wpływem dekarboksylazy pirofosfomewalonianowej daje aktywny izopren.
6. aktywny izopren pod wpływem izomerazy izopentenylopirofosforanowej daje dimetyloallilopirofosforan
7. dimetyloallilopirofosforan + izopentenylopirofosforan pod wpływem dimetyloallilotransferazy dają geranylopirofosforan (uwalnia się pirofosforan)
8. geranylopirofosforan + aktywny izopren pod wpływem syntetazy farnezylopirofosforanowej daje farnezylopirofosforan (wydziela się pirofosforan)
9. farnezylopirofosforan pod wpływem syntetazy skwalenowej daje skwalen (wydzielają się 2 cząsteczki pirofosforanu)
10. skwalen pod wpływem hydroksylazy skwalenowej cyklizuje do lanosterolu
11. lanosterol drogą licznych reakcji enzymatycznych ostatecznie przekształcony zostaje do cholesterolu
CHOLESTEROL - pod względem chemicznym cholesterol jest alkoholem, który może tworzyć estry z kwasami tłuszczowymi zaliczane do grupy wosków. Z cukrami może tworzyć połączenia glikozydowe. Nie rozpuszcza się w wodzie, rozpuszcza się w rozpuszczalnikach organicznych. Stężenie cholesterolu we krwi jest regulowane przez wątrobę. Bierze on udział w syntezie steroidów zwierzęcych: hormonów steroidowych, wit D3, kw żółciowych. Cholesterol ma 27 atomów węgla. Głównym miejscem jego syntezy jest wątroba.
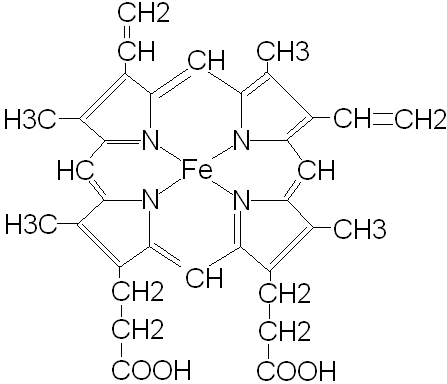
IX. HEM-biosynteza, katabolizm, wzór:
- hem - żelazoporfirylo: 4 rodniki CH3, 2 rodniki winylowe (-CH=CH2), 2 reszty kw. propionowego (kompleks chelatowy z żelazem; 2Fe2+- ferrohem w czynnych hemoglobinach, Fe3+- ferrihem)
1) biosynteza hemu:
- glicyna (dawca atomów azotu)
- bursztynylo-CoA (dawca atomów węgla)
- początek w mitochondriach (wytwarzanie α-aminolewulinianu)) wytwarzanie α-aminolewulinianu:
glicyna + bursztynylo-CoA kw. 2-amino-3-oksoadypinowy kw. δ-aminolewulinowy
- później w cytoplazmie tworzenie porfobilirigenu:
2x δ-aminolewulinowy (przy udziale syntazy porfobilinogenu) porfobilinogen
- synteza uroporfirynogenu:
porfobilinogen(przy udziale syntazy uroporfirynogenu) uroporfirynogen I + uroporfirynogen II
- powstawanie hemu - z 4 czasteczek porfobilinogenu
uroporfirynogen III (uroporfirynogenaza dekarboksylowa) koproporfiryna III (oksydaza koproporfirynowa III) protoporfirynogen IX (oksydaza protoporfirynowa IX) protoporfiryna IX (syntaza hemowa) HEM
2) katabolizm hemu:
-synteza bilirubiny
hem(oksygenaza hemu) biliwerdyna* (reduktaza biliwerdyny) bilirubina*
* - barwniki żółciowe
- wychwyt bilirubiny w watrobie
bilirubina + kw. glukuronowy (transferaza DPGA) z żółcią do dwunastnicy
- tworzenie urobiliny, urobilinogenu, sterkobilinogenu w przewodzie pokarmowym
bilirubina (enzymy mikroflory) urobilinogen (z moczem) (utlenienie) urobilina (z kałem).
bilirubina sterkobilinogen (utlenianie) sterkobilina (z kałem)
X. BUFORY KRWI odczyn krwi lekko zasadowy. Utrzymanie równowagi kwasowo zasadowej umożliwiają układy buforowe, Do ukl. buforowych nalezą: hemoglobina - 79%CBF, bialka 13,6%, wodorowęglany - 6,1% (w osoczu łączą się z K+ i NA+), fosforany1,3%. Część Hb: budowa białkowa (właściwości amfoteryczne). Dużą pojemność Hb przypisuje się jonizacji imidazolu (występuje w histydynie)-stanowi 6-10%Hb. Efekt Bohra - zmniejszenie powinowactwa hemoglobiny do tlenu, efekt: zmniejszenie ph krwi, zwiększenie ciśnienia parcjalnego
Co2 i podwyższenie temp. Wodoroweglany, gdy powst. kwas mocniejszy od węglowego, łączy się z kationem wodorowęglanu rugując kwas węglowy. CO2 uwolnione z kwasu węglowego przez karpanhydraze zostaje usunięty przez płuca. Tego rodzaju mechanizmy utrzymują Ph.
XI. FUNKCJE BIAŁEK OSOCZA KRWI: Rola koloidów ochronnych, wpływ na krążenie wody w tkankach i ciśnienie osmotyczne, udział w procesach immunologicznych, odpowiedzialność za krzepniecie krwi, funkcje enzymatyczne(albuminy, globuliny), u roślinożernych więcej globulin. Białka te syntetyzowane w wątrobie.
XII. LIPAZY I FOSFOLIPAZY: - trawią tłuszcze. Fosfolipazy - A,B - atak na wiązania estrowe kw. tłuszczowych w cząsteczce fosfolipidow. Fosfolipazy C i D rozszczepiają wiązania estrowe kwasu fosforowego tychże związków. Fosfolipazy A,B C u zwierząt powst. w ścianie jelita, a fosfolipaza D wyst. U roślin. Lipazy:L. Lipoproteinowa - hydroliza triacylogliceroli chylomikronów. Lipaza wątrobowa hydroliza triacylogliceroli frakcji IDL i HDL. LDL i wątrobowa występują w śródbłonku naczyniowym. Lipaza trzustkowa wyst. w jelicie cienkim. Są one esterazami wydzielanymi w postaci aktywnej, rozszczepiają tłuszcze na glicerol i kwasy tłuszczowe. Esteraza cholesterolowa rozszczepia estry cholesterolu z kwasami tłuszczowymi. Lipaza zoladkowa- jest w gruczołach żołądków ssaków.
XIII. NEUROMEDIATORY: + depolaryzują błonę postsynaptyczna. Dochodzi do aktywacji Na i otwierają się kanały. Po 0,5mseknastepuje inaktywacja Na i jednoczesna aktywacja K- repolaryzacja. (Acetylocholina, Dop. Adren. Noradren. Glutaminiany, Asparaginiany).
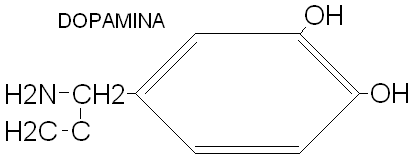
powstaje IPSP - potencjaly hamujące, jony Cl- wchodzą do wnętrza neuronu. Hiperpolaryzacja rozprzestrzenia się na neurony.
![]()
XIV. PRÓBA BENEDICTA (NA WYKRYWANIE CUKRÓW REDUKUJĄCYCH) - na wykrywanie cukrów redukujących. Odczynnik Benedicta (zawiera połączone roztw.CuSo4x5H2O i Cytrynian sodowy+bezwodny węglan sodowy z H2O) + kilka kropli cukru redukującego wstawiamy na 5 min. do wrzątku. Robi się zielone, albo osad od żółtego do czerwonego. Jest to próba bardzo czuła. Przy niskiej zaw. cukru robi się zielone na skutego mieszania małych ilości Cu2O z niebieskim odczynnikiem.
Jony Cu (z CuSo4) wytrącają się jako Cu(OH)2, nierozpuszczalny w wodzie. Dlatego dodaje się cytrynian i węglan, które tworzą z nim rozpuszczalne kompleksy, które w miarę redukcji rozpadają się, dając Cu2+.Jeśli wyniki dodatni, to wytrąca się tlenek miedziany Cu2O-czerwony, jeśli ujemny, to czarny CuO.
XV. PRÓBA SULFOSALICYLOWA (WYKRYWANIE BIAŁEK) - Do roztw bialka dodajemy kilka kropli 20%kw.sulfosalicylowego. Wytrąca się biały osad.Bardzo czuła, jeśli mało białka, to zmętnienie roztw.
W środ.kwaśnym, cząsteczki białka mają charakter kationu i mogą tworzyć połączenia z niektórymi anionami kw. Organicznych a także nieorg.. Kwasy te w większy stężeniach powodują denaturację białek.
XVI. PRÓBA PSEUDOPEROKSYDAZOWA HEMOGLOBINY (TEST NA WYKRYWANIE ŚLADOWYCH ILOŚCI HEMOGLOBINY)
H2O dest + krew + benzydyna + H2O2 niebieskie zabarwienie.
Reakcja nie jest związana z enzymami ponieważ zagotowanie roztworu nie wpływa na wynik próby. Odczyn barwny z benzydyną daje układ hemowy hemoglobiny - żelazo
XVII. PRÓBA HAYA (WYKRYWANIE KWASOW ŻÓŁCIOWYCH):
do probówki wlewamy roztwór żółci, jednocześnie do drugiej probówki dajemy taką sama ilość wody destylowanej. Na powierzchnie płynów wsypujemy odrobinę kwiatu siarczanowego. W roztworze żółci opada deszcz siarkowy, natomiast w próbie z wodą siarka zatrzymuje się na powierzchni. Przyczyną zatrzymania siarki na powierzchni wody jest jej wysokie napięcie powierzchniowe, które w obecności kw. Żółciowych zostaje obniżone.
XVIII. PRÓBA SALKOWAKIEGO (WYKRYWANIE CHOLESTEROLU):
Warunkiem tej próby jest zachowanie środowiska bezwodnego. Pod wpływem H2 SO4 następuje odłączenie 2 cząsteczek wody i połączenie 2 cząsteczek cholesterolu przy węglach C3 w bicholestadien. Jednocześnie przy węglach C7 następuje dołączenie 2 reszt sulfonowych. Powstaje kwas 2- sulfonowy o czerwonym zabarwieniu.
XIX. REAKCJA PIOTROWSKIEGO ( PRÓBA BIURETOWA):
kryształki mocznika ogrzanie wydziela się amoniak
pozostała biała substancja = biuret
biuret + H2O destylowana + NaOH + Cu SO4 barwa fioletowa
Biuret ma wiązania peptydowe charakteryzujące peptydy i białka. Powstanie fioletowej barwy związane jest z utworzeniem soli kompleksowej na skutek koordynacyjnego połączenia miedzi z dwoma przyległymi wiązaniami peptydowymi.
XX. WYKRYWANIE BILIRUBINY W SUROWICY KRWI - ODCZYN VAN DEN BERGA
- odczyn bezpośredni - surowica + odczynnik dwufazowy
jest dodatni jeśli w ciągu 30 sekund pojawi się czerwone lub fioletowe zabarwienie
- odczyn pośredni - surowica + etanol (po odwirowaniu dodajemy odczynnik 1 i 2)
pojawia się różowo-fioletowe zabarwienie
W warunkach prawidłowych surowica nie daje dodatniego odczynu bezpośredniego, a słaby pośredni. W surowicy do 17,1 μmol/dm3 bilirubiny
XXI. WYKRYWANIE UROBILINOGENU W MOCZU:
mocz + odczynnik Ehrlicha czerwone zabarwienie
Urobilinogen w wysokich stężenniach HCl kondensuje z aldehydowym odczynnikiem Ehrlicha na intensywnie czerwony barwnik
XXII. ILOŚCIOWE OZNACZANIE HEMOGLOBINY METODĄ DRABKINA:
Pod wpływem odczynnika Drabkina, który zawiera sześciocyjanożelazian potasu oraz cyjanek potasu w buforze węglanowym. Następuje przekształcenie Hb w cyjanomethemoglobinę o barwie karminowej
XXIII PURYNY I PIRYMIDYNY (KATABOLIZM I BIOSYNTEZA)
KATABOLIZM ZASAD PURYNOWYCH
- adenina (deaminaza) hipoksantyna (oksydaza ksantynowa) kw. moczowy
- guanina (deaminaza) ksantyna (oksydaza ksantynowa) kw. moczowy
u większości gat zwierząt kw. moczowy ulega dalszym przekształceniom: kw. moczowy (urykaza) alantoina (otwarty pierścień pirymidynowy)
u płazów i niektórych ryb dodatkowo: alantoina (alantoinaza) kw. alantoinowy (otwarty pierścień pirymidynowy i midazolowy)
KATABOLIZM ZASAD PIRYMIDYNOWYCH
Cytozyna (deaminaza cytozynowa) uracyl (dehydrogenaza dihydrouracylowa) dihydrouracyl kw. B-ureidopropionowy (ureidopropionaza) B-alanina (transaminacia) semialdehyd kwasu malonowego (utlenienie, dekarboksylacja) kw. octowy
Metylocytozyna tymina dihydrotymina kw. B-uryidoizomasłowy kw. B-aminoizomasłowy (transaminacja) semialdehyd kw. metylomalonowego (utlenienie) kw. metylomalonowy (izomeracja) kw. bursztynowy
semialdehyd kw. matylomalonowego (utlenianie i dekarboksylacja) kw. propionowy
BIOSYNTEZA MONONUKLEOTYDÓW PURYNOWYCH
IMP jest związkiem prekursorowym do powstawania nukleotydów purynowych, powstaje z α-rybozy
IMP + kw. asparaginowy kw. adenylobursztynowy AMP + kw. fumarowy
IMP XMP GMP
BIOSYNTEZA MONONUKLEOTYDÓW PIRYMIDYNOWYCH
Karbamoilofosforan + kw. asparaginowy kw. karbamoiloasparaginowy kw. dihydroorotowy kw. orotowy orotydyno-5-fosforan (OMP) urydyno-5-monofosforan (UMP-związek macierzysty dla nukleotydów) urydynotrifosforan (UTP) cytycydotrifosforan (CTP)
UMP (aminacja) kw. cytydylowy (CH3) kw. metylocytydylowy (CMP)
UMP (CH3) kw. tymidylowy (TMP)
XXIV. DROGI TRANSFORAMCJI KSENOBIOTYKÓW - Substancje obce dla org.ulegaja, biotransformacji. 1.wytw. związków pośrednich przez. Utlenowanie, redukcje i hydroliz. 2.daje prod. Końcowe, które sprzężone z kw.glukuronowym, siarkowym, glutationem, glicyna, ulęgają acetylacji i metylacji. Pierwsza faza prowadzi do uzyskania polarności(enz.:oxydored. i hydrolazy). Druga:katalizuja reakcje sprzęgania(np.UDP, glukuronylotransferaza-wyst. W mikrosomach, lub enzymy cytozolowe). Monooksygenazy-enzymy oxydoredukcyjne, enzymy błonowe- synteza kw. zolciowych i hormonów steroidowych.
XXV. PODZIAŁ I OPIS ENZYMÓW
OKSYDOREDUKTAZY - stanowią klasę enzymów biorących udział w reakcjach utleniania i redukcji. Do tej klasy należą bardzo liczne enzymy występujące w przyrodzie. Działają one na grupy chemiczne, które są dawcami pary elektronów lub pary atomów wodoru. Donorami mogą być grupy =CH-OH, grupy aldechydowe i ketonowe, grupy =CH-CH=, =CH-NH2, -CH=NH, NADH oraz NADPH, grupy tiolowe oraz hemowe. Akceptorami mogą być NAD+ lub NADP+, mogą być nimi także liponian, tlen, związki chinonowe i inne.
DEHYDROGENEZY - enzymy powodujące odszczepienie atomów wodoru od substratu
KATALAZA - enzym przenoszący z jednej cząsteczki nadtlenku wodoru na drugą. W efekcie zostaje uwolniony tlen i woda
TRANSFERAZY - stanowią klasę enzymów biorących udział w przenoszeniu różnych grup chemicznych z dawcy na biorcę. Tworzą połączenia z substratami przez wiązania kowalencyjne. Zaliczamy tu enzymy przenoszące grupy jednowęglowe, acyle, grupy glikozylowe, aminowe, reszty fosforanowe i nukleotydowe. Enzymy te odgrywają dużą rolę w energetyce biologicznej.
HYDROLAZY - stanowią najliczniejszą klasę enzymów. Reakcje przez nie katalizowane są na ogół nieodwracalne, towarzyszy im utrata swobodnej energii. Mogą występować w komórkach, a także działać pozakomórkowo w płynach ustrojowych oraz sokach trawiennych. Powodują rozszczepienie wiązań, na które działają za pomocą cząsteczki wody, stąd reakcje przez nie prowadzone sę nazwane reakcjami hydrolizy enzymatycznej
LIAZY - są enzymami, które rozszczepiają niehydrolityczne przede wszystkim wiązania chemiczne występujące między dwoma atomami węgla, węglem i tlenem, węglem i azotem oraz węglem i siarką. Na skutek rozszczepienia substratu mogą być uwalniane związki drobnocząsteczkowe, takie jak: CO2, aldechydy, H2O, NH3 lub H2S. Biorąc pod uwagę rodzaj uwalnianych cząsteczek, enzymy tej klasy można podzielić na: dekarboksylazy, aldolazy, dehydratazy, amoniakolazy oraz desulfhydrazy.
XXVI. PIERWIASTKI (SELEN, KOBALT):
SELEN - Jest pierwiastkiem śladowym w organizmie człowieka. Selen wchodzi w skład peroksydazy glutationowej, enzymu, który chroni błony komórkowe i czerwone ciałka krwi przed niszczącym działaniem wolnych rodników. Selen działa również synergistycznie z witaminą E, blokując szkodliwe procesy utleniania w tkankach (wraz z witaminą E szczególnie chroni serce i układ krążenia przed zmianami chorobowymi, oraz wzmacnia sprawność funkcjonowania układu odpornościowego). Unieszkodliwianie niszczących działań wolnych rodników zapobiega powstawaniu zmian nowotworowych w różnych tkankach i narządach. Pomaga w wydalaniu z organizmu szkodliwych metali ciężkich i uczestniczy w wytwarzaniu hormonopodobnych substancji, prostaglandyn, zapobiegającym stanom zapalnym. Niedobory selenu mogą powodować bolesność mięśni, osłabienie, choroby wątroby i trzustki. Selen należy do mikroelementów. Szkodliwy jest niedobór, jak również, jego nadmiar. W dużych dawkach selen jest trujący dla ludzi i zwierząt. Powoduje to ślepotę koni, wypadanie sierści, zębów, deformację rozwoju kończyn, zatrucia drobiu. przyswajany w formie organicznych związków, selenocysteiny i selenometioniny. Występują one w naturalnych produktach spożywczych. Ich przyswajalność ogranicza spożywanie dużych dawek witaminy C.
KOBALT - Kobalt występuje we wszystkich tkankach organizm. Największe jego stężenie jest, w wątrobie, nerkach i kościach. Jest pierwiastkiem w chodzącym w skład witaminy B12 (kobalaminy), niezbędnej do tworzenia nowych ciałek krwi, otoczki mielinowej komórek nerwowych, odtwarzania kodu genetycznego w nowo powstających komórkach, tworzeniu neuroprzekaźników. Kobalt dostaje się do naszego organizmu razem z kobalaminą. Kobalt znajdujący się w pokarmach roślinnych nie jest przyswajany w przewodzie pokarmowym. Kbalt zawierają pokarmy mięsne a zwłaszcza, wątroba, nerki i ostrygi. Nadmiar kobaltu może nasilać czynność tarczycy i szpiku kostnego co powoduje nadmierną produkcję czerwonych ciałek krwi. Niedobory kobaltu występują rzadko.
Wyszukiwarka
Podobne podstrony:
368
sbd2008, sbd307-368, - 1
368 369
(5) C 368 95 Vereinigte Familiapress EN Streszczenie
MPLP 368;369 08.03.;20.03.2013
368 , Psychoterapia wykład IV 10 III 01
368 Manuskrypt przetrwania
368 czy pospolity grzyb moze byc przyczyna raka
368
368
K 368
368 id 36206 Nieznany
368
368
368
368
więcej podobnych podstron