4. R E A K C J E E L I M I N A C J I
A. Kołodziejczyk 2010. 02
Związki organiczne zawierające dobrą grupę odchodzącą mogą ulegać reakcji eliminacji, w wyniku czego powstają alkeny.
B-
R-CH2-CH2-X _→ R-CH=CH2 + BX
Grupami odchodzącymi są te same jony lub cząsteczki, które zostały omówione w reakcjach substytucji, a więc halogenki, reszta tosylanowa, alkoksylanowa czy woda. Reakcje eliminacji zachodzą pod wpływem zasad, a ponieważ odczynniki zasadowe wykazują zwykle również właściwości nukleofilowe, reakcje substytucji i eliminacji są wzajemnie konkurencyjne i zwykle współbieżne.
Nu-
R-CH2-CH2-X ___→ R-CH=CH2 + R-CH2-CH2-Nu
- NuX, - X-
↑ ↑
eliminacja substytucja
Kierunek reakcji zależy zarówno od właściwości związku organicznego, właściwości odczynnika (im bardziej zasadowy tym większa tendencja do eliminacji) i warunków reakcji.
Reakcje eliminacji, podobnie jak substytucji mogą biec wg mechanizmu dwucząsteczkowego E2, jak i jednocząsteczkowego E1.
4.1 Reakcje eliminacji typu E2
R-CH2-CH2-X + B- _→ R-CH=CH2 + HB + X-
W reakcjach eliminacji biegnących wg mechanizmu E2 szybkość reakcji zależy od stężenia obu reagentów.
v = k[R-CH2-CH2-X].[B-]
4.1.1.Reguła Zajcewa
Reakcje eliminacji są regiospecyficzne, a ich kierunek określa reguła Zajcewa, która brzmi: w produktach reakcji eliminacji halogenowodoru (HX) z halogenków alkilowych przeważa bardziej rozgałęziony alken.
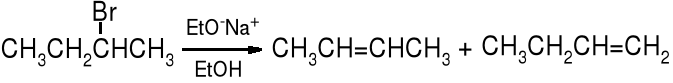
2-bromobutan but-2-en (81%) but-1-en (19%)
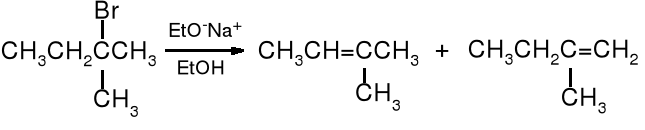
2-bromo-2-metylobutan 2-metylobut-2-en (70%) 2-metylobut-1-en (30%)
Reakcje E2 zachodzą pod wpływem silnej zasady. Odrywa ona proton z atomu węgla w pozycji , czyli z atomu sąsiadującego z atomem C do którego przyłączona jest grupa odchodząca.
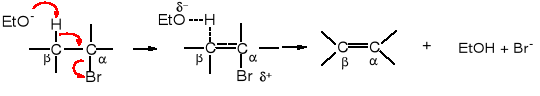
stan przejściowy reakcji E2
W stanie przejściowym, który zaistniał w wyniku ataku zasady (EtO-) na atom wodoru związany z C dochodzi do rozluźnienia wiązania pomiędzy H-C i C-Br i utworzenia częściowo podwójnego wiązania pomiędzy C-C (zaznaczone linią przerywaną).
Warto zwrócić uwagę, że proton jest odrywany wyłącznie wtedy, gdy znajduje się w pozycji s-trans w stosunku do grupy odchodzącej, tzn. że atom wodoru i grupa odchodząca muszą być do siebie w konformacji antyperiplanarnej (naprzemianległej). Tylko w tej konformacji jest możliwość nakładania się orbitali wiążących atomu wodoru oraz grupy odchodzącej i utworzenia wiązania częściowo podwójnego, co znacznie zmniejsza energię stanu przejściowego. W stanie przejściowym osie orbitali tworzącego się wiązania podwójnego muszą znaleźć się w jednej płaszczyźnie z osiami orbitali sp3 wiązania atomu wodoru i grupy odchodzącej. Dodatkowo w tej konformacji odrywany proton zajmuje pozycję najbardziej oddaloną od grupy odchodzącej, a tym samym zasada (EtO-) ma ułatwione warunki do zbliżenia się do niego; w każdej innej konformacji zasada jest mocniej odpychana przez elektrostatycznie działanie ujemnie naładowanej grupy odchodzącej.
Energia stanu przejściowego decyduje o kierunku eliminacji i racjonalnie tłumaczy regułę Zajcewa. W reakcji 2-bromo-2-metylobutanu z etanolanem sodu jest możliwość utworzenia dwóch struktur stanu przejściowego, w wyniku ataku zasady na proton przy C1 lub C3.
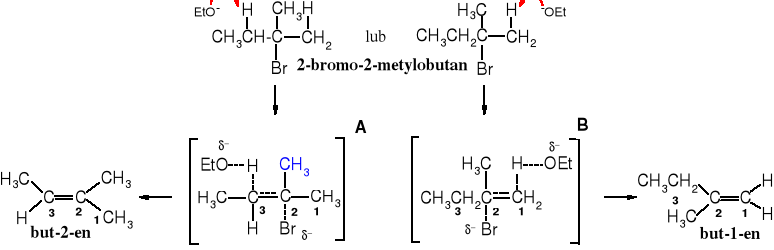
Schemat reakcji eliminacji typu E2. Zgodnie z regułą Zajcewa preferowane jest tworzenie się alkenu bardziej rozgałęzionego, ponieważ stan przejściowy A jest stabilizowany przez 3 grupy alkilowe (zaznaczone kolorem niebieskim), a B tylko przez dwie
Utworzenie stanu przejściowego B wymaga większej energii aktywacji, jest więc mniej prawdopodobne.
4.1.2 Przykłady reakcji eliminacji (orientacja reakcji dehydrohalogenacji

![]()
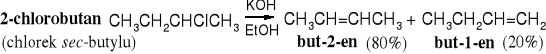
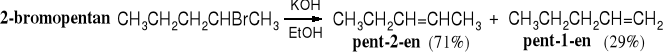
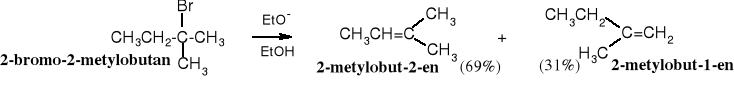
Na wydajność określonego alkenu w produktach reakcji eliminacji wpływa nie tylko trwałość produktu pośredniego (tym samym danego alkenu), ale również liczba i reaktywność (kwasowość) atomów H ulegających oderwaniu.
Reaktywność atomów wodoru w reakcjach eliminacji Tabela 4.1
Substrat _→ produkt |
Względna szybkość |
Względna szybkość w przeliczeniu na 1 atom H |
H-CH2CH2Br → CH2=CH2 |
1,0 |
1,0 (trzy H) |
CH3CHHCH2Br → CH3CH=CH2 |
3,3 :2/3 |
5,0 (dwa H) |
H-CH2CHBrCH3 → CH3CH=CH2 |
9,4 :2 |
4,7 (sześć H) |
(CH3)2CBr(CH2H) |
120 :3 |
40 (dziewięć H) |
Wraz ze wzrostem rzędowości atomów C, z którymi związany jest halogen rośnie kwasowość atomów wodoru na sąsiadujących atomach węgla, a tym samym ich reaktywność w reakcjach eliminacji E2, równocześnie ten czynnik (rzędowość atomów C) sprzyja powstawaniu bardziej rozgałęzionych alkenów.
Reaktywność halogenków alkilowych w reakcjach dehydrohalogenacji rośnie wraz ze wzrostem ich rzędowości: 1o < 2o < 3o.
4.1.3 Reakcje eliminacji halogenowodorów ze związków chiralnych - Stereochemia reakcji E2
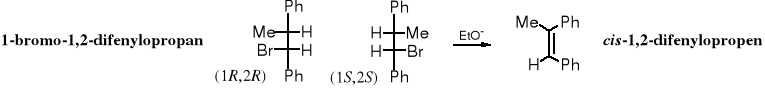
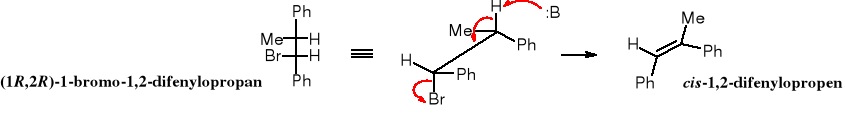
Podobnie jak SN2, tak i reakcje eliminacji biegnące mechanizmem E2 są stereospecyficzne. Produkty reakcji eliminacji bromowodoru z 1-bromo-1,2-difenylopropanu zależą od konfiguracji substratu. Ze stereoizomerów (1R,2R) i (1S,2S) otrzymuje się cis-1,2-difenylopropen, podczas gdy z (1S,2R) i (1R,2S) powstaje trans-1,2-difenylopropen.

Powyższa zależność wynika z preferencji konformacyjnej stanu pośredniego reakcji E2. Zwykle, ze względów energetycznych dwa największe podstawniki w cząsteczce organicznej znajdują się w pozycji antyperiplanarnej (s-trans). Natomiast reakcja E2 wymaga, żeby to atom H zajął pozycję s-trans, a więc najbardziej oddaloną od grupy odchodzącej -X. Taki układ ułatwia atak zasady, ponieważ ujemnie naładowana zasada może zbliżyć się do cząsteczki organicznej jedynie od przeciwnej strony do grupy odchodzącej (ma ona też ładunek cząstkowy ujemny i działa na zasadę odpychająco).
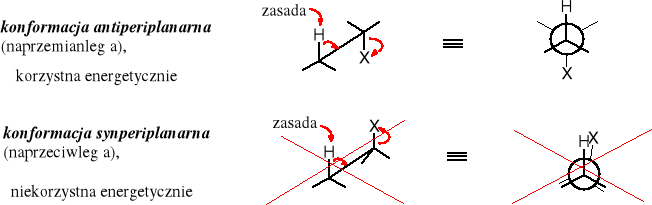
Konformacja substratu w stanie przejściowym reakcji eliminacji typu E2
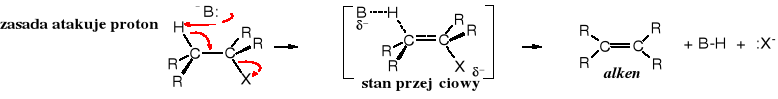
Mechanizm reakcji E2
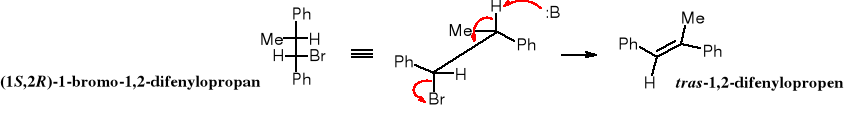
Powyższe wyjaśnienia ułatwiają zrozumienie, dlaczego z (1S,2R)- i z (1R,2S)-1-bromo-1,2-difenylopropanu powstaje (E)-1,2-difenylopropen, a z (1R,2R)- i z (1S,2S)-1-bromo-1,2-difenylopropanu tworzy się (Z)-1,2-difenylopropen.
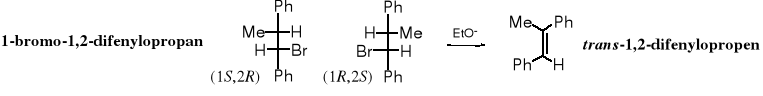
W projekcji perspektywicznej cząsteczki widać wyraźnie, że eliminacja cząsteczki HBr z (1S,2R)-1-bromo-1,2-difenylopropanu prowadzi do izomeru E. Ten sam produkt powstaje w trakcie eliminacji cząsteczki HBr z jego enancjomeru - (1R,2S).
Z enancjomerów (1R,2R) i (1S,2S)-1-bromo-1,2-difenylopropanu powstaje izomer (Z).
4.2 Reakcje eliminacji typu E1
Z chlorku t-butylu w roztworze wodnym zawierającym etanol (dla ułatwienia rozpuszczenia substratu) powstaje zarówno t-butanol jak i 2-metylopropen. Wiadomo, że alkohol powstaje wg mechanizmu SN1, a jak tworzy się alken, jeżeli w środowisku nie ma silnej zasady?
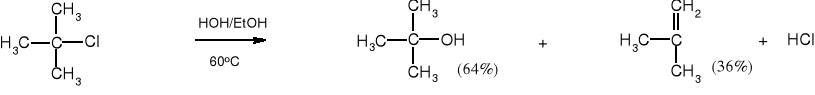
chlorek tert-butylu (2-chloro-2-metylopropan) alkohol tert-butylowy (2-metylopropan-2-ol) 2-metylopropen
Dla obu produktów szybkość reakcji zależy jedynie od stężenia chlorku t-butylu, a więc 2-metylopropen powstaje wg mechanizmu reakcji eliminacji jednocząsteczkowej, określanej typem E1.
v = k[R-X]
4.2.1 Mechanizm reakcji
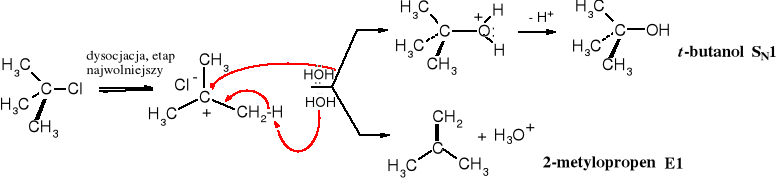
Do eliminacji typu E1 dochodzi w środowisku niezbyt zasadowym, a ulegają jej przede wszystkim halogenki 3o, wolniej, ale również 2o. W obecności silnych zasad 3o halogenki ulegają także E2, pod warunkiem, że spełniają wymogi stereochemiczne, czyli możliwość ułożenia się atomu H i grupy odchodzącej w konformacji antyperiplanarnej.
Taka sytuacja występuje w trakcie eliminacji HCl z chlorku mentylu. Grupa izopropylowa tego związku wymusza znaczną przewagę konformeru, w którym izopropyl zajmuje pozycję ekwatorialną. W tej pozycji nie ma możliwości antyperiplanarnego ułożenia się H i Cl, wobec czego eliminacja HCl biegnie bardzo wolno. Jest ona możliwa tylko dla nielicznie reprezentowanej populacji konformerów, w których izopropyl zajmuje pozycję akcjalną.
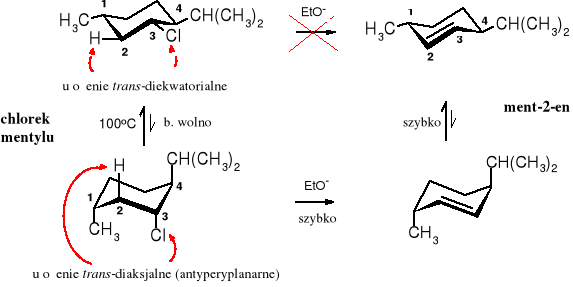
Eliminacja HCl z chlorku mentylu pod wpływem stężonej zasady zachodzi wg mechanizmu E2 i biegnie bardzo wolno, ponieważ możliwa jest tylko dla niekorzystnej energetycznie konformacji; przyspieszyć ją można przez podwyższenie temperatury reakcji
W stereoizomerycznym chlorku neomentylu reakcja eliminacji jest znacznie szybsza, ponieważ w uprzywilejowanym konformerze atomy H i Cl znajdują się w ułożeniu antyperyplanarnym. Głównym produktem eliminacji jest ment-3-en, ponieważ bardziej kwaśny atom H przy C4 niż przy C2, jest bardziej podatny na oderwanie przez zasadę.
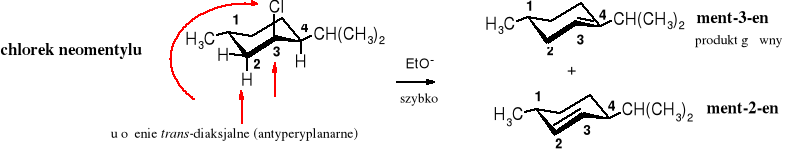
Eliminacja cząsteczki HCl z chlorku neomentylu biegnie szybko mechanizmem E2
W lekko zasadowym środowisku eliminację HCl z chlorku mentylu też się obserwuje, biegnie ona jednak mechanizmem E1 (szybkość reakcji zależy jedynie od stężenia chlorku mentylu); jest ona bardzo wolna, a w produktach znajdują się zarówno ment-2-en, jak i ment-3-en. Reakcja wg E1 zachodzi dwuetapowo, przy czym w pierwszym etapie po dysocjacji Cl- powstaje karbokation przy C3, a ten z kolei stabilizuje się przez oderwanie protonu od C2 lub C4. Atom H przy C4 (3o) jest bardziej ruchliwy (b. kwaśny) i dlatego głównym produktem, zgodnie z regułą Zajcewa, jest ment-3-en.
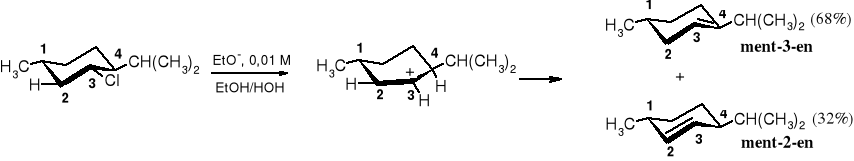
Eliminacja HCl z chlorku mentylu w środowisku słabo zasadowym biegnie wg mechanizmu E1
Dowodem na tworzenie się karbokationu jako produktu pośredniego podczas eliminacji E1 są produkty jego przegrupowania, ponieważ karbokation ma tendencję do przekształcania się w trwalsze ugrupowanie 3o, jeżeli istnieje taka możliwość.
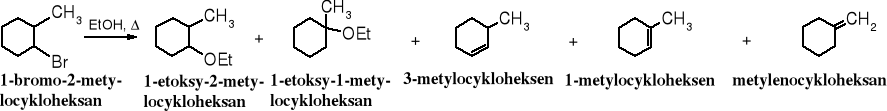
Zadanie: wyjaśnij pochodzenie produktów powstających w reakcji przedstawionej na powyższym schemacie
Eliminacja typu E1 zaczynająca się dysocjacją Cl- nie ma specjalnych wymagań konformacyjnych.
4.3 Reakcja dehydratacji
Alkohole mogą ulegać dehydratacji (odwodnieniu), przy czym w tej reakcji zwykle równowagowej, powstają alkeny. Równowaga reakcji dehydratacji jest najczęściej przesunięta na korzyść alkoholi, ale poprzez usuwanie wody lub alkenu (w zależności od temperatury wrzenia reagentów) można otrzymywać alkeny z dużą wydajnością. Często w takiej reakcji wykorzystuje się stężony kwas siarkowy lub fosforowy, które wiążą wodę.
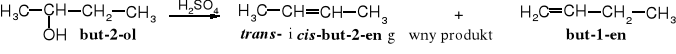
Zadanie: zaproponuj mechanizm dehydratacji 2-pentanolu pod wpływem kwasu siarkowego.
4.4 Porównanie reakcji substytucji nukleofilowej i eliminacji
Reakcje substytucji nukleofilowej SN i eliminacji E są reakcjami konkurencyjnymi. Znaczący wpływ na kierunek reakcji ma moc użytej zasady. Im silniejsza zasada, tym większy udział eliminacji biegnącej wg mechanizmu E2. Ponadto o kierunku reakcji decyduje:
- budowa związku organicznego (rzędowość atomu C w centrum reakcji),
- właściwości odczynnika reagującego (nukleofilowość/zasadowość),
- rodzaj rozpuszczalnika i inne warunki reakcji.
Pierwszorzędowe halogenki alkilowe reagują głównie wg mechanizmu SN2 i E2 ponieważ:
- w ataku odczynnika nie przeszkadzają duże podstawniki;
- trudno ulegają dysocjacji do karbokationu.
Na kierunek reakcji decydujący wpływ ma nukleofilowość odczynnika; z silnie nukleofilowymi dochodzi głównie do substytucji, a silne zasady wymuszają eliminację.
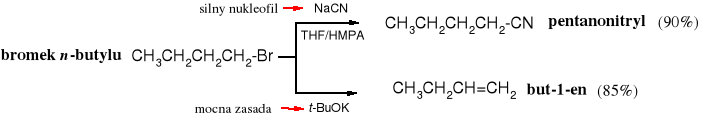
Rys. 4.7 Bromek n-butylu w zależności od reagenta ulega reakcji SN2 z NaCN (silnym nukleofilem) lub E2 z t-BuOK (silna zasadą)
Drugorzędowe halogenki alkilowe ulegają substytucji nukleofilowej i to zarówno wg mechanizmu SN2 i SN1 oraz eliminacji, także wg obu mechanizmów E2 i E1, ponieważ mają pośrednie właściwości pomiędzy halogenkami 1o i 3o.
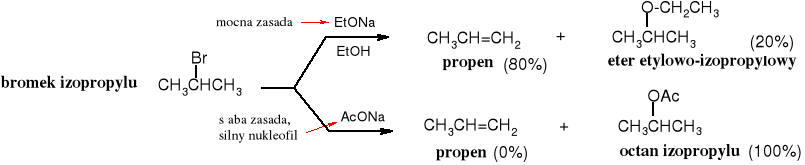
Rys. 4.8 Bromek izopropylu w reakcji z etanolanem sodu (silnej zasady, ale słabszej od t-BuOK) ulega głównie eliminacji, a w mniejszym stopniu substytucji do eteru, natomiast z silnym nukleofilem, jakim jest octan sodu zachodzi wyłącznie substytucja
Trzeciorzędowe halogenki alkilowe w zależności od reagentów i warunków ulegają substytucji SN1 lub eliminacji, przy czym może to być eliminacja E1 lub E2. W reakcji eliminacji 3o halogenków nie przeszkadza zawada przestrzenna przy atomie C związanym z halogenem, ponieważ zasada odrywa proton z sąsiedniego atomu węgla. Silne zasady w reakcji z 3o halogenkami alkilowymi wymuszają eliminację, przy czym biegnie ona zarówno wg mechanizmu E1, jak i E2; im silniejsza zasada tym większy udział eliminacji typu E2.
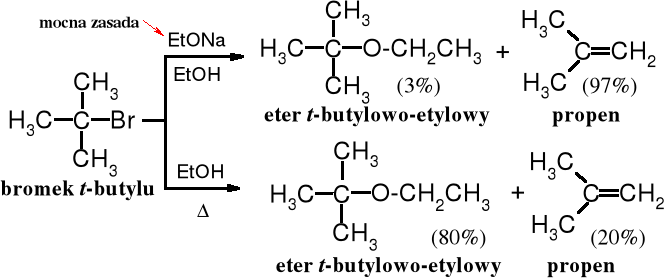
Trzeciorzędowy halogenek, jakim jest bromek t-butylu pod działaniem etanolanu sodu ulega głównie reakcji eliminacji (E2); w samym alkoholu przeważa substytucja SN1, której towarzyszy eliminacja E1, ale reakcja jest wolna; wymaga ogrzewania w celu zwiększenia jej szybkości.
Porównanie reaktywności halogenków alkilowych Tabela 4.2
Rzędowość R-X |
Typ reakcji |
|||
|
SN1 |
SN2 |
E1 |
E2 |
1o |
- |
główny proces pod wpływem silnych nukleofili |
- |
główny proces pod wpływem silnych zasad |
2o |
zachodzi podczas solwolizy w polarnym rozpuszczalniku |
główny proces pod wpływem silnych nukleofili, w polarnym aprotycznym rozpuszczalniku |
zachodzi podczas solwolizy w polarnym rozpuszczalniku |
główny proces pod wpływem silnych zasad |
3o |
główny proces pod wpływem silnych nukleofili, będących słabymi zasadami, biegnie w rozpuszczalnikach polarnych |
- |
zachodzi podczas solwolizy |
główny proces pod wpływem silnych zasad |
Objętościowo duże zasady, np. t-BuOK, diizopropyloamina i podobne ułatwiają eliminację typu E2, a utrudniają substytucję SN2.
8
Wyszukiwarka
Podobne podstrony:
11. Tiole i sulfidy, studia, I rok, chemia, organiczna
10. Etery, studia, I rok, chemia, organiczna
bromoacetanilid, Studia, Sprawozdania, Chemia organiczna
chemia ściąga, Budownictwo Studia, Rok 1, chemia
Ćwiczenie 9a, Studia, I rok, Chemia ogólna i nieorganiczna
zasady zaliczenia OAM 2011 2012, Rok I, Chemia organiczna
sprawozdanie- cw 8, Studia Biologia, Chemia organiczna
sprawozdanie- cw 8, Studia Biologia, Chemia organiczna
Ćwiczenie 5a, Studia, I rok, Chemia ogólna i nieorganiczna
Biotechnologia I rok, Studia, I rok, Chemia fizyczna
Techniki laboratoryjne, Farmacja ŚUM, II ROK, Chemia organiczna, Chemia organiczna, Ćwiczenia, I sem
sprawozdanie- cw 9, Studia Biologia, Chemia organiczna
metyloacetanilid, Studia, Sprawozdania, Chemia organiczna
Spr - Wyodrębnianie Kofeiny, AGH - IMIR - IMIM, I ROK, Chemia organiczna
PROGRAM ĆWICZEŃ Z CHEMII DLA STUDENTÓW I ROKU Biologia, biologia, Biologia I rok, Chemia organiczna
Aminy związki pochodne - ćw. 7, Rok I, Chemia organiczna
Sprawozdanie ćw. 11 Marty, Studia, I rok, Chemia fizyczna
więcej podobnych podstron