![]()
Materiały treningowe do kolokwium1
Pisząc odpowiednie równania reakcji wykaż właściwości amfoteryczne wodorotlenków: glinu, cynku i ołowiu.
![]()
![]()
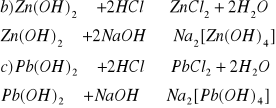
Nazwij podane związki:
H2SO4 - kwas siarkowy (VI)
H2SO3 - kwas siarkowy (IV)
NaClO4 - chloran (VII) sodu
MnO2 - tlenek manganu (II)
K4[Fe(CN)6] - heksacyjanożelazian (II) potasu
K3[Fe(CN)6] - heksacyjanożelazian (III) potasu
MgCl(OH) - chlorek wodorotlenek magnezu
K[Al(OH)4] - tetrahydroksoglinian (III) potasu
HNO2 - kwas azotowy (III)
Fe(OH)3 - wodorotlenek żelaza (III)
Fe2O3 - tlenek żelaza (III)
[Ag (NH3)2]Cl - chlorek diaminasrebra
KHCO3 - wodorowęglan potasu
NH4NO3 - azotan (V) amonu
Ca(HSO4)2 - diwodorosiarczan (VI) wapnia (II)
FeSO4 - siarczan (VI) żelaza (II)
Mg(NO3)2 - diazotan (V) magnezu
BaHPO4 - wodorofosforan (V) baru
KMnO4 - manganian (VII) potasu
Ag2S - siarczek srebra (I)
SO2 - tlenek siarki (IV)
H3PO4 - kwas fosforowy (V)
H2O2 - nadtlenek wodoru
MgSO4 · 7H2O - siedmiohydrat siarczanu (VI) magnezu
[CoCl2(NH3)4]Cl - chlorek tetraaminadichlorokobaltu (III)
Fe4[Fe(CN)6]3 - heksacyjanożelazian (II) ołowiu (III)
Na2S - siarczek sodu
BaSO4 - siarczan (VI) baru
CaC2O4 - szczawian wapnia
Napisz wzory związków:
azotan (V)srebra (I) - ![]()
siarczek manganu (II) - ![]()
ortofosforan (V) potasu - ![]()
wodorosiarczan(IV) amonu - ![]()
dichlorek hydroksoglinu - ![]()
tlenek diazotu - ![]()
tlenek azotu (V) - ![]()
tlenek manganu (VII) - ![]()
tlenek chloru (VII) - ![]()
nadtlenek baru - ![]()
wodorek sodu - ![]()
siarczek amonu - ![]()
kwas krzemowy - ![]()
chlorek hydroksomagnezu - ![]()
pieciohydrat chlorku miedzi (II) - ![]()
szczawian wapnia - ![]()
siarczek żelaza (II) - ![]()
heksacyjanożelazian (II)żelaza (III) - ![]()
chlorek diaminasrebra - ![]()
tlenek srebra (I) - ![]()
siarczan (VI)żelaza (III) - ![]()
wodorowęglan potasu - ![]()
siarczan (VI) amonu i potasu - ![]()
chlorek diaminasrebra - ![]()
Określ odczyn roztworu i napisz reakcje przebiegające w wodnych roztworach soli:
a) K2SO4![]()
(sól mocnej zasady KOH oraz mocnego kwasu ![]()
) (sól rozpuszczalna w wodzie, całkowicie zdysocjowana na jony)
![]()
![]()
kationy ![]()
nie reagują z wodą i nie tworzą niezdysocjowanych cząsteczek KOH z ![]()
, ponieważ KOH jest mocną zasadą całkowicie zdysocjowaną w wodzie na jony
![]()
aniony ![]()
nie reagują z wodą i nie tworzą niezdysocjowanych cząsteczek ![]()
, ponieważ ![]()
jest mocnym kwasem całkowicie zdysocjowanym w wodzie na jony
![]()
reakcja nie przebiega
Odczyn roztworu: obojętny (reakcja hydrolizy nie przebiega, w roztworze nie pojawiają się aniony ![]()
oraz kationy ![]()
)
b) Na2SO3 ![]()
(sól mocnej zasady NaOH oraz słabego kwasu ![]()
) (sól rozpuszczalna w wodzie, całkowicie zdysocjowana na jony, powstające w wyniku dysocjacji soli jony ![]()
reagują z cząsteczkami wody)
![]()
![]()
(tworzy się słaby niezdysocjowany kwas, aniony ![]()
pobierają kationy ![]()
od cząsteczek wody, w środowisku reakcji pojawiają się aniony ![]()
)
![]()
kationy ![]()
nie reagują z wodą i nie tworzą się niezdysocjowanych cząsteczek NaOH z ![]()
, ponieważ NaOH jest mocną zasadą całkowicie zdysocjowaną w wodzie na jony
![]()
![]()
![]()
Odczyn roztworu: zasadowy (wskazuje na to pojawienie się w środowisku reakcji hydrolizy anionów ![]()
)
Hydroliza anionowa, bo reakcji z cząsteczkami wody ulegają aniony soli
c) NH4NO3 ![]()
(sól słabej zasady ![]()
oraz mocnego kwasu ![]()
) (sól rozpuszczalna w wodzie, całkowicie zdysocjowana na jony)
powstające w wyniku dysocjacji soli jony ![]()
reagują z cząsteczkami wody
![]()
- tworzy się słaba niezdysocjowana zasada, kationy ![]()
wiążą aniony ![]()
pochodzące z wody, w środowisku reakcji pojawiają się kationy ![]()
![]()
aniony ![]()
nie reagują z cząsteczkami wody i nie tworzą niezdysocjowanych cząsteczek ![]()
z ![]()
pochodzącymi z wody, ponieważ ![]()
jest kwasem mocnym całkowicie zdysocjowanym w wodzie na jony
![]()
pojawiające się w środowisku reakcji ![]()
nie reagują z ![]()
i nie tworzą niezdysocjowanych cząsteczek mocnego kwasu
![]()
Odczyn roztworu: kwaśny (wskazuje na to pojawienie się w środowisku reakcji hydrolizy - kationów ![]()
)
Hydroliza kationowa
d) Na2S ![]()
(sól mocnej zasady NaOH oraz słabego kwasu ![]()
)
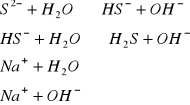
Odczyn roztworu: zasadowy (obecność jonów ![]()
)
Hydroliza anionowa
e) MgCl2 ![]()
(sól słabej zasady ![]()
oraz mocnego kwasu HCl)
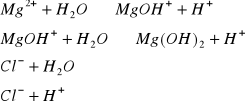
Odczyn roztworu: kwaśny (obecność jonów ![]()
)
Hydroliza kationowa
f) KCl ![]()
(sól mocnej zasady KOH oraz mocnego kwasu HCl)
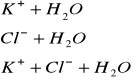
Odczyn roztworu: obojętny (brak jonów ![]()
i ![]()
)
g) Ca(NO3)2 ![]()
(sól mocnej zasady ![]()
oraz mocnego kwasu ![]()
)
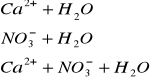
Odczyn roztworu: obojętny (brak jonów ![]()
i ![]()
)
h) Zn(ClO4)2![]()
(sól słabej zasady ![]()
oraz mocnego kwasu
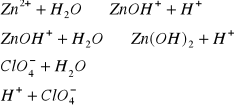
Odczyn roztworu: kwaśny (obecność jonów - ![]()
)
Hydroliza kationowa
i) Ba(NO2)2 ![]()
(sól mocnej zasady ![]()
oraz słabego kwasu ![]()
)
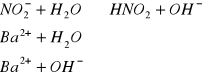
Odczyn roztworu: zasadowy (obecność jonów - ![]()
)
Hydroliza anionowa
j) FeCl3 ![]()
(sól słabej zasady ![]()
oraz mocnego kwasu HCl)
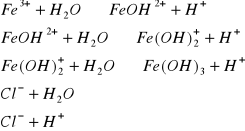
Odczyn roztworu: kwaśny (obecność jonów - ![]()
)
Hydroliza kationowa
k) FeSO4 ![]()
(sól słabej zasady ![]()
oraz mocnego kwasu ![]()
)
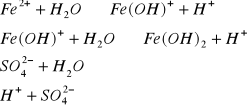
Odczyn roztworu: kwaśny (obecność jonów - ![]()
)
l) Mn(NO3)2 ![]()
(sól słabej zasady ![]()
oraz mocnego kwasu ![]()
)
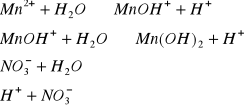
Odczyn roztworu: kwaśny (obecność jonów - ![]()
)
m) Na2CO3 ![]()
(sól mocnej zasady NaOH oraz słabego kwasu ![]()
)
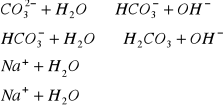
n) KHCO3![]()
(sól mocnej zasady KOH oraz słabego kwasu ![]()
)
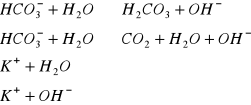
Odczyn roztworu: zasadowy (obecność jonów - ![]()
)
o) Fe(NO3)2 ![]()
(sól słabej zasady ![]()
oraz mocnego kwasu ![]()
)
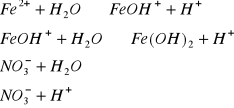
Odczyn roztworu: kwaśny (obecność jonów - ![]()
)
Podaj przykłady tlenków: zasadowych , kwasowych, obojętnych, amfoterycznych.
a) zasadowe: ![]()
, ![]()
, ![]()
b) kwasowe: ![]()
, ![]()
, ![]()
c) obojętne: CO, NO
d) amfoteryczne: ZnO, SnO, PbO
Wymień mocne kwasy i mocne zasady
mocne kwasy: ![]()
mocne zasady: ![]()
, ![]()
Napisz równania dysocjacji : H2SO4, HClO4, HNO2, H3PO4, Mg(OH)2, Ca(OH)2, KOH. (umownie - kwasy mocne i zasady mocne są całkowicie zdysocjowane, słabe kwasy i zasady dysocjują stopniowo)
a) H2SO4![]()
b) HClO4![]()
c) HNO2![]()
d) H3PO4![]()
- dysocjacja stopniowa
![]()
![]()
e) ![]()
dysocjacja stopniowa
![]()
f) Ca(OH)2![]()
g) KOH![]()
Jak stosując tylko roztwór NaOH rozróżnić kationy (podaj efekty wizualne oraz równania reakcji (jonowo i cząsteczkowo).W równaniach cząsteczkowych jako anionu odpowiednich soli podanych kationów użyj anionu azotanowego (V)
Mg2+
![]()
![]()
biały osad
![]()
![]()
NH4+
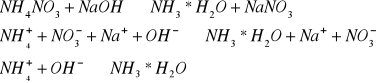
Fe+3
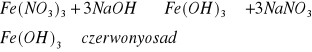
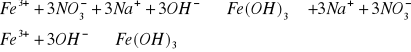
Zn2+
![]()
![]()
biały osad
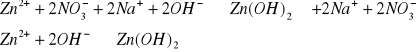
Fe2+
![]()
![]()
osad zielony
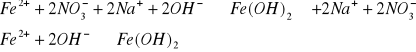
Al3+
![]()
![]()
osad biały
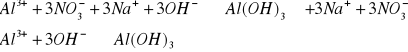
Ag+
![]()
![]()
brunatny osad
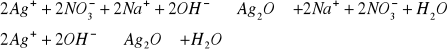
Cu2+
![]()
![]()
niebieski osad
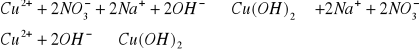
Ca2+
![]()
![]()
biały osad
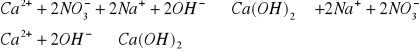
K+
![]()
brak reakcji
K+
![]()
brak reakcji
NH4+
![]()
brak reakcji
Mg2+
![]()
![]()
biały osad
![]()
![]()
Zn2+
![]()
![]()
biały osad
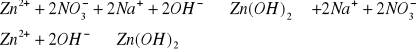
Mn2+
![]()
![]()
osad cielisty
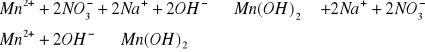
Podaj tok postępowania (w tym efekty wizualne i reakcje: zapis jonowy i cząsteczkowy), który prowadzi do wykrycia w badanym roztworze kationu:
W reakcjach cząsteczkowych jako “źródło” kationu w roztworze wykorzystaj azotan (V) odpowiedniego kationu.
a) Zn2+
1) ![]()
brak osadu
2) ![]()
![]()
3) ![]()
![]()
- osad się rozpuszcza
4) Reakcja charakterystyczna:
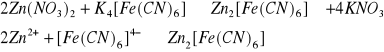
biało kremowy osad
b) Al3+
1) ![]()
brak reakcji, osadu.
2) 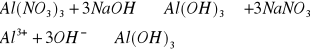
3) 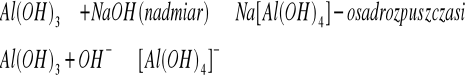
4) Reakcja charakterystyczna:
![]()
brak reakcji
c) Mn2+
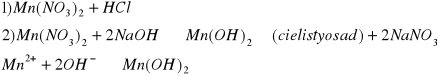
d) Ba2+
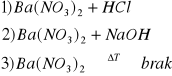
4) Próba płomieniowa - płomień zielony
lub
![]()
biały osad
![]()
e) NH4+
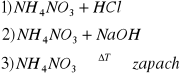
f) Ca2+
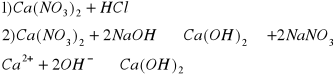
biały osad
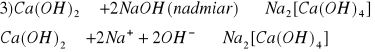
osad nie rozpuszcza się
4) Reakcja charakterystyczna:
![]()
g) K+
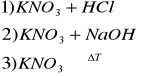
4) Reakcja charakterystyczna:
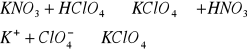
biały osad
h) Mg2+
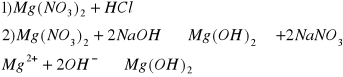
biały osad
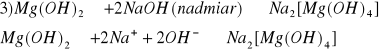
osad nie rozpuszcza się
4) Reakcja charakterystyczna:
![]()
i) Fe3+
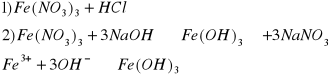
czerwony osad
j) Fe2+
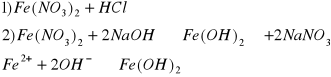
zielony osad
k) Cu2+
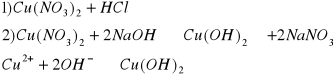
niebieski osad
Podaj sposób rozróżnienia w parach następujących kationów (uwaga reakcja rozróżniająca dla obu kationów powinna być napisana z tym samym odczynnikiem). Napisz odpowiednie reakcje jonowo i cząsteczkowo i określ ich efekty wizualne. Podaj nazwy produktów reakcji.
Zn2+ i Al3+
Reakcja charakterystyczna:
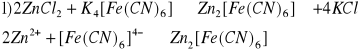
białokremowy osad, heksacyjanożelazian(II) cynku
![]()
b) Ca2+ i Cu2+
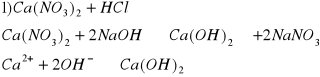
biały osad, diwodorotlenek wapnia
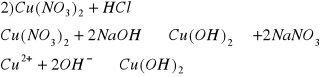
niebieski osad, diwodorotlenek miedzi (II)
c) Ca2+ i Mg2+
próba płomieniowa - ![]()
- czerwony płomień
d) K+ i NH4+
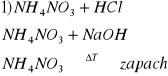
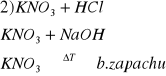
e) Ag+ i Fe2+
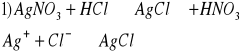
biały osad, chlorek srebra (I)
![]()
f) Zn2+ i Mn2+
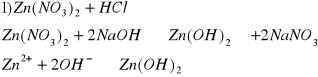
biały osad, diwodorotlenek cynku (II)
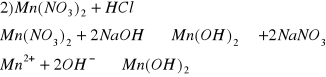
cielisty osad, diwodorotlenek manganu (II)
g) Zn2+ i Mg2+
![]()
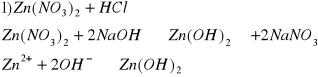
biały osad, diwodorotlenek cynku (II)
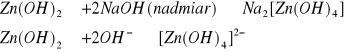
osad rozpuszczony,
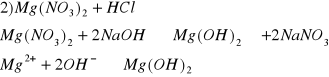
biały osad, diwodorotlenek magnezu (II)
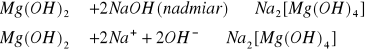
osad nie rozpuszcza się, tetrahydroksomagnezian(II) sodu
Dokończ równania reakcji (tam gdzie one przebiegają). Podaj ich skrócony zapis jonowy.
a) 2NaOH + H2SO4→![]()
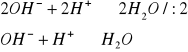
Δ
b) NH4Cl + NaOH →![]()
![]()
c) CuSO4 + 2NaOH→![]()
![]()
d) ![]()
![]()
e) Na2SiO3 +2 HNO3→2![]()
![]()
f) NaHCO3 + HCl →![]()
![]()
g) AgNO3 + HNO3→[?]
h) AgNO3 + HCl→![]()
![]()
i) Pb(OH)2![]()
+ 2NaOH→![]()
![]()
j) Pb(OH)2 ![]()
+2 HNO3→![]()
![]()
k) CaCl2 + Na2C2O4→![]()
![]()
l) MgCl2+ Na2C2O4→![]()
![]()
m) 2KCl + Na2SO4→
o) Mg (NO3)2 + 2NaOH →![]()
![]()
p) CaCO3![]()
+ 2HNO3 →![]()
![]()
r) KCl + HClO4 →
s) AgCl ↓ + 2NH3 . H2O →![]()
![]()
t) 4FeCl3 + 3K4[Fe(CN)6] →![]()
(chyba brak reakcji, wszystko się rozpuszcza, brak osadu)?
u) Zn(OH)2↓ + 4NH3 . H2O →![]()
![]()
![]()
[W hydrolizie soli rozpisuje się jony pochodzące od słabych zasad i kwasów.
W dysocjacji rozpisuje się na jony mocne kwasy i mocne zasady, słabych nie.]
Pytania 3.1.1., pytanie 3.1.2, pytanie 3.1.3, pytanie 3.1.4. i pytanie 3.1.5 str 49 podręczmik do cwiczeń “Cwiczenia z chemii nieorganicznej i analitycznej”
tetrahydroksocynkan (II) sodu