SPRAWOZDANIE NR 1
data sporządzenia:
|
wykonujący:
|
|
tytuł ćwiczenia: |
rozdział substancji |
|
opiekun grupy |
|
|
data przyjęcia
|
data oddania sprawozdania |
data przyjęcia sprawozdania poprawionego:
|
data ostatecznego zaliczenia sprawozdania:
|
ocena |
|
SPIS TREŚCI
Część I - Doświadczenie I |
|
|
Część teoretyczna |
Str. 2 |
|
Opracowanie wyników |
Str. 4 |
|
CZĘŚĆ II - Pokazy doświadczeń - metody rozdzielania substancji |
||
Pokaz I Destylacja prosta wodnego roztworu chlorku miedzi (II). |
Str. 7 |
|
Pokaz II Sublimacja jodu. |
Str. 7 |
|
Pokaz III Ekstrakcja ciągła barwników z liści mlecza za pomocą roztworu etanolu. |
Str. 8 |
|
Bibliografia |
Str. 9 |
|
CZĘŚĆ I - Doświadczenie 1.
CZĘŚĆ TEORETYCZNA
Temat: Rozdział substancji metodą chromatografii.
Cel: Rozdział na drodze chromatografii cienkowarstwowej TLC składników soku z cytryny
i soku z kiwi. Identyfikacja kwasu askorbinowego w soku z cytryny i soku z kiwi.Osiągnięte efekty kształcenia:
CH1_W05.3:
3. opisanie wybranych metod oczyszczania i rozdziału związków chemicznych występujących zarówno w układach jedno- jak i wielofazowych
CH1_W05.6:
1. dopasowanie odpowiedniego szkła laboratoryjne do podstawowych prac laboratoryjnych
(np. wykonanie roztworu o określonym stężeniu, wykonanie roztworu buforowego, synteza
i oczyszczanie ciała stałego itp.)
2. wybór do pracy odpowiednich urządzeń laboratoryjnych
4. interpretację wyników doświadczalnych
CH1_W07:
Student:
1. dysponuje wiedzą z zakresu BHP pozwalająca na bezpieczną pracę w laboratorium chemicznym
2. potrafi omówić oznakowanie substancji chemicznych
3. potrafi wymienić środki ochrony osobistej
4. potrafi przedstawić sposoby udzielania pierwszej pomocy w nagłych wypadkach
5. potrafi omówić przepisy przeciwpożarowe obowiązujące na Wydziale Chemii oraz wskazać drogi ewakuacji
6. potrafi wyjaśnić, w jaki sposób powinno się odpowiedzialnie używać niebezpiecznych związków chemicznych oraz w szczególności potrafi przedstawić zasady ich utylizacji
CH1_U07:
Student: 1. potrafi zastosować przepisy z zakresu BHP pozwalające na bezpieczną pracę
w laboratorium
2. potrafi posługiwać się oznaczeniami substancji chemicznych
3. potrafi stosować środki ochrony osobistej
4. potrafi udzielić pierwszej pomocy w nagłych wypadkach
5. potrafi zastosować się do przepisów przeciwpożarowych obowiązujących na Wydziale Chemii
6. potrafi odpowiedzialnie używać związków chemicznych oraz potrafi je ich selekcjonować odpowiednio do sposobów utylizacji
CH1_U03:
Student:
1. posiada umiejętność zastosowania edytora tekstu do napisania sprawozdania
z przeprowadzonych w laboratorium doświadczeń
CH1_K05:
Student dba o jakość i staranność zarówno podczas wykonywania zadań na zajęciach laboratoryjnych, jak i podczas opisywania ich wyników w zeszycie laboratoryjnym oraz
w sprawozdaniach
Wstęp teoretyczny:
Pierwiastek chemiczny to zbiór atomów o takiej samej liczbie atomowej
Związek chemiczny to jednorodne połączenie co najmniej dwóch różnych pierwiastków chemicznych za pomocą dowolnego wiązania
Mieszaniny jednorodne (homogeniczne) to takie których składniki są bardzo silnie rozdrobnione - najczęściej do pojedynczych cząsteczek, a składników nie jesteśmy w stanie rozróżnić “gołym okiem”.
Mieszaniny niejednorodne (heterogeniczne) to takie których składniki są rozdrobnione słabo, zawierają one duże zespoły cząsteczek. W takiej mieszaninie co najmniej jeden składnik możemy rozróżnić “gołym okiem”
Faza to forma występowania materii, jednolita w całej objętości pod względem składu chemicznego i właściwości fizycznych
Azeotropia to zjawisko związane z przebiegiem destylacji pewnych lotnych mieszanin ciekłych, skrajnie odbiegających od stanu doskonałego, polegające na tym, że przy określonym składzie ilościowym mieszaniny te wrą bez zmiany składu. W związku z tym nie można ich rozdzielić na drodze destylacji
Chromatografia to proces rozdzielania substancji odbywający się na granicy dwóch faz: fazy stacjonarnej (nośnika, adsorbentu) i fazy ruchomej (eluentu).
Najczęściej stosowane nośniki:
żel krzemionkowy,
tlenek glinowy,
węgiel aktywny
celuloza
Najczęściej stosowane eluenty to
aceton
acetonitryl
chlorek metylenu
chloroform
etanol
metanol
tetrahydrofuran
toluen
woda
hel
wodór
Prędkość ruchu poszczególnych składników rozdzielanej mieszaniny jest zależna od oddziaływań międzycząsteczkowych między związkami chemicznymi obecnymi w analizowanej próbce a fazą rozdzielczą i eluentem.
Chromatografia może służyć również do identyfikacji związków zawartych w mieszaninie. Identyfikacja oznacza tu stwierdzenie, że badana substancja jest identyczna z inną substancją przyjętą za wzorzec.
OPRACOWANIE WYNIKÓW:
Sprzęt:
Kapilara,
Zakręcane słoiki,
Pęseta,
Odczynniki:
Roztwór kwasu askorbinowego , stężenie 0,01 mol/dm3,
jod krystaliczny
roztwór acetonu
Przebieg doświadczenia:
Na środku szerokości płytki TLC, w odległości ok. 1,5 cm od krótszego brzegu naniosłam za pomocą kapilary roztwór wzorcowy kwasu askorbinowego, tak aby utworzył plamkę
o średnicy 4-6 mm. Zaznaczyłam ołówkiem wysokość naniesienia roztworu na brzegu płytki. Wysuszyłam i wstawiłam płytkę do słoika z układem rozwijającym - acetonem, miejscem naniesienia roztworu badanego do dołu. Po rozwinięciu chromatogramu wyjęłam płytkę ze słoika, zaznaczyłam delikatnie ołówkiem czoło fazy ruchomej i odparowałam pod dygestorium składniki fazy ruchome. Następnie wstawiłam płytkę do słoika z kilkoma kryształkami jodu. Po pojawieniu się na płytce zabarwienia wyjęłam płytkę ze słoika za pomocą pęsety
i położyłam na ręczniku papierowym. Obrysowałam miękkim ołówkiem widoczną plamkę
i zaznaczyłam punkt na jej środku. Zmierzyłam odległości od punktu naniesienia do środka barwnej plamki oraz od punktu naniesienia do czoła fazy ruchomej.
Powyższe czynności powtórzyłam na osobnych płytkach dla soku z cytryny i skoku z kiwi.

Wyniki:Barwa wybarwionych plam
Podobna wartość współczynnika opóźnienia
Warunki oznaczenia (zastosowany układ, ten sam eluent i faza stacjonarna, temperatura otoczenia, ciśnienie)
Barwa wybarwionych plam
Wartość współczynnika opóźnienia
Warunki oznaczenia (zastosowany układ, ten sam eluent i faza stacjonarna, temperatura otoczenia, ciśnienie)
Wstęp teoretyczny
Przebieg doświadczenia
Wstęp teoretyczny:
Przebieg:
Wstęp teoretyczny:
Przebieg doświadczenia:
Płytka 1 |
Czynnik wywołujący: Jod |
Roztwór nanoszony na płytkę: |
Roztwór kwasu askorbinowego , stężenie 0,01 mol/dm3, |
Barwa plam uwidocznionych związków:
|
żółta |
Wartość współczynnika Rf: |
|
Substancja chemiczna:
|
kwas askorbinowy |
Wzór strukturalny:
|
|
Płytka 2 |
|
Czynnik wywołujący: |
jod |
Roztwór nanoszony na płytkę: |
sok z cytryny
|
Barwa plam uwidocznionych związków:
|
żółta |
Wartości współczynników Rf uwidocznionych związków: |
|
Wynik porównania z chromatogramem wzorca: |
|
Nazwa wykrytej substancji:
Przesłanki identyfikacji (wymień w punktach):
|
Kwas askorbinowy
|
Płytka 3 |
|
Czynnik wywołujący: |
jod |
Roztwór nanoszony na płytkę: |
sok z kiwi
|
Barwa plam uwidocznionych związków: |
żółta |
Wartości współczynników Rf uwidocznionych związków: |
|
Wynik porównania z chromatogramem wzorca: |
|
Nazwa wykrytej substancji:
Przesłanki identyfikacji (wymień w punktach):
|
Kwas askorbinowy
|
CZĘŚĆ II - Pokazy doświadczeń - metody rozdzielania substancji
POKAZ I Destylacja prosta wodnego roztworu chlorku miedzi (II).
Destylacja to proces stosowany do oczyszczania cieczy z niewielkich zanieczyszczeń lub do rozdzielania mieszaniny kilku cieczy.
W procesie destylacji przeprowadza się ciecz w parę w wyniku ogrzewania jej do wrzenia. Powstałe opary kieruje się do chłodnicy gdzie ulegają skropleniu i następnie są zbierane w odbieralniku.
Destylacja możliwa jest jedynie w przypadku, gdy składniki mieszaniny wykazują znaczną różnicę lotności, czyli jednocześnie temperatury wrzenia. W przypadku gdy różnica ta jest niewielka należy przeprowadzać rektyfikację, zwaną także destylacją frakcyjną, polegającą na wielu kolejnych destylacjach przeprowadzanych w specjalnych zestawach.
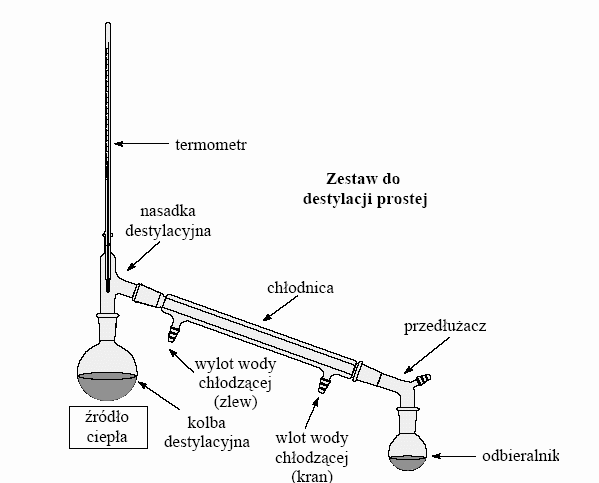
Do destylacji cieczy można stosować chłodnice powietrzną - dla cieczy wrzących powyżej 120OC lub chłodnicę wodną - dla cieczy wrzących poniżej 120OC. Dodatkowo stosujemy zasadę: im bardziej lotna ciecz tym dłuższą chłodnicę stosujemy w trakcie destylacji.
W kolbie destylacyjnej umieszczono destylowany wodny roztwór chlorku miedzi (II) i kamyczki wrzenie. Kolbę ogrzewano za pomocą płaszcza grzejnego. Po ogrzaniu do ok. 100OC Z roztworu w postaci pary zaczęła ulatniać się woda. Jej pary przeszły przez chłodnicę Liebiega, gdzie uległy skropleniu i spłynęły do odbieralnika. Po zakończeniu procesu w kolbie destylacyjnej znajdował się oczyszczona ciecz wyczerpana - chlorek miedzi (II) zaś w odbieralniku destylat- woda. Rys.1 Zestaw do destylacji prostej
POKAZ II Sublimacja jodu.
Sublimacja to proces przejścia ze stanu stałego do gazowego z pominięciem fazy ciekłej. Można ją stosować w celu oddzielenia substancji sublimującej od niesublimującej. Przykładowe substancje sublimujące to jod, antracen, naftalen, chlorek amonu.
W suchej zlewce o poj. 100cm3 umieszczono mieszaninę jodu i piasku. Zlewkę przykryto kolbą okrągłodenną wypełnioną do ¾ zimną wodą. Zlewkę ogrzewano płomieniem palnika gazowego.
W trakcie ogrzewania w zlewce pojawiły się fioletowe pary gazowego jodu. Po zaprzestaniu ogrzewania na dnie kolby okrągłodennej pojawiły się srebrzyste kryształki jodu. W zlewce pozostał oczyszczony z jodu piasek.
POKAZ III Ekstrakcja ciągła barwników z liści mlecza za pomocą roztworu etanolu.
Ekstrakcja to proces wydzielania składnika z roztworu lub mieszaniny stałej (surówki) rozpuszczalnikiem (ekstrahentem) nie mieszającym się z rozpuszczalnikiem ekstrahowanego roztworu.
Ekstrakcje z roztworu można prowadzić w sposób okresowy, posługując się rozdzielaczem stożkowym lub w sposób ciągły w odpowiednich zestawach. Ekstrakcja ciągła jest bardziej skuteczna w przypadku ekstrahowania składnika z mieszaniny stałej. Nawet w przypadku stosowania ekstrakcji nieciągłej zaleca się ekstrahowanie kilkukrotne, niewielkimi porcjami ekstrahenta,
i połączenie uzyskanych ekstraktów.
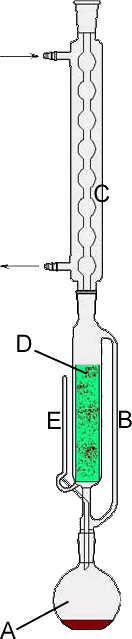
Przykładem zestawu do ekstrakcji ciągłej jest aparat Soxhleta.
Do ekstrakcji barwników z liści mlecza za pomocą etanolu zastosowano aparat Soxhleta (Rysunek 1.). Liście mlecza umieszczono w nasadce Soxhleta D. Następnie kolbę okrągłodenną A wypełniono etanolem do 2/3 wysokości.. Kolbe umieszczono
w płaszczu grzejnym. Na skutek ogrzewania, powstające pary rozpuszczalnika przechodziły przez rurkę B, a następie w chłodnicy zwrotnej C uległy skropleniu. Skroplony rozpuszczalnik spływał do nasadki Soxhleta D, powoli go wypełniając, co skutkowało ekstrakcją związków z substancji. W momencie, kiedy poziom skroplonego rozpuszczalnika osiągnął poziom wyższy od wysokości rurki E (tzw. syfon) został on z powrotem automatycznie spuszczony do kolby A. Nasadka napełniała się ponownie czystym rozpuszczalnikiem i proces zachodził na nowo. Po zakończeniu doświadczenia, liście mlecza straciły częściowo zieloną barwę w skutek wyekstrahowania większości barwników, zaś etanol zabarwił się na zielono.
Rys. 2. Aparat Soxhleta
BIBLIOGRAFIA:
http://www.vmc.org.pl/index.php/dowiadczalna/item/207-ekstrakcja-metod%C4%85-soxhleta
M. Modzelewski, J. Woliński, „Pracownia chemiczna. Techniki laboratoryjne.”
Rysunek pochodzi ze strony: http://www.staff.amu.edu.pl/~wlodgal/f-cwiczenie%202.pdf
Rysunek pochodzi ze stony internetowej: http://www.vmc.org.pl/index.php/dowiadczalna/item/207-ekstrakcja-metod%C4%85-soxhleta
Sprawozdanie nr 2
rozdział substancji Strona 1
Sprawozdanie nr 1 Marta Szymańska
Strącanie soli trudno rozpuszczalnej w wodzie Strona 5
Wyszukiwarka
Podobne podstrony:
Sprawozdanie 1 - Strącanie osadów, Chemia Medyczna, Laboratorium
Sprawozdanie 3 Związki kompleksowe, Chemia Medyczna, Laboratorium
sprawozdanie 1 rozdzielanie substanji
SPRAWOZDANIE 8.5, STUDIA, semestr 4, Chemia fizyczna, Laboratorium
chemia, CHROMATOGRAFIA, CHROMATOGRAFIA- opiera się na zjawisku selektywnej adsorpcji rozdzielanych s
sprawozdanie analityczna, Technologia chemiczna, Chemia analityczna, Laboratorium
sprawozdanie kompleksy, Chemia Medyczna, Chemia fizyczna
sprawozdanie spektro, Technologia chemiczna, Chemia analityczna, laboratorium
Wzór sprawozdania chemfiz lab, Inżynieria środowiska, inż, Semestr III, Chemia fizyczna, laboratoriu
Sprawozdanie 10.1, Semestr 1, Chemia laboratorium, chemia budowlana sprawozdania, Chemia Budowlana
Łączenie i rozdzielanie substancji chemicznych, NAUKA, +Chemia
WZÓR SPRAWOZDANIA, Studia - Chemia kosmetyczna UŁ, II rok, IV semestr, CHEMIA FIZYCZNA laboratorium
Wzór sprawozdania - chemog dzienne lab, Inżynieria środowiska, inż, Semestr II, Chemia ogólna, labor
wyznaczanie izoterm adsorbcji substancji powierzchniowo czynnych, Chemia fizyczna, laboratorium, Che
Chemia medyczna wykład 1
instrukcja - HYDROLIZA SOLI, Inżynieria środowiska, inż, Semestr II, Chemia ogólna, laboratorium
pHmetr-instrukcja obsługi, Inżynieria środowiska, inż, Semestr II, Chemia ogólna, laboratorium
więcej podobnych podstron