Robert Maniura
Sprawozdanie z ćwiczenia nr 27: Katalityczny rozkład nadtlenku wodoru - H2O2.
Wyniki ćwiczenia:
L.p. |
Czas t [s] |
|
|
|
|
|
1 |
60 |
0,9 |
0,6 |
0,55 |
0,55 |
0,75 |
2 |
120 |
1,2 |
0,75 |
0,75 |
0,8 |
1,1 |
3 |
180 |
1,4 |
1,2 |
1,1 |
1,1 |
1,2 |
4 |
240 |
1,9 |
1,65 |
1,35 |
1,4 |
1,4 |
5 |
300 |
2,4 |
2,1 |
1,65 |
1,55 |
1,5 |
6 |
360 |
3,1 |
2,45 |
1,95 |
1,95 |
1,65 |
7 |
420 |
3,55 |
2,8 |
2,35 |
2,1 |
1,75 |
8 |
480 |
4,4 |
3,25 |
2,7 |
2,3 |
1,95 |
9 |
540 |
5,1 |
3,75 |
3,1 |
2,45 |
2,2 |
10 |
600 |
5,6 |
4,1 |
3,45 |
2,65 |
2,35 |
11 |
660 |
6,3 |
4,55 |
3,8 |
2,85 |
2,6 |
12 |
720 |
6,8 |
5,1 |
4,2 |
3,1 |
2,8 |
13 |
780 |
7,35 |
5,45 |
4,6 |
3,35 |
2,95 |
14 |
840 |
8,1 |
6,45 |
4,35 |
3,8 |
3,25 |
15 |
900 |
8,75 |
6,85 |
5,4 |
4,05 |
3,4 |
16 |
960 |
9,3 |
7,15 |
5,75 |
4,3 |
3,55 |
17 |
1020 |
10,05 |
7,65 |
6,1 |
4,65 |
3,65 |
18 |
1080 |
10,6 |
8,15 |
6,45 |
5,1 |
3,8 |
19 |
1140 |
11,4 |
8,5 |
6,8 |
5,35 |
4,1 |
20 |
1200 |
11,85 |
8,85 |
7,25 |
5,6 |
4,25 |
Wstęp teoretyczny:
Katalizatorami nazywamy substancje wpływające na szybkość reakcji, pozostające w niezmienionej ilości po zakończeniu reakcji. Cechą charakterystyczną jest przy tym to, że bardzo małe ilości substancji katalitycznej, w porównaniu z ilościami substratów, mogą mieć bardzo silny wpływ na szybkość reakcji. Inną charakterystyczną własnością katalizatorów jest ich specyficzność. W przypadku katalizy jednorodnej, to jest takiej, gdy układ reagujący i katalizator tworzą jednorodną fazę (może to być na przykład układ gazowy lub roztwór) działanie substancji katalitycznej sprowadza się do obniżenia energii aktywacji. Cząsteczki katalizatora tworzą z reagentami produkty pośrednie, które reagują dalej znacznie łatwiej. Liczne eksperymenty wykazały, że energia aktywacji może się zmieniać pod wpływem katalizatora nawet o 100 i więcej kJ/mol. Szybkość reakcji katalitycznej jest zazwyczaj proporcjonalna do stężenia katalizatora. Jeżeli szybkość reakcji bez katalizatora wyraża równanie:
![]()
to w obecności katalizatora K jej szybkość wyniesie: ![]()
Drugi człon tego równania określa szybkość reakcji katalitycznej, [K] oznacza stężenie katalizatora, a k' stałą szybkości reakcji katalitycznej.
W tym przypadku zakłada się, że reakcja nie zmienia swego rzędu. Są jednak znane przypadki, gdy rząd reakcji zmienia się pod wpływem katalizatora. Dotyczy to w szczególności powolnych reakcji I rzędu, które pod wpływem katalizatora mogą się stać reakcjami II rzędu. Są to jednak przypadki bardzo rzadkie. Równanie na szybkość reakcji można zapisać w postaci:
![]()
w przypadku, gdy stężenie katalizatora jest stałe:![]()
Działanie katalizatora sprowadza się więc do zmiany stałej szybkości reakcji.
Opracowanie wyników:
Ćwiczenie ma na celu badanie kinetyki reakcji rozkładu H2O2 w zależności od zastosowanego katalizatora. Podczas rozkładu H2O2 wydziela się tlen. Pomiaru objętości wydzielającego się tlenu dokonywałam co 1 minutę w ciągu 20 minut. Przeprowadziłam 5 pomiarów - po jednym pomiarze dla każdego katalizatora. Objętość 30 % roztworu nadtlenku wodoru użytego w każdym pomiarze wynosiła 4 cm3. Objętość roztworu katalizatora 0,1 cm3. Stężenie nadtlenku wodoru wyrażam w mol/dm3. Przeliczam stężenie procentowe na molowe. Temperatura otoczenia w dniu pomiaru wynosiła 18 °C. Gęstość 30 % roztworu H2O2 w temperaturze 18 °C, znaleziona w literaturze, wynosi 1,1111 g/cm3. Masa molowa H2O2 jest równa 34,015 g/mol. Wiadomo, że 100 g r-ru H2O2 zawiera 30 g czystego H2O2. Objętość 100 g roztworu H2O2 wynosi: V = 100 [g] / 1,1111 [g/cm3]= 90 cm3.
Ponieważ:
1 mol H2O2 - 34,015 g
x moli H2O2 - 30 g ⇒ x = 0,882 mola H2O2
Zatem:
90 cm3 30% r-ru H2O2 zawiera 0,882 mola H2O2
4 cm3 30% r-ru H2O2 zawiera x mola H2O2 ⇒ x = 0,0392 mola H2O2
Ponieważ do 4 cm3 roztworu H2O2 dodaje się 0,1 cm3 katalizatora, całkowita objętość roztworu wynosi 4,1 cm3. Stężenie początkowe roztworu, wyrażone w mol/dm3, wynosi:
0,0392 mola H2O2 jest zawarte w 4,1 cm3 roztworu
c mola H2O2 jest zawarte w 1000 cm3 roztworu ⇒ c = 9,561 mol/dm3
Podczas rozkładu nadtlenku wodoru zachodzi następująca reakcja: 2 H2O2 2 H2O + O2
Aby wyznaczyć rząd reakcji konieczna jest znajomość stężenia nadtlenku wodoru. W miarę przebiegu reakcji stężenie H2O2 będzie malało. Część nadtlenku wodoru rozłoży się na tlen, którego objętość mierzy się w czasie ćwiczenia. Do dalszych obliczeń dogodne staje się więc wyprowadzenie wzoru, który umożliwia obliczenie stężenia w poszczególnych minutach pomiaru znając stężenie początkowe roztworu nadtlenku wodoru i objętość wydzielonego tlenu.
Przyjmując uproszczenie i traktując tlen jako gaz doskonały z prawa Avogadra wynika, że:
22400 cm3 gazu to 1 mol
VO2 - nO2 პ nO2 = VO2 / 22400
Z równania reakcji wynika, że:
z 2 moli H2O2 powstaje 1 mol O2
a nH2O2 rozłoży się na VO2/22400 პ nH2O2 rozłoż.= 2 VO2 / 22400 = VO2 / 11200
W czasie reakcji ubywa liczba moli H2O2, zatem:
nH2O2 pocz. - nH2O2 rozłoż. = nH2O2 პ nH2O2 = nH2O2 pocz. - (VO2 / 11200)
Objętość roztworu nie zmienia się :
4,1 cm3 roztworu zawiera nH2O2 mola
1000 cm3 roztworu zawiera c mola
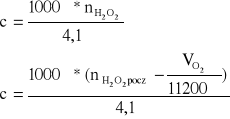
Liczbę moli na początku nH2O2 pocz. można zastąpić stężeniem początkowym:
1000 cm3 roztworu - c pocz.
4,1 cm3 roztworu - nH2O2 pocz. პ nH2O2 pocz. = (4,1 * c pocz. ) / 1000
Po wstawieniu do wzoru znanych wartości dostaję wzór pozwalający obliczyć stężenie nadtlenku wodoru, gdy wydzieliło się VO2 cm3 tlenu:
![]()
Rząd reakcji wyznaczam metodą graficzną. W celu wyznaczenia rzędu reakcji metodą graficzną sprawdzam zależność log c = f(t). Dla reakcji I rzędu charakterystyczna jest liniowa zależność takiej funkcji. W przypadku reakcji rozkładu nadtlenku wodoru taka zależność jest spełniona- reakcja jest I rzędu.
Stałą szybkości reakcji wyznaczam z równania kinetycznego. Równanie kinetyczne dla reakcji I rzędu ma postać: ![]()
po całkowaniu i zmianie logarytmów naturalnych na dziesiętne:
![]()
skąd k wynosi: ![]()
Ponieważ mam do czynienia z małą serią pomiarów średnia wartość stałej szybkości reakcji może znacznie różnić się od wartości prawdziwej. Aby określić błąd występujący w pomiarach określam przedział ufności, w którym wartość rzeczywista znajduje się z dużym prawdopodobieństwem: ၭ = X ± t * s gdzie: X- średnia arytmetyczna; t- wartość funkcji Studenta uzależniona od ilości pomiarów; s- odchylenie standardowe średniej arytmetycznej;
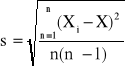
gdzie: Xi - kolejne wyniki; X - średnia arytmetyczna wyników; n - ilość wyników.
Błąd obliczam dla każdej wyznaczonej stałej szybkości reakcji. Przyjmuję poziom istotności a=0,05 dla każdej serii pomiarów.
Seria 1: 0.05m FeCl3 + 0.4m HCl + 0.005m CuCl2
L.p. |
Czast [s] |
Objętość tlenu VO2 [cm3] |
Stężenie H2O2 c [mol/dm3] |
log c |
Stała szybkości k |
1 |
60 |
0,9 |
9,541401 |
0,97961213 |
3,42E-05 |
2 |
120 |
1,2 |
9,534868 |
0,97931467 |
2,28E-05 |
3 |
180 |
1,4 |
9,530512 |
0,97911624 |
1,77E-05 |
4 |
240 |
1,9 |
9,519624 |
0,97861978 |
1,81E-05 |
5 |
300 |
2,4 |
9,508735 |
0,97812275 |
1,83E-05 |
6 |
360 |
3,1 |
9,493491 |
0,97742596 |
1,97E-05 |
7 |
420 |
3,55 |
9,483692 |
0,97697742 |
1,93E-05 |
8 |
480 |
4,4 |
9,465181 |
0,97612893 |
2,1E-05 |
9 |
540 |
5,1 |
9,449937 |
0,97542893 |
2,16E-05 |
10 |
600 |
5,6 |
9,439049 |
0,97492823 |
2,14E-05 |
11 |
660 |
6,3 |
9,423805 |
0,97422629 |
2,19E-05 |
12 |
720 |
6,8 |
9,412916 |
0,9737242 |
2,17E-05 |
13 |
780 |
7,35 |
9,400939 |
0,97317124 |
2,16E-05 |
14 |
840 |
8,1 |
9,384606 |
0,97241606 |
2,22E-05 |
15 |
900 |
8,75 |
9,370451 |
0,9717605 |
2,24E-05 |
16 |
960 |
9,3 |
9,358474 |
0,97120503 |
2,23E-05 |
17 |
1020 |
10,05 |
9,342141 |
0,97044642 |
2,27E-05 |
18 |
1080 |
10,6 |
9,330164 |
0,96988927 |
2,26E-05 |
19 |
1140 |
11,4 |
9,312742 |
0,96907758 |
2,31E-05 |
20 |
1200 |
11,85 |
9,302943 |
0,96862034 |
2,28E-05 |
Średnia wartość stałej szybkości reakcji kśr = 2,19 * 10-5
Wartość odchylenia standardowego s wynosi 0,08 * 10-5.
Przedział ufności wynosi ± 0,17 * 10-5.
kśr = 2,19 * 10-5 ± 0,17 * 10-5
Seria 2: 0.05m FeCl3 + 0.4m HCl + 0.002m CuCl2
L.p. |
Czast [s] |
Objętość tlenu VO2 [cm3] |
Stężenie H2O2 c [mol/dm3] |
log c |
Stała szybkości k |
1 |
60 |
0,6 |
9,547934 |
0,979909399 |
2,28E-05 |
2 |
120 |
0,75 |
9,544667 |
0,979760792 |
1,43E-05 |
3 |
180 |
1,2 |
9,534868 |
0,979314667 |
1,52E-05 |
4 |
240 |
1,65 |
9,525068 |
0,978868082 |
1,57E-05 |
5 |
300 |
2,1 |
9,515268 |
0,978421038 |
1,6E-05 |
6 |
360 |
2,45 |
9,507646 |
0,978073019 |
1,55E-05 |
7 |
420 |
2,8 |
9,500024 |
0,97772472 |
1,52E-05 |
8 |
480 |
3,25 |
9,490225 |
0,977276497 |
1,55E-05 |
9 |
540 |
3,75 |
9,479336 |
0,976777928 |
1,59E-05 |
10 |
600 |
4,1 |
9,471714 |
0,976428589 |
1,56E-05 |
11 |
660 |
4,55 |
9,461915 |
0,975979026 |
1,58E-05 |
12 |
720 |
5,1 |
9,449937 |
0,975428926 |
1,62E-05 |
13 |
780 |
5,45 |
9,442315 |
0,9750785 |
1,6E-05 |
14 |
840 |
6,45 |
9,420538 |
0,974075721 |
1,76E-05 |
15 |
900 |
6,85 |
9,411828 |
0,97367396 |
1,75E-05 |
16 |
960 |
7,15 |
9,405294 |
0,973372395 |
1,71E-05 |
17 |
1020 |
7,65 |
9,394406 |
0,972869322 |
1,72E-05 |
18 |
1080 |
8,15 |
9,383517 |
0,972365665 |
1,74E-05 |
19 |
1140 |
8,5 |
9,375895 |
0,972012757 |
1,72E-05 |
20 |
1200 |
8,85 |
9,368274 |
0,971659562 |
1,7E-05 |
Średnia wartość stałej szybkości reakcji kśr = 1,65 * 10-5
Wartość odchylenia standardowego s wynosi 0,04 * 10-5.
Przedział ufności wynosi ± 0,08 * 10-5.
kśr = 1,65 * 10-5 ± 0,08 * 10-5
Seria 3: 0.05m FeCl3 + 0.4m HCl + 0.001m CuCl2
L.p. |
Czast [s] |
Objętość tlenu VO2 [cm3] |
Stężenie H2O2 c [mol/dm3] |
log c |
Stała szybkości k |
1 |
60 |
0,55 |
9,549023 |
0,979958923 |
2,09E-05 |
2 |
120 |
0,75 |
9,544667 |
0,979760792 |
1,43E-05 |
3 |
180 |
1,1 |
9,537045 |
0,979413845 |
1,39E-05 |
4 |
240 |
1,35 |
9,531601 |
0,979165856 |
1,28E-05 |
5 |
300 |
1,65 |
9,525068 |
0,978868082 |
1,26E-05 |
6 |
360 |
1,95 |
9,518535 |
0,978570104 |
1,24E-05 |
7 |
420 |
2,35 |
9,509824 |
0,978172481 |
1,28E-05 |
8 |
480 |
2,7 |
9,502202 |
0,977824263 |
1,29E-05 |
9 |
540 |
3,1 |
9,493491 |
0,977425956 |
1,31E-05 |
10 |
600 |
3,45 |
9,485869 |
0,977077138 |
1,32E-05 |
11 |
660 |
3,8 |
9,478247 |
0,97672804 |
1,32E-05 |
12 |
720 |
4,2 |
9,469537 |
0,976328726 |
1,34E-05 |
13 |
780 |
4,6 |
9,460826 |
0,975929045 |
1,35E-05 |
|
14 |
840 |
4,35 |
9,46627 |
0,976178889 |
1,19E-05 |
|
15 |
900 |
5,4 |
9,443404 |
0,975128578 |
1,38E-05 |
|
16 |
960 |
5,75 |
9,435782 |
0,974777909 |
1,37E-05 |
|
17 |
1020 |
6,1 |
9,42816 |
0,974426957 |
1,37E-05 |
|
18 |
1080 |
6,45 |
9,420538 |
0,974075721 |
1,37E-05 |
|
19 |
1140 |
6,8 |
9,412916 |
0,9737242 |
1,37E-05 |
|
20 |
1200 |
7,25 |
9,403117 |
0,973271827 |
1,39E-05 |
|
Średnia wartość stałej szybkości reakcji kśr = 1,37 * 10-5
Wartość odchylenia standardowego s wynosi 0,04 * 10-5.
Przedział ufności wynosi ± 0,08 * 10-5.
kśr = 1,37 * 10-5 ± 0,08 * 10-5
Seria 4: 0.05m FeCl3 + 0.4m HCl + 0.0005m CuCl2
L.p. |
Czast [s] |
Objętość tlenu VO2 [cm3] |
Stężenie H2O2 c [mol/dm3] |
log c |
Stała szybkości k |
1 |
60 |
0,55 |
9,549023 |
0,979958923 |
2,09E-05 |
2 |
120 |
0,8 |
9,543578 |
0,979711245 |
1,52E-05 |
3 |
180 |
1,1 |
9,537045 |
0,979413845 |
1,39E-05 |
4 |
240 |
1,4 |
9,530512 |
0,979116241 |
1,33E-05 |
5 |
300 |
1,55 |
9,527246 |
0,978967363 |
1,18E-05 |
6 |
360 |
1,95 |
9,518535 |
0,978570104 |
1,24E-05 |
7 |
420 |
2,1 |
9,515268 |
0,978421038 |
1,14E-05 |
8 |
480 |
2,3 |
9,510913 |
0,978222204 |
1,09E-05 |
9 |
540 |
2,45 |
9,507646 |
0,978073019 |
1,04E-05 |
10 |
600 |
2,65 |
9,503291 |
0,977874025 |
1,01E-05 |
11 |
660 |
2,85 |
9,498936 |
0,977674941 |
9,87E-06 |
12 |
720 |
3,1 |
9,493491 |
0,977425956 |
9,84E-06 |
13 |
780 |
3,35 |
9,488047 |
0,977176829 |
9,82E-06 |
14 |
840 |
3,8 |
9,478247 |
0,97672804 |
1,04E-05 |
15 |
900 |
4,05 |
9,472803 |
0,976478512 |
1,03E-05 |
16 |
960 |
4,3 |
9,467359 |
0,97622884 |
1,03E-05 |
17 |
1020 |
4,65 |
9,459737 |
0,975879059 |
1,04E-05 |
18 |
1080 |
5,1 |
9,449937 |
0,975428926 |
1,08E-05 |
19 |
1140 |
5,35 |
9,444493 |
0,97517865 |
1,08E-05 |
20 |
1200 |
5,6 |
9,439049 |
0,974928231 |
1,07E-05 |
Średnia wartość stałej szybkości reakcji kśr = 1,17 * 10-5
Wartość odchylenia standardowego s wynosi 0,06 * 10-5.
Przedział ufności wynosi ± 0,12 * 10-5.
kśr = 1,17 * 10-5 ± 0,12 * 10-5
Seria 5: 0.05m FeCl3 + 0.4m HCl
L.p. |
Czast [s] |
Objętość tlenu VO2 [cm3] |
Stężenie H2O2 c [mol/dm3] |
log c |
Stała szybkości k |
1 |
60 |
0,75 |
9,544667 |
0,979760792 |
2,85E-05 |
2 |
120 |
1,1 |
9,537045 |
0,979413845 |
2,09E-05 |
3 |
180 |
1,2 |
9,534868 |
0,979314667 |
1,52E-05 |
|
4 |
240 |
1,4 |
9,530512 |
0,979116241 |
1,33E-05 |
|
5 |
300 |
1,5 |
9,528334 |
0,979016995 |
1,14E-05 |
|
6 |
360 |
1,65 |
9,525068 |
0,978868082 |
1,05E-05 |
|
7 |
420 |
1,75 |
9,52289 |
0,978768779 |
9,51E-06 |
|
8 |
480 |
1,95 |
9,518535 |
0,978570104 |
9,28E-06 |
|
9 |
540 |
2,2 |
9,513091 |
0,978321633 |
9,3E-06 |
|
10 |
600 |
2,35 |
9,509824 |
0,978172481 |
8,95E-06 |
|
11 |
660 |
2,6 |
9,50438 |
0,977923782 |
9E-06 |
|
12 |
720 |
2,8 |
9,500024 |
0,97772472 |
8,89E-06 |
|
13 |
780 |
2,95 |
9,496758 |
0,977575364 |
8,64E-06 |
|
14 |
840 |
3,25 |
9,490225 |
0,977276497 |
8,85E-06 |
|
15 |
900 |
3,4 |
9,486958 |
0,977126987 |
8,64E-06 |
|
16 |
960 |
3,55 |
9,483692 |
0,976977424 |
8,46E-06 |
|
17 |
1020 |
3,65 |
9,481514 |
0,976877688 |
8,19E-06 |
|
18 |
1080 |
3,8 |
9,478247 |
0,97672804 |
8,05E-06 |
|
19 |
1140 |
4,1 |
9,471714 |
0,976428589 |
8,23E-06 |
|
20 |
1200 |
4,25 |
9,468448 |
0,976278786 |
8,11E-06 |
|
Średnia wartość stałej szybkości reakcji kśr = 1,11 * 10-5
Wartość odchylenia standardowego s wynosi 0,11 * 10-5.
Przedział ufności wynosi ± 0,23 * 10-5.
kśr = 1,11 * 10-5 ± 0,23 * 10-5
Stężenie katalizatora w poszczególnych pomiarach szybkości rozkładu nadtlenku wodoru- do 4 cm3 H2O2 dodaje się 0,1 cm3 roztworu CuCl2 o stężeniu wyjściowym cwyj.:
1000 cm3 zawiera cwyj. CuCl2
0,1 cm3 - n moli CuCl2 ⇒ n = (cwyj. * 0,1) / 1000
Po zmieszaniu objętość roztworu wynosi 4,1 cm3. Zatem:
4,1 cm3 roztworu zawiera (cwyj. * 0,1) / 1000 mola CuCl2
1000 cm3 roztworu - cCuCl2
![]()
L.p. |
Rodzaj katalizatora |
Objętość dodanego katalizatora [cm3] |
Stężenie katalizatora - CuCl2 w kolbie reakcyjnej [mol/dm3] |
1 |
0,05 M FeCl3, 0,4 M HCl, 0,005 M CuCl2 |
0,1 |
1,22 * 10-4 |
2 |
0,05 M FeCl3, 0,4 M HCl, 0,002 M CuCl2 |
0,1 |
0,49 * 10-4 |
3 |
0,05 M FeCl3, 0,4 M HCl, 0,001 M CuCl2 |
0,1 |
0,24 * 10-4 |
4 |
0,05 M FeCl3, 0,4 M HCl, 0,0005 M CuCl2 |
0,1 |
0,1 * 10-4 |
5 |
0,05 M FeCl3, 0,4 M HCl |
0,1 |
0 |
Zestawienie wyników pomiarów:
L.p. |
Rodzaj katalizatora |
Średnia wartość stałej szybkości reakcji, k [s-1] |
1 |
0,05 M FeCl3, 0,4 M HCl, 0,005 M CuCl2 |
2,19 * 10-5 ± 0,17 * 10-5 |
2 |
0,05 M FeCl3, 0,4 M HCl, 0,002 M CuCl2 |
1,65 * 10-5 ± 0,08 * 10-5 |
3 |
0,05 M FeCl3, 0,4 M HCl, 0,001 M CuCl2 |
1,37 * 10-5 ± 0,08 * 10-5 |
4 |
0,05 M FeCl3, 0,4 M HCl, 0,0005 M CuCl2 |
1,17 * 10-5 ± 0,12 * 10-5 |
5 |
0,05 M FeCl3, 0,4 M HCl |
1,11 * 10-5 ± 0,23 * 10-5 |
Wnioski.
Na podstawie przeprowadzonych pomiarów i obliczeń można stwierdzić, że reakcja rozkładu nadtlenku wodoru jest reakcją I rzędu. Świadczy o tym liniowa zależność dziesiętnego logarytmu ze stężenia c od czasu t. Porównując wyznaczone stałe szybkości reakcji katalizowanej roztworem CuCl2 widać bardzo wyraźny wpływ stężenia katalizatora na szybkość reakcji. Ze wzrostem stężenia katalizatora w układzie reagującym rośnie wartość stałej szybkości reakcji k, czyli rozkład nadtlenku wodoru zachodzi szybciej. Niewielki dodatek katalizatora bardzo wpływa na wzrost stałej szybkości reakcji. Katalityczny rozkład nadtlenku wodoru za pomocą CuCl2 jest przykładem katalizy homogenicznej. Substrat i katalizator jest w tej samej fazie. Katalizator musi wchodzić do jednego z etapów reakcji i odtwarzać się w następnym.
Wykresy.
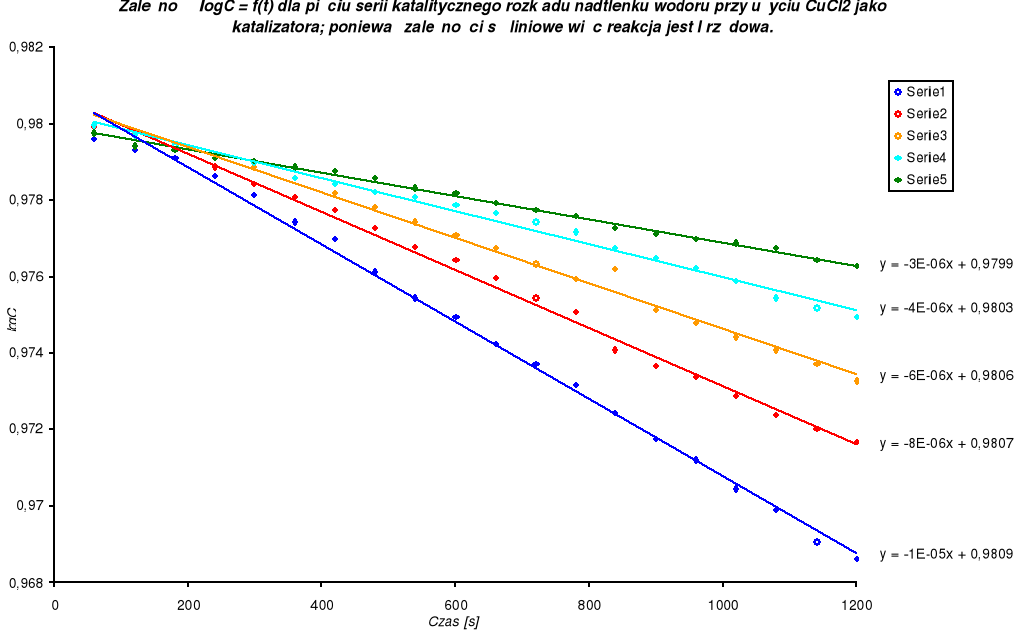
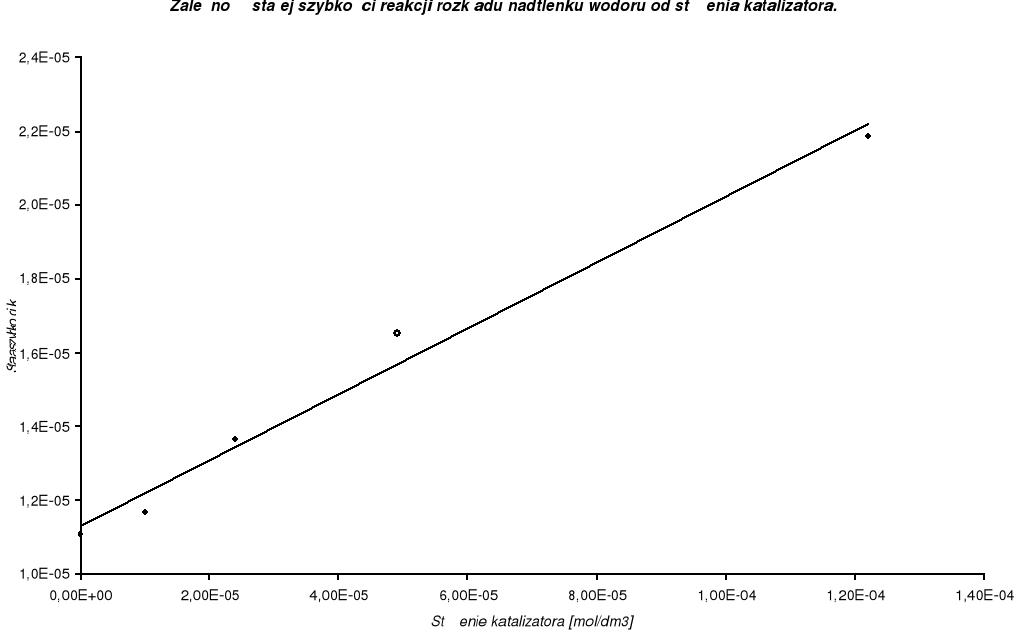
8
Wyszukiwarka
Podobne podstrony:
Katalityczny rozkład nadtlenku wodoru ZUSM (uproszczone)
Katalityczny rozkład nadtlenku wodoru
Katalityczny rozkład nadtlenku wodoru
4 nadtlenek wodoru redoks
08 Katalityczny rozkład
KATALITYCZNY ROZKŁAD WODY UTLENIONEJ, CHEMIA
Wartość rokownicza stężenia nadtlenku wodoru w kondensaW, Ratownictwo Medyczne, wykłady
nadtlenek wodoru, BHP KARTA CHARAKTERYSTYKI SUBSTANCJI NIEBEZPIECZNEJ
NADTLENEK WODORU30, BHP KARTA CHARAKTERYSTYKI SUBSTANCJI NIEBEZPIECZNEJ
katalityczny rozklad wody
Katalityczny rozkład wody utlenionej, Katalityczny rozkład wody utlenionej
4 Nadtlenek wodoru
Katalityczny rozkład wody utlenionej teoria
ĆW4 Oznaczanie nadtlenku wodoru w
więcej podobnych podstron